微管相关蛋白tau在乳腺癌中表达及临床意义的生物信息学分析
2019-06-11赵东怡周恩相李伦杨永萍谢萍芳
赵东怡,周恩相,李伦,杨永萍,谢萍芳
(1.中南大学湘雅二医院 乳甲外科,湖南 长沙 410011;2.复旦大学肿瘤研究所,上海 200433;3.辽宁省丹东市妇幼保健医院 妇科,辽宁 丹东 118000)
近年来,乳腺癌的发病率迅速增长,无论是发达国家还是发展中国家,乳腺癌都是女性目前最为常见的癌症。根据全球肿瘤流行病统计数据,2018年全球乳腺癌新发病例数为2088849例,乳腺癌的发病率和病死率都跃居女性恶性肿瘤中的首位[1]。在我国,乳腺癌也是女性发病率最高的恶性肿瘤,据我国癌症中心公布的最新数据表明,我国女性乳腺癌年发病例数可达30.4万例,死亡例数约3.1万例,严重威胁着女性的健康[2-4]。目前乳腺癌的主要治疗方法是以手术为主的综合治疗[5-6],虽然乳腺癌的诊疗水平不断提高,但乳腺癌的复发、放化疗等治疗对机体的毒副作用和综合治疗的高额费用仍给患者带来了躯体和心理的双重影响,同时也给家庭和社会带来了巨大的经济负担。
微管相关蛋白tau(microtubule-associated protein tau,MAPT)是细胞内纺锤体的主要构成部分,是一种微管相关蛋白,其编码基因位于17q21.3,包括15个外显子,可促进细胞骨架微管的聚合、稳定,调节微管蛋白动力学变化,首次被报道是在关于阿尔兹海默病的研究中,与神经系统退行性疾病有关[7]。有研究[8]表明,MAPT表达在乳腺癌中有一定意义。目前乳腺癌中MAPT表达的临床意义的研究尚不全面,本研究使用生物信息学的方法,分析乳腺癌中MAPT的表达情况,对MAPT预测乳腺癌耐药、预后进行探究,为乳腺癌的预防和治疗提供新的思路。
1 材料与方法
1.1 数据来源及研究内容
基于TCGA数据库(https://cancergenome.nih.gov)和bc-GenExMiner数据库(http://bcgenex.centregauducheau.fr)中乳腺癌组织及正常乳腺组织的测序结果,分析MAPT在正常乳腺组织与乳腺癌组织中的表达情况,分析不同临床分期、月经状态、分子分型的乳腺癌组织中MAPT的表达差异。基于GEO数据库(https://www.ncbi.nlm.nih.gov/geoprofiles),以“MAPT+BREAST+RESISTANCE”为关键词进行检索,收集关于MAPT与化疗耐药、内分泌耐药及靶向治疗耐药的数据集,分析MAPT与乳腺癌化疗、内分泌和靶向治疗耐药之间的关系。从Kaplan Meier Plotter数据库(http://kmplot.com/analysis)中获取有关乳腺癌预后的相关数据,分析MAPT在不同分子分型乳腺癌中与总生存期(overall survival,OS)和无复发生存期(recurrence-free survival,RFS)之间的关系,绘制Kaplan-Meier曲线。
1.2 统计学处理
使用SPSS Statistics 21软件对数据进行t检验或t'检验,统计检验均采用双侧检验,P<0.05为差异具有统计学意义。数据以均数±标准差(±s)或中位数(四分位数间距)[M(IQR)]来表示。
2 结 果
2.1 MAPT在正常乳腺组织及乳腺癌组织中的表达情况
对TCGA中1097例乳腺癌和114例正常乳腺组织的数据进行分析,发现MAPT在正常乳腺组织中表达水平为17.964(13.532~25.455),在乳腺癌组织中表达水平为25.768(4.77~58.728),其在乳腺癌组织中表达高于正常乳腺组织(P<0.01)。分析不同的分子分型乳腺癌中MAPT表达水平,566例Luminal型乳腺癌中MAPT表达水平为34.612(13.720~66.167),高于正常乳腺癌组织(P<0.01),37例HER-2型乳腺癌组织中表达水平为1.882(0.909~6.136),116例三阴型乳腺癌(triple-negative breast cancer,TNBC)组织中表达水平为1.013(0.496~2.623),均低于正常乳腺癌组织(均P<0.01)。分析其在不同临床分期乳腺癌中表达水平,183例I期乳腺癌组织中MAPT表达水平为41.311(11.196~69.101),在615例II期乳腺癌中表达水平为23.152(3.507,59.974),在247例III期乳腺癌中表达水平为21.817(6.445~46.555),20例IV期乳腺癌组织中表达水平为13.861(5.877~22.036),I、II、III期乳腺癌中MAPT的表达均高于正常乳腺癌组织(均P<0.01),II、III、IV期乳腺癌组织中MAPT表达均高于I期乳腺癌(均P<0.05)。IV期乳腺癌和正常乳腺癌组织中表达无统计学差异(P>0.05)。230例绝经前乳腺癌中表达水平为29.106(4.934~58.015)、700例绝经后乳腺癌中表达水平为23.837(5.014~59.210),绝经前患者和绝经后患者癌组织中MAPT的表达均高于正常乳腺组织(P<0.05)(图1)。
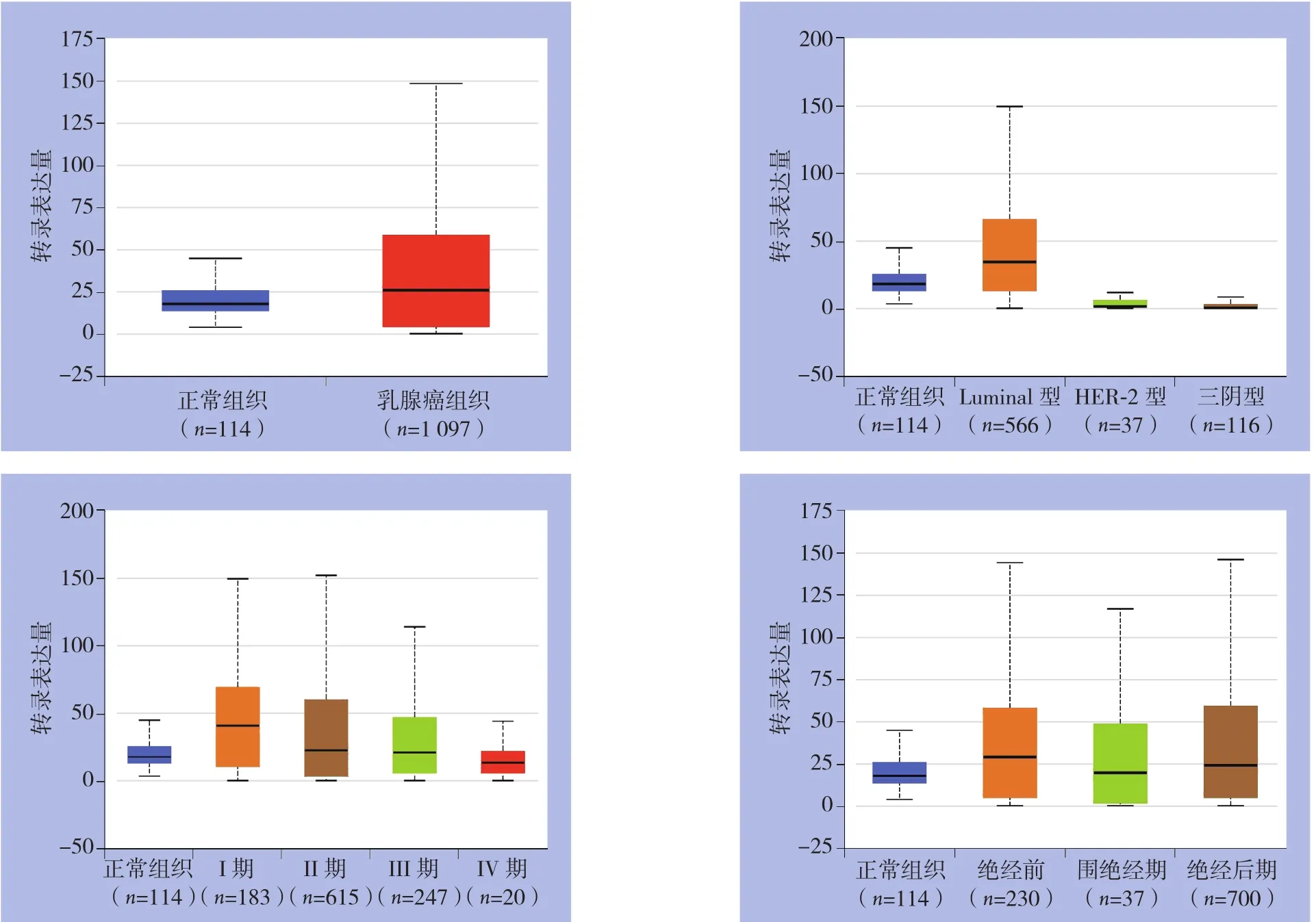
图1 MAPT在乳腺癌中表达情况Figure1 Expressions of MAPT in breast cancer
分析bc-GenExMiner数据库中1525例ER阴性乳腺癌、3923例ER阳性乳腺癌、946例PR阴性乳腺癌和1439例PR阳性乳腺癌发现,MAPT在ER、PR阳性乳腺癌中表达量明显高于ER、PR阴性乳腺癌,两者差异具有统计学意义(均P<0.0001)。分析Ki-67高表达的2672例乳腺癌和Ki-67低表达的2673例乳腺癌中MAPT转录表达量,发现Ki-67低表达乳腺的MAPT表达水平较Ki-67高表达的乳腺癌高,两者差异具有统计学意义(P<0.0001)。对201例HER-2阳性乳腺癌和1409例HER-2阴性乳腺癌进行分析,发现HER-2阳性乳腺癌的MAPT表达量明显低于HER-2阴性乳腺癌,两者差异也具有统计学意义(P<0.0001)(图2)。
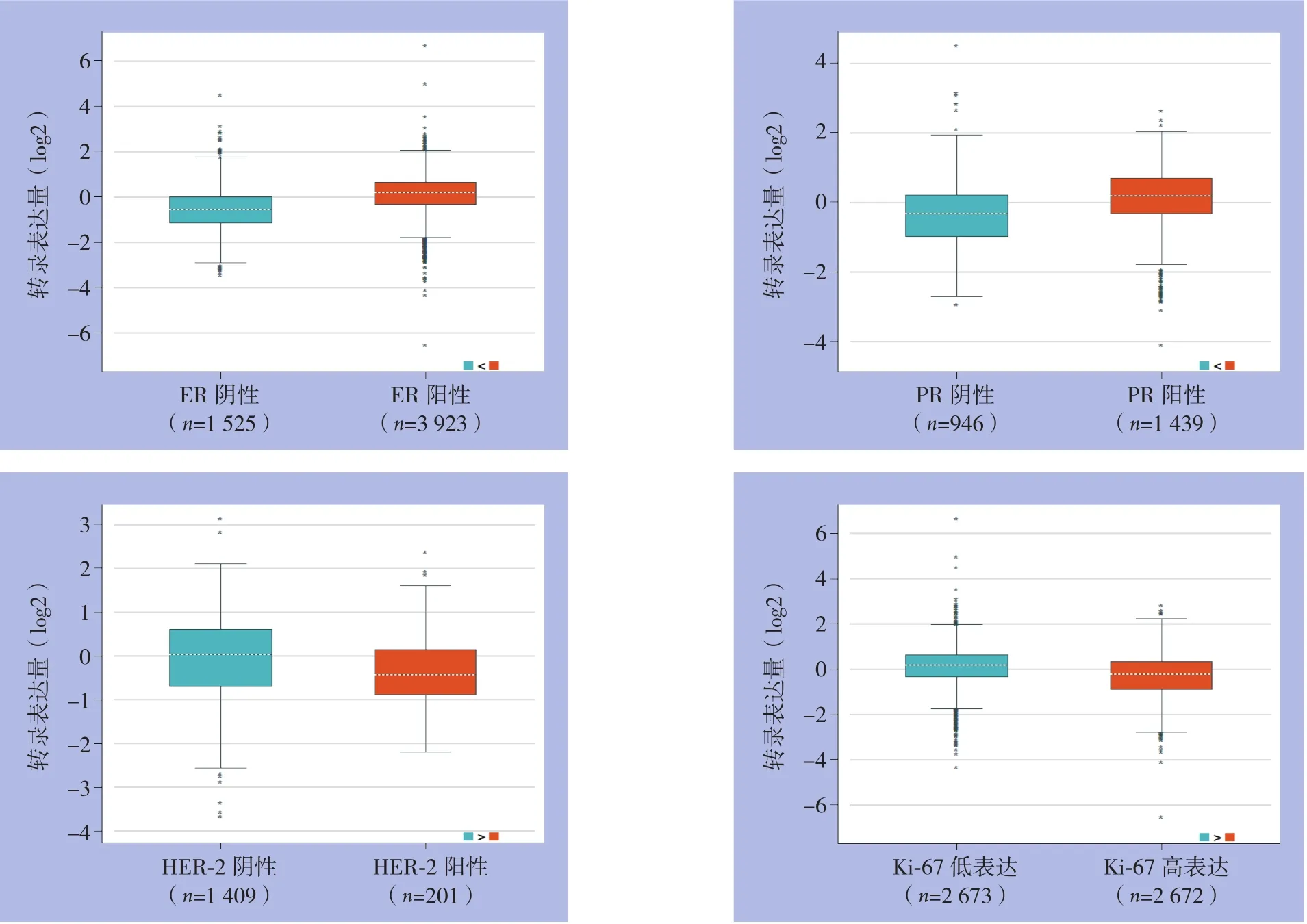
图2 MAPT表达与ER、PR、HER-2、Ki-67的关系Figure 2 Relations of MAPT expression with ER,PR,HER-2 and Ki-67
2.2 MAPT与乳腺癌内分泌耐药、化疗耐药以及靶向治疗耐药的关系
分析GEO数据库中与的数据发现,数据集GDS360中331_at这一基因片段表达量在多西他赛耐药组与敏感组中分别为116.83±35.28(n=14)和81.89±14.02(n=10),114_r_at表达量在多西他赛耐药组及敏感组分别为48.05±37.58(n=14)和20.03±16.19(n=10),MAPT在多西他赛耐药乳腺癌中表达水平较高(P<0.01)。对数据集GDS4083进行分析,发现拉帕替尼耐药组206401_s_at片段表达量为284.74±69.29(n=12),敏感组中为184.31±35.84(n=6),206401_s_at片段在耐药组和敏感组的表达量分别为187.38±34.59(n=12)和139.94±12.21(n=6),MAPT在拉帕替尼耐药组中的表达量明显高于敏感组(P<0.01)。对数据集GDS4051进行统计分析,发现203929_s_at、225379_at、203928_x_at、206401_s_at 4个片段在他莫昔芬耐药组中表达量均低于敏感组(均P<0.01)(表1)。
2.3 MAPT与乳腺癌预后的关系
分析Kaplan Meier Plotter数据库中3955例乳腺癌患者的总生存期数据并绘制生存曲线,发现MAPT高表达乳腺癌患者OS高于低表达患者(HR=0.65,95%CI=0.48~0.89,P<0.01)。分别分析各个分子分型,在Luminal A型乳腺癌中,MAPT高表达乳腺癌的OS高于低表达患者(HR=0.38,95%CI=0.23~0.63,P<0.05),MAPT与Luminal B型、HER-2型乳腺癌OS无明显关系(均P>0.05)。对于TNBC,MAPT表达量低的乳腺癌患者OS更高(HR=2.91,95%CI=1.54~5.5)。
对Kaplan Meier Plotter数据库中1402例乳腺癌患者的RFS进行统计分析,结果显示MAPT高表达的乳腺癌患者R F S高于其低表达患者(HR=0.59,95%CI=0.51~0.69,P<0.05)。在Luminal A型的乳腺癌患者中,MAPT高表达患者R F S高于其低表达患者(H R=0.64,95%CI=0.49~0.82,P<0.01)。TNBC中,MAPT高表达患者的RFS低于其低表达患者(HR=1.45,95%CI=1.04~2.04,P<0.05)。而Luminal B型和HER-2型乳腺癌患者中,MAPT表达量与RFS无明显关系(均P>0.05)(图3)。
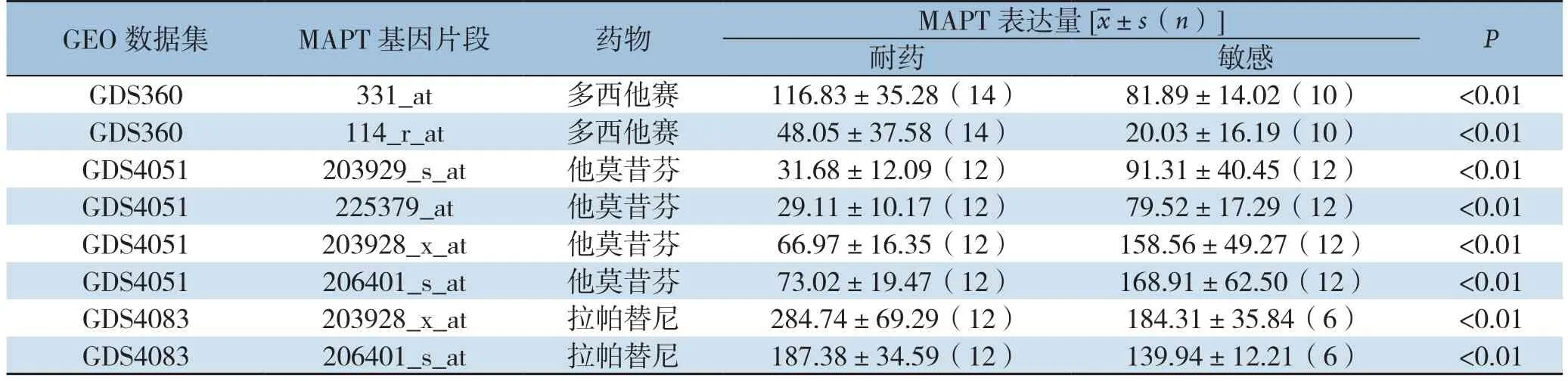
表1 MAPT与乳腺癌化疗、内分泌治疗、靶向治疗耐药的关系Table 1 Relations of MAPT expression with the resistance to chemotherapy,endocrine therapy and targeted therapy of breast cancer
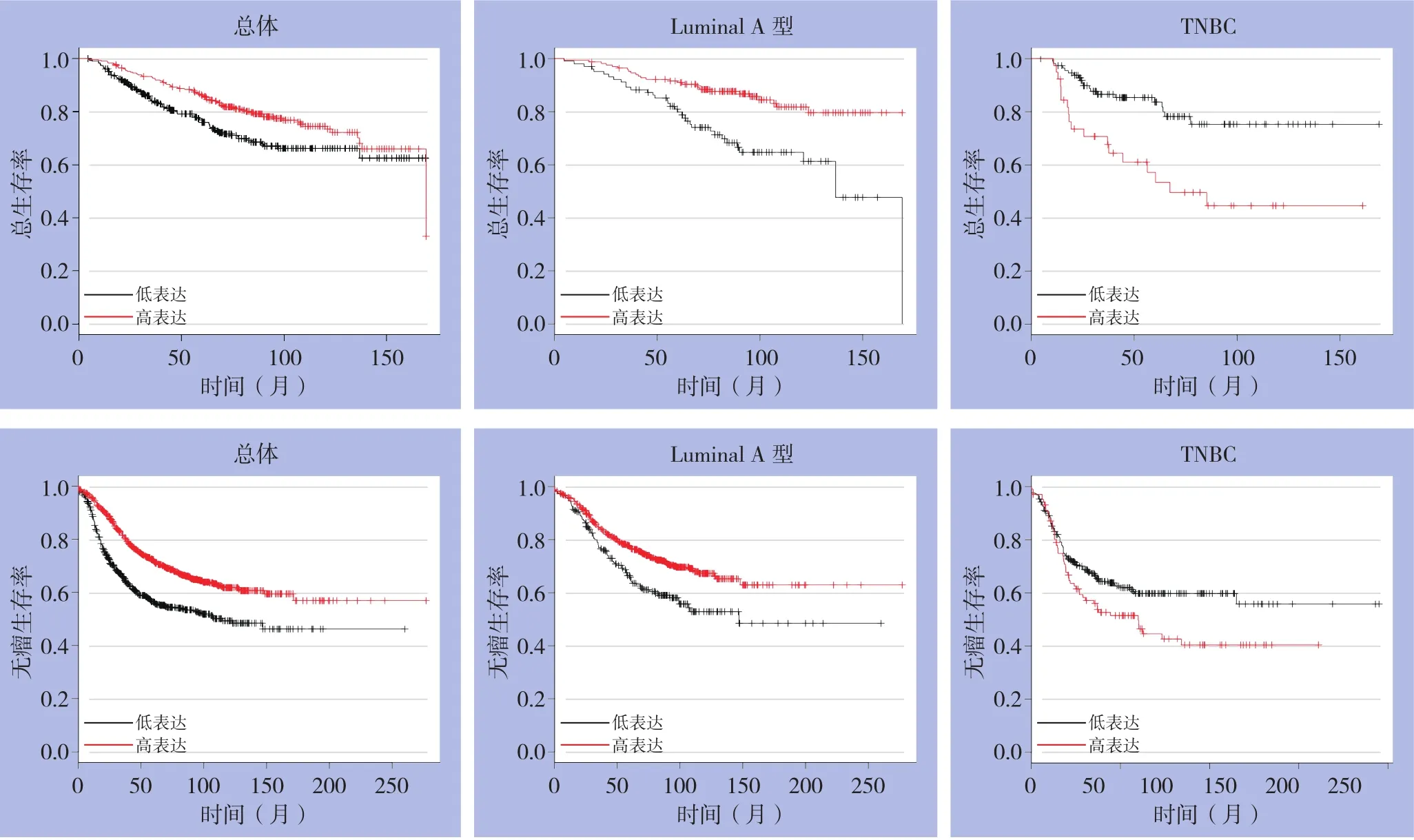
图3 MAPT与乳腺癌预后的关系Figure 3 Relationship between MAPT and prognosis of breast cancer
3 讨 论
目前,在乳腺癌治疗方面,大多为手术为主辅以术后放化疗、内分泌治疗及靶向药物治疗,紫杉类药物和雌激素受体抑制剂是临床上最常使用的乳腺癌化疗及内分泌治疗药物[9-10]。临床上对于乳腺癌预测及预后有许多不同的分子标志物。除了患者年龄、肿瘤大小、淋巴结状态、组织学分级、远处转移状态等影响预后的因素,传统的乳腺癌预后因子包括ER、PR、HER-2、Ki-67、血管生成因子、凋亡相关因子等等,但是这些指标已经不能满足临床上个体化治疗乳腺癌的需求,需要更多、更精确的预测因子对乳腺癌的预后及耐药性进行预判[11]。
通过对乳腺癌组织与正常乳腺组织中MAPT表达量、耐药及敏感细胞株中MAPT表达量数据的生物信息学分析发现,MAPT在正常乳腺组织及乳腺癌组织中均有表达,且在乳腺癌组织中高表达。I、II、III期乳腺癌中MAPT表达量均高于正常乳腺组织,在IV期乳腺癌和正常乳腺癌之间没有发现这种差异,猜测MAPT在IV期乳腺与正常组织无表达差异是由于晚期癌症已经发生远处转移,有相当一部分患者的一般情况较差,甚至发生恶病质,机体代谢失调导致供能不足,而肿瘤细胞异常增生需要大量的原料和能量,缺乏营养支持的肿瘤细胞代谢活跃性减低,故与细胞有丝分裂相关的MAPT表达水平降低。也有可能是因为IV期乳腺癌大多局部已经有了变性、坏死,对MAPT的表达结果存在一定的影响。本研究显示,MAPT的表达也与乳腺癌的分子分型相关,Luminal型乳腺癌具有较高的MAPT表达,而HER-2型及TNBC组织中MAPT低表达。MAPT表达与雌、孕激素受体、HER-2及Ki-67表达均相关。有研究发现ER阳性乳腺癌中MAPT表达显著低于ER阴性乳腺癌,Andre等[12]认为这提示着ER参与MAPT调控。Pentheroudakis等[13]对200多例乳腺癌组织进行实时定量PCR实验,也发现MAPT与ER、PR密切相关。Pusztai等[8]发现ER阳性乳腺癌中MAPT阳性结果更多,而HER-2阳性的乳腺癌中MAPT阳性结果较少,这与本研究结果一致。本研究表明MAPT表达与临床分期以及ER、PR、HER-2、Ki-67这几个常见的乳腺癌分子标志物均有相关性,而已经有大量研究实验表明,这些因素与乳腺癌的预后、耐药、分化程度紧密相关[14-16],这提示MAPT也有成为预测乳腺癌耐药及预后的新的分子标志物的潜力。
本研究表明,MAPT高表达乳腺癌对紫杉类化疗药有耐药性。Rouzier等[15]使用siRNA(小干扰RNA)下调紫杉醇敏感细胞株ZR75.1和MCF-7中MAPT的表达,结果表明,下调MAPT表达后乳腺癌对紫杉醇的敏感性明显升高。紫杉类药物的作用靶点在微管,它可以通过与微管的结合阻止其解聚,从而影响乳腺癌细胞的有丝分裂,MAPT影响乳腺癌对紫杉类药物敏感性的机制可能是由于MAPT蛋白与紫杉醇和微管结合的位点是相同的,但不具备阻止微管解聚的功能,故MAPT高表达导致乳腺癌细胞对紫杉醇耐药[17]。有研究表明,MAPT基因启动子上游存在雌激素应答元件,雌激素与雌激素受体结合后可通过与雌激素应答元件结合启动转录和翻译。MAPT水平可一定程度反应乳腺癌细胞中雌激素活性,因此MAPT有可能预测内分泌治疗效果[13,18]。此外,有研究[19]表明ER可影响MAPT表达,选择性雌激素受体抑制剂氟维司群可下调MAPT表达,增加MAPT阳性、ER阳性乳腺癌细胞对紫杉类化疗药的敏感性。长期以来,同时使用内分泌药物和化学药物联合治疗乳腺癌一直饱受争议,临床上大多使用化疗序贯内分泌治疗,已经有一些学者提出患者可以从化疗联合内分泌治疗得到更多获益[20-21],而选择性雌激素受体对MAPT的调节作用更是为我们提供了一种联合使用内分泌治疗和化疗的可能性。拉帕替尼是一种小分子氨基酸激酶抑制剂,它通过与APT结合位点结合抑制其磷酸化从而抑制肿瘤生长,其耐药成因较复杂,包括PIK3CA的激活性突变[22]、HER-2基因的K753E突变等[23],本研究观察到MAPT与乳腺癌拉帕替尼耐药有相关性。MAPT蛋白在微管形成、解聚中发挥的作用可以影响乳腺癌细胞的增殖,这可能会成为新的乳腺癌防治策略。在乳腺癌术后化疗的方案选择上,可以对乳腺癌组织进行MAPT基因检测以制定精准的个体化治疗方案,MAPT高表达乳腺癌患者应避免使用紫杉类药物作为主要化疗方案,而低表达乳腺癌患者可积极使用紫杉类化疗药,以此取得更好疗效,预防乳腺癌的术后复发。
研究[24]发现MAPT高表达而微管解聚蛋白低表达乳腺癌具有更高的DFS,且MAPT与微管解聚蛋白表达量比值与DFS呈正相关关系,两者比值可以作为OS的独立预测因子,还有体外试验表明MAPT在乳腺癌中高表达与较好的预后相关[25]。本研究发现乳腺癌中MAPT表达量显著高于正常乳腺组织,而MAPT高表达乳腺癌有较好的OS与RFS,这提示MAPT可能不仅仅有单一的抑癌作用或者促癌作用,有的肿瘤相关因子已经被发现既有抑癌作用也有促癌作用,比如转化生长因子β(TGF-β),目前有研究表明,在肿瘤发育的不同时期,TGF-β可以发挥不同的作用,在肿瘤发生早期,抑制细胞增殖[26];而在肿瘤发展到晚期时,TGF-β可促使上皮细胞向间充质细胞转化,使得肿瘤细胞具有转移、浸润的倾向,此外在肿瘤晚期它还可刺激肿瘤血管生成并使机体对肿瘤细胞产生免疫抑制[27]。由此可见,某个分子在癌症发生、发展这一序贯过程中,起到的作用可能是不同的。所以MAPT也可能在肿瘤早期起到促进肿瘤生长的作用,然而在肿瘤晚期这种促癌的作用逐渐被抑癌的作用取代,故MAPT高表达的反而表现出更好的预后。最近也有研究[28]表明,PLK1基因在多种肿瘤细胞中过表达,但实际有抑癌作用。此外,在有些研究[29]中,抑癌基因P27也被发现具有促癌的特性。在个别的研究中,有学者[12]发现MAPT的表达水平与没有接受过辅助治疗的乳腺癌患者的“自然预后”没有相关性,这提示着MAPT可能是通过影响乳腺癌的内分泌、化疗、靶向治疗的效果改变预后,也就是说MAPT对乳腺癌的预后影响也取决于患者接受辅助治疗情况。本研究还发现,总体来说,MAPT高表达的乳腺癌预后较好,单独统计Luminal A型的数据也是如此,但TNBC除外,MAPT对乳腺癌的预后与乳腺癌分子分型相关。这与PLK1很相似,研究人员发现在HER-2阳性的肿瘤中,PLK1过表达的患者预后较好,而在ER受体阳性乳腺癌中,PLK1过表达的患者预后差,PLK1对肿瘤预后的作用也取决于肿瘤的亚型[28]。当然,上述仅提出了一些可能性,未来仍需要更多的细胞生物学实验来验证MAPT的抑癌机制及进一步探求其与乳腺癌预后的关系。
本研究结果显示MAPT高表达乳腺癌对紫杉类药物耐药,但预后更好,笔者分析,这可能有两点原因,第一,MAPT高表达乳腺癌虽然对紫杉类药物耐药,但对雌激素受体抑制剂敏感,可以取得更好的内分泌治疗效果,从而表现出更好的预后,有研究[30]表明,在特定的乳腺癌患者中,内分泌治疗的获益更多,St Gallen专家共识[31]也认为对于某些患者来说内分泌治疗更加重要,所以推测某些情况下雌激素受体抑制剂敏感比紫杉类药物耐药对预后的影响可能更大。第二,本研究选择了紫杉类药物作为研究的主要对象,但临床上在制定乳腺癌化疗方案时通常使用2~3种药物联合方案,如环磷酰胺、多柔比星等药物,MAPT的表达与其他类型化疗药物的关系尚不明确,因此不能排除MAPT高表达乳腺癌对紫杉类药物耐药而对其他化疗药物敏感性高的可能性。
本研究使用生物信息学方法和各种生物信息工具对MAPT在乳腺癌中表达意义做了较为全面的分析,但是本研究也存在一定的局限性,本研究所采用的数据来源于公共数据库,在数据处理和上传过程中遵循一定的格式,可能会丢失一部分原始数据,公共数据库中纳入的乳腺癌病例来自不同地区种族的人群,可能存在一定种族差异,且生物信息工具有各自的适用范围,为了更好的了解MAPT与乳腺癌耐药、预后的关系,仍有必要在进一步研究中设计合理的细胞生物学实验加以验证。
综上,MAPT在乳腺癌中高表达,且不同分型乳腺癌中的表达具有一定差异。MAPT与乳腺癌的耐药和预后密切相关,高表达的乳腺癌患者可能对紫杉类药物耐药而对他莫昔芬敏感,且可能具有更好的预后。因此,MAPT是一个非常有潜力的乳腺癌预后因子,也是他莫昔芬敏感性和紫杉醇耐药性的双功能预测因子,有可能为防治乳腺癌及预防其术后复发提供新的思路,值得更进一步的研究。
