泛素蛋白连接酶E3A在乳腺癌细胞中作用的蛋白质组学与生物信息学分析
2019-06-11谢少利刘家有王碧娟黄红梅李静佳赵小波邓世山侯令密
谢少利,刘家有,王碧娟,黄红梅,李静佳,赵小波,邓世山,侯令密
(1.川北医学院附属医院 甲状腺乳腺外科,四川 南充 637000;2.川北医学院解剖教研室,四川 南充 637000;3.川北医学院第二附属医院 内科,四川 南充 637000)
三阴性乳腺癌(TNBC)是乳腺癌分子分型中的一种特殊亚型,因其特殊的生物学特性,导致TNBC进展快、预后差成为其典型特点[1]。因为缺乏内分泌治疗和靶向治疗的特异位点,到目前为止,对TNBC的治疗陷入瓶颈,临床上尚无有效的综合治疗手段。蛋白质为生命功能的执行者,在机体内其产生与降解维持着动态平衡。泛素-蛋白酶体系统途径(ubiquitin proteasome system,UPS)广泛参与蛋白质的降解,因为特异性的泛素蛋白连接酶E3,导致其降解蛋白质具有高度选择性[2]。泛素蛋白连接酶E3A(UBE3A)又称E6-AP(E6 associated protein,E6-AP),属于含有HECT结构的E3泛素蛋白连接酶家族成员,研究证实,细胞内大量的基因编码的蛋白质如P53、c-myc、P27等可通过UBE3A介导的泛素-蛋白酶体系统降解,从而促进肿瘤的发生发展[3]。笔者在前期实验[4-5]发现,通过慢病毒介导敲低UBE3A后,乳腺癌细胞MDA-MB-231细胞的增殖能力降低、细胞的侵袭能力减低以及细胞周期发生明显改变,提示UBE3A在乳腺癌细胞中扮演着重要角色,但其具体参与机制还不明确。本实验对敲低UBE3A前后进行差异蛋白质分析,以检测UBE3A前后TNBC细胞株MDA-MB-231细胞蛋白水平的表达差异,探讨UBE3A敲低后乳腺癌细胞生物学行为改变的可能机制。
1 材料与方法
1.1 实验对象
人TNBC细胞株MDA-MB-231,购于中国科学院细胞总库。将MDA-MB-231细胞分为UBE3A敲低组与对照组,分别转染shRNA-UBE3A片段与对细胞无影响的shRNA片段。
1.2 主要实验仪器
倒置显微镜、荧光显微镜等购于德国Leica;酶标仪、SDS-PAGE电泳仪、转膜仪、成像仪、PCR仪购于美国Bio-Rad;双向电泳仪、扫描仪购于美国GE。
1.3 实验主要试剂
RPMI-1640培养基、胎牛血清购于美国HyClone;目的片段、GV-115中国上海吉凯基因化学技术有限公司;脂质体Lipo-2000、Trans IT购于美国Invitrogen;逆转录试剂盒、PCR引物购于物美国Thermo;2-D clean-up kit、2-D Quant Kit、Immobiline DryStrip Cover Fluid、IPG Buffer pH 3-10 NL购于美国Pharmacia。
1.4 实验方法
1.4.1 细胞培养及慢病毒感染常规方法培养MDA-MB-231以及用于包装慢病毒的239T细胞;按上海吉凯基因提供的慢病毒包装步骤包装慢病毒载体并将其定量;待目的细胞融合度达到约30%~40%时,加入适宜量慢病毒,12 h后更换培养基;感染72 h后荧光显微镜下观察GFP的表达情况,荧光率大于90%者,可用于后续实验。
1.4.2 提取各组细胞总蛋白质及蛋白纯化及定量取生长状态良好的细胞,按蛋白提取试剂盒步骤常规提取各组细胞总蛋白;按GE提供的操作步骤进行纯化及定量细胞总蛋白,确定后续实验的准确性。
1.4.3 双向电泳(two-dimensional electrophoresis,2-DE)第一向等点聚焦IEF:室温平衡18 cm IPG预制干胶条至少15 min;取蛋白质样品340 μL(约2.0 mg)进行上样;将IPG干胶条胶面朝下置于水化盘中蛋白样品溶液上;缓慢加入2 mL矿物油覆盖IPG干胶条;按表1步设置等电聚焦程序进行IEF等点聚焦;结束后去除矿物油,取出胶条,加适当体积的SDS-DTT平衡缓冲液进行摇动平衡15 min;取出后再加入适当体积的SDS-碘乙酰胺平衡缓冲液再次摇动平衡15 min。第二向SDS-PAGE电泳:配制12%的丙烯酰胺凝胶后常规灌胶;取平衡后的胶条,使之与聚丙烯酰胺凝胶胶面完全接触,凝胶的上方加入低熔点琼脂糖封胶液,放置5 min使其凝固;在电泳槽加入电泳缓冲液后,起始时用的低电电压,观察溴酚蓝指示剂,待指示剂在完全走出IPG胶条后,并浓缩成一条线后,再加大电压,待溴酚蓝指示剂达到底部边缘时,停止电泳。
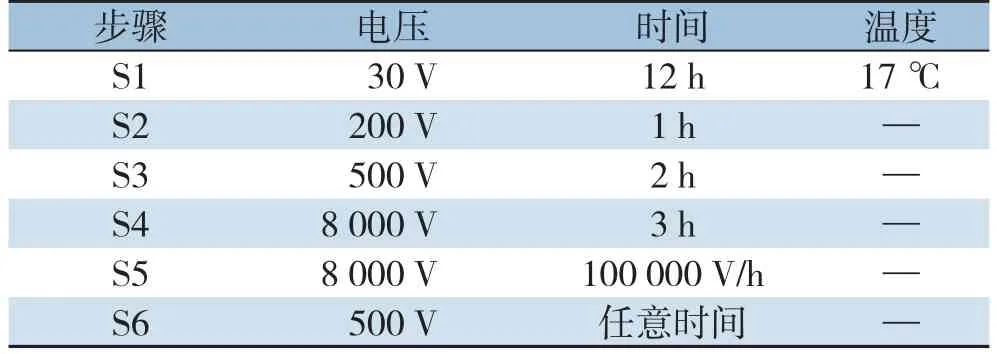
表118 cm IPG胶条IEF程序设定Table 1 Protocol for IEF of 18 cm strip
1.4.4 差异蛋白质点选取电泳结束后取出凝胶,将胶放入考马斯亮蓝染色液中染色3 h;反复更换脱色液直至蛋白点明显、背景清楚;置于扫描仪上扫描凝胶;利用PDQuest7.1软件选取差异大于1倍以上的蛋白质点。
1.4.5 差异蛋白质点的串联质谱检测取切取的差异蛋白质点,-20℃冷冻保存,交由生工生物工程(上海)股份有限公司进行基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-TOF-MS/MS)检测差异蛋白质。
1.4.6 差异蛋白点的生物信息学分析进入DAVID及Sting网址,对差异蛋白质进行GO分类,得到生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组分(cellular component,CC)各层面的相关生物学信息。
2 结 果
2.1 双向电泳结果及差异蛋白质点生物信息分析
敲低UBE3A前后进行2-DE寻找差异蛋白质点,运用PD Quest 7.1软件进行分析,选出28个差异蛋白质点(图1)。选取28差异蛋白质点进行质谱分析,鉴定出差异表达蛋白质共28个,排除重复的后有24个蛋白质(表2)。本实验最终得到28个差异蛋白质点,其中有实验组有4个蛋白质相对阴性对照组高表达,有24个相对低表达。将其Map到DAVID数据库中与Homo Species匹配的记录有23个。对已识别的23个差异蛋白开展了进一步的分析。能够进行生物学途径、细胞成分、分子功能注释分类的蛋白质分别为23个(100%)、20个(87%)和23个(100%)。差异性蛋白质在DAVID数据库中按照GO的5个层次进行分析,每一层次有部分交叉,且部分概念分类内也有交叉。所以各分类的百分比之和可能超过100%。差异性蛋白质在KEGG数据库的代谢和信号传导通路涉及蛋白酶体、糖代谢等见表3。
2.2 String Tool分析差异蛋白质之间相互关系
本实验中运用StringTool对鉴定的差异蛋白质进行相互作用预测,发现这些差异蛋白质中有23个蛋白质有着直接或者间接的联系(图2)。线越粗代表相互联系越强。
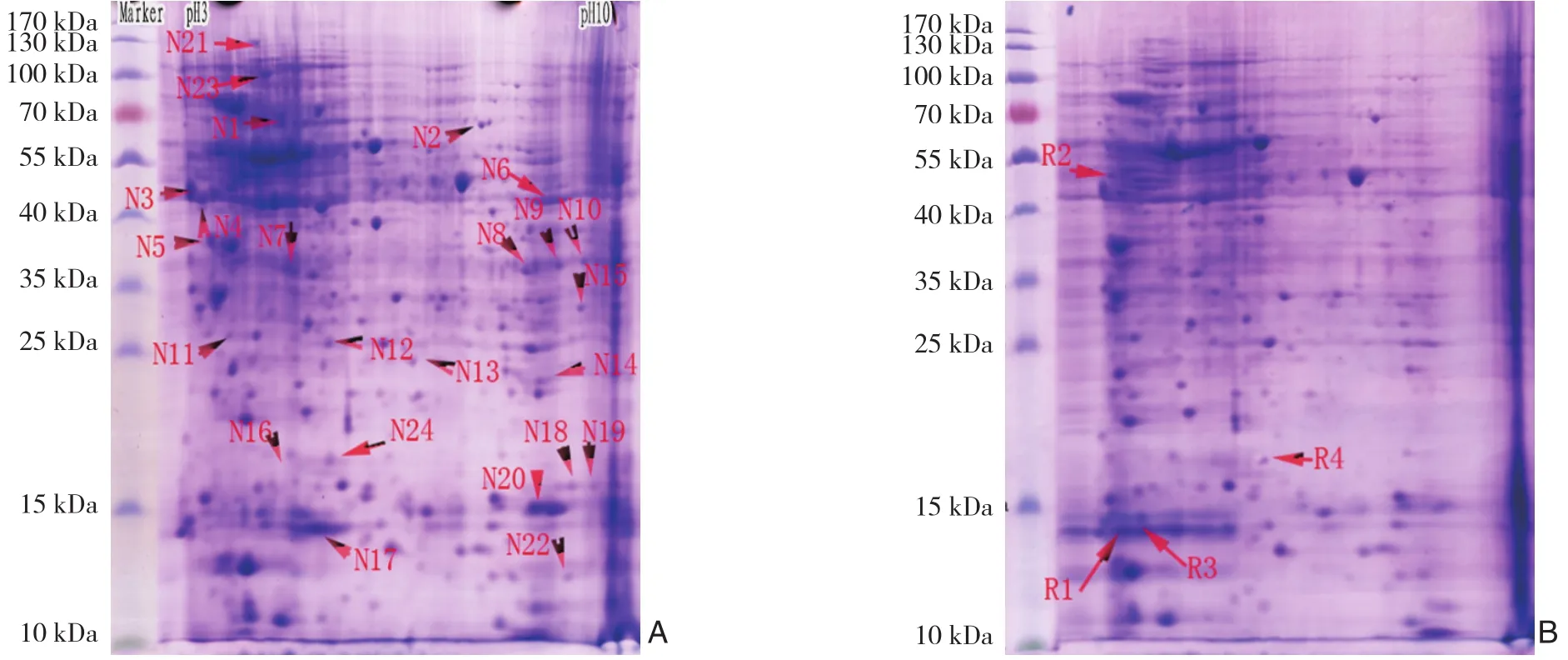
图12-DE图片 A:对照组;B:UBE3A敲低组Figure 1 2-DE pictures A:Control group;B:UBE3A knock-down group

表2 差异蛋白质点信息Table 2 Information of the spots of differentially expressed proteins

表3 差异性蛋白质在KEGG数据库的代谢和信号传导通路Table 3 The metabolism and transduction pathways of the differentially expressed proteins in KEGG database
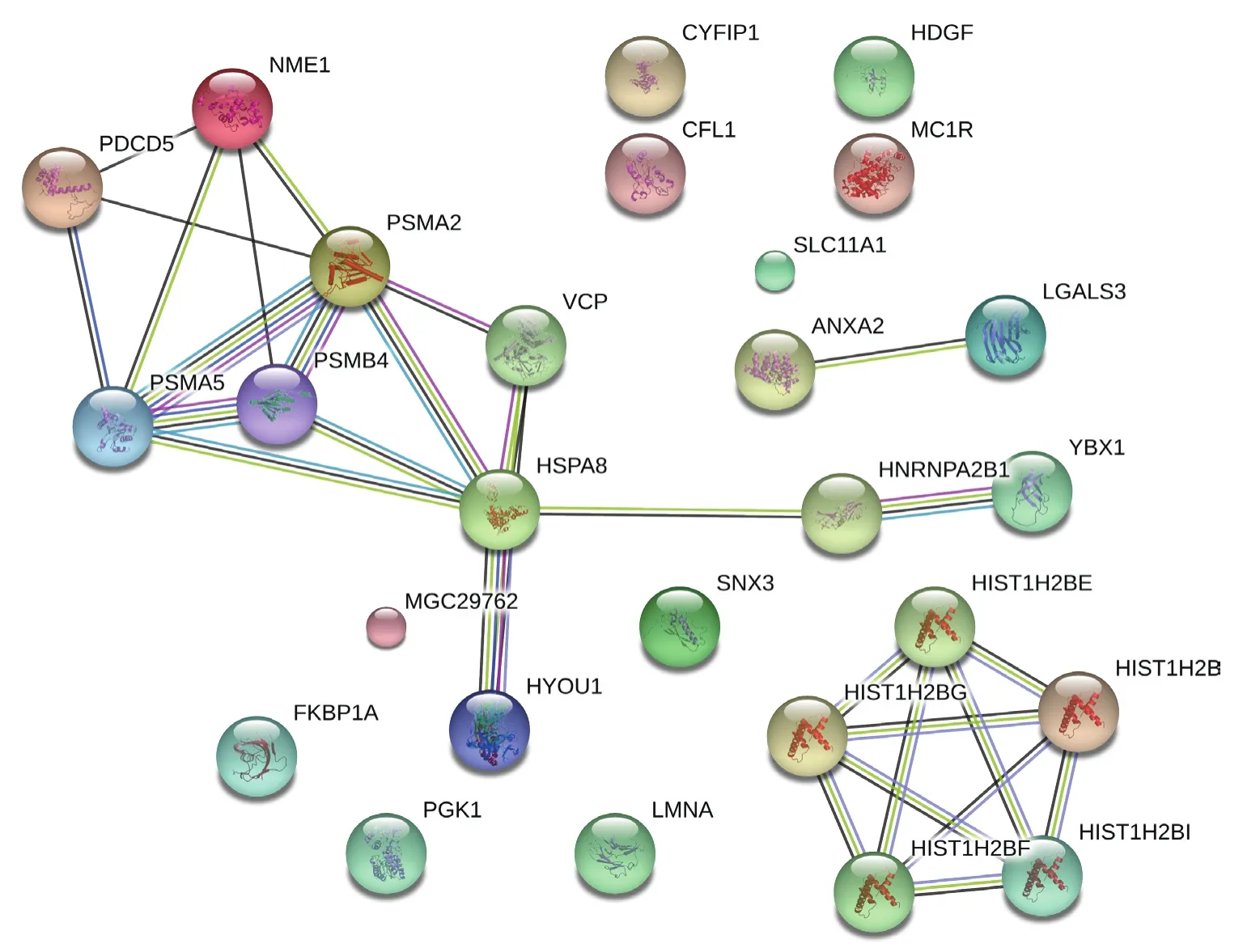
图2 差异蛋白质相互关系Figure 2 Interactions of the differentially expressed proteins
3 讨 论
蛋白质是生命功能的执行者,机体蛋白质的产生与降解维持着动态平衡。其产生受基因调控,其降解主要通过两种途径,即溶酶体途径和UPS,后者具有高度选择性[2]。UPS由泛素(UB)、泛素活化酶E1、泛素结合酶E2、泛素蛋白连接酶E3、泛素延长酶E4、去泛素化酶DUB(DUB)和26S的蛋白酶体组成,在UPS中由于E3酶独特的结构和功能域,决定了其介导的靶蛋白降解反应的高度选择性与特异性[2]。UBE3A属于含有HECT结构的E3泛素蛋白连接酶家族成员。目前的研究表明,UBE3A蛋白定位在细胞核中,作为甾醇类激素受体的共激活因子调节下游基因的转录参与天使综合征(angelic syndrome,AS)[6-7],研究证实,细胞内大量的基因编码的蛋白质如P53、c-myc、P27等可通过UBE3A介导的泛素-蛋白酶体系统降解,从而促进肿瘤的发生发展[3]。蛋白质组学(proteomics)即是研究细胞、组织乃至生物体蛋白质组及蛋白质变化规律的学科,目前蛋白质组学研究首选的蛋白质分离技术仍是2-DE技术[8-9]。本次实验将2-DE的差异蛋白点进行串联质谱分析,能得到具体的蛋白质信息,将差异蛋白信息在DAVID以及String Tool在线数据库进行生物信息学分析,以探讨敲低UBE3A后乳腺癌细胞发生生物学行为改变的机制[10],为后续的研究提供思路。
本实验中2-DE凝胶图谱选取差异表达蛋白质共28个,有4个蛋白质在UBE3A敲低组相对对照组高表达,24个相对低表达。鉴定结果中有4个相同的蛋白质。根据在2-DE凝胶图谱及鉴定结果显示位于不同的位置的部分蛋白质,但是质谱鉴定结果为同一种蛋白质,这可能是因为这些蛋白存在多种不同的翻译后修饰形式,也有可能是部分多亚基蛋白被解离成单个亚基,或者部分蛋白质发生了共价键的解离,能够改变蛋白的等电点及相对分子量,所以在双向电泳图谱上同一种蛋白质可能位于不同的位置。
将这24个差异蛋白质Map到DAVID数据库中与Homo Species匹配的记录有23个,剩余的1个可能因为还没有完整的基因及蛋白功能注释信息,因而不能识别。对已识别的23个差异蛋白开展了进一步的蛋白质的GO分析。能够进行生物学途径BP、细胞成分CC、分子功能MF注释分类的蛋白质分别为23个(100%)、20个(87.7%)和23个(100%)。因这些差异性蛋白质在DAVID数据库中按照GO的5个层次进行分析,每一层次有部分交叉,且部分概念分类内也有交叉,所以各分类的百分比之和会超过100%。同时在KEGG分析中显示,在这些差异蛋白质中,PGK1、2集中参与了糖的有氧酵解和糖异生;蛋白酶体α亚基2、5及蛋白酶体β亚基4参与组成蛋白酶体,行使蛋白质的降解功能。
现今,在世界范围内肿瘤与糖尿病是两大主要的慢性疾病[11],目前大部分研究表明糖代谢紊乱与恶性肿瘤息息相关[12-13]。大量的研究表明血糖的高水平或糖尿病能增加患乳腺癌的风险且增加乳腺癌患者的病死率[12,14-16]。PGK1是糖酵解过程中的关键酶之一,能够将一个磷酸转移到ADP上形成ATP[17],此外,其还参与了多种生物学功能如肿瘤的血管生成[18]、DNA的复制与修复[19]。目前的研究表明PGK1与多种肿瘤相关如肝癌[19]、结肠癌[20]、胃癌[21]等。Sun等[22]最近的研究发现PGK1参与乳腺癌治疗过程中耐紫杉醇,降低了乳腺癌的治疗效果。在本实验中也发现敲低UBE3A后PGK1表达减少,乳腺癌细胞浸润与转移能力也降低,所以猜想PGK1参与的糖酵解途径发生的改变促使了UBE3A敲低后乳腺癌细胞的浸润与转移能力减弱。
降解蛋白质的UPS是一个依赖ATP高度有序的级联酶促反应过程。在一系列酶的作用下将泛素标记的靶蛋白运送到26S的蛋白酶酶体上进行降解反应[23]。其中26S的蛋白酶体是一个由20S核心蛋白颗粒和2个19S调节颗粒构成的多亚基蛋白酶复合体。20S的核心是由7个相同的α亚基和7个相同的β亚基对称排列构成的2个环形的桶状结构组成,外部的α环围绕着内部的β环,每个环各有7个相同的亚基,即为α1~α7和β1~β7[24]。Kondakova等[25]研究在人类多种肿瘤中26S蛋白酶体功能时发现,蛋白酶体的降解功能与各亚基的含量不同有很大的关系。UBE3A作为UPS系统中关键酶之一,在本研究中发现,通过敲低UBE3A前后,参与组成蛋白酶体的α2、β4、α5亚基含量发生改变,其降解蛋白的功能也发生了改变,部分具有重要功能的蛋白质降解发生改变。因此,笔者认为在敲低UBE3A后乳腺癌的浸润与增值能力降低可能就是蛋白酶体功能发生改变的结果。
为了解敲低UBE3A前后差异蛋白质之间相互作用关系,本研究利用String Tool蛋白相互作用数据库对这些差异蛋白质间的相互作用进行预测和分析,结果发现这些差异蛋白质中,有23种蛋白质在蛋白质相互作用网络图上同时出现,说明这些蛋白质存在直接或间接的关系,线条越粗,关系越密切。可以推测这些差异蛋白质之间存在着某些功能联系,且这些功能联系与敲低UBE3A后乳腺癌细胞的增殖与浸润能力有关。其中HSPA8、PSM、HYOU1、HNRNPA2B1、HMGB1、Annexin A2、HDGF、NME1关系较为紧密。这些蛋白质均与肿瘤的浸润与转移相关,这给予了很好的启发,可选取这几个蛋白用于乳腺癌的研究及下一步功能验证。当然本实验还有些许不足,这些差异蛋白质与UBE3A之间到底是什么关系,他们之间通过什么途径相互作用还有待进一步的研究。这也为后续研究提供方向。
敲低UBE3A后,TNBC细胞株MDA-MB-231在泛素-蛋白酶体系统功能与糖代谢功能方面发生变化,这可能是敲低UBE3A后乳腺癌细胞生物学行为改变的原因。当然这些差异蛋白质与UBE3A之间到底是什么关系,他们之间通过什么途径相互作用还有待进一步的研究。
