重组人SOD1/3转基因山羊的制备及表达产物的检测
2019-06-04周敏雅陆睿张婷袁婷婷卢瑶瑶严坤宁袁玉国成勇
周敏雅 陆睿 张婷 袁婷婷 卢瑶瑶 严坤宁 袁玉国 成勇
(1. 扬州大学兽医学院,扬州 225009;2. 扬州大学医学院,扬州 225009)
超氧化物歧化酶(Superoxide dismutase,SOD)是广泛存在于生物界的一类金属酶,它能清除机体内多余的活性氧。哺乳类动物和人体内仅含Cu/Zn-SOD(SOD1)、Mn-SOD(SOD2)及 EC-SOD(SOD3),其中SOD1和 SOD3 同属于Cu/Zn-SOD,前者存在于细胞内,后者位于细胞外液中[1]。据报道[2],在哺乳动物体内 Cu/Zn-SOD 的稳定性和含量均高于Mn-SOD,因此Cu/Zn-SOD在临床应用上更受重视。
随着人们对高质量生物制品的需求日益增大,通过转基因技术制备的重组蛋白开始不断涌现。与其他表达系统相比[3],转基因动物乳腺生物反应器具有高表达、高生物学活性、蛋白翻译后可修饰及不产生内毒素等优势,是极具发展前景的制药新途径之一。本实验室在应用乳腺生物反应器表达功能性蛋白的技术已较成熟[4-5],其中Song(宋绍征)等[6]在转基因兔乳腺生物反应器表达重组人纤溶酶原激活剂的研究中,rhPA 浓度最高可达 630 μg/mL,表达产物比活性是现有阿替普酶的 360 倍。由此可见,乳腺生物反应器具有生物活性高、生产成本低等优点。
目前,能利用宿主生物体来表达多种异源蛋白的方法有共整合[7]和元表达载体系统[8],前者是转基因通过内部核糖体进入位点(Internal ribozyme entry site,IRES)连接,但不同的基因之间总是影响彼此的表达;通常是5'区相对高于3'区,而且每个基因的表达水平均会相对低于单基因整合个体。然而,在二元载体系统中,这两个载体具有独立的表达调节区,不存在彼此影响。因此,我们选用二元载体系统开展研究。此外,为提高转基因效率,我们尝试仅用一个载体含标记基因来筛选获得双载体共转染的重组阳性克隆细胞株,并通过体细胞核移植(Somatic cell nuclear transfer,SCNT)技术生产双转基因克隆山羊。
在本研究中,通过酶联免疫吸附测定(Enzymelinked immunosorbent assay,ELISA)、Western blotting和体外活性实验等方法检测到rhSOD1和rhSOD3能在山羊乳汁中有效表达,从而表明成功构建了携带山羊 β-酪蛋白/CMV 杂合启动/增强子优化的hSOD1和hSOD3编码序列的二元表达载体。因此,本实验设计用乳腺生物反应器来生产rhSOD1、rhSOD3蛋白是可行的,为后续纯化和大批量生产rhSOD蛋白提供依据。
1 材料与方法
1.1 材料

1.1.1 乳腺特异性表达载体 山羊乳腺特异性表达载体以山羊beta酪蛋白为表达调控序列,鸡beta珠蛋白为隔离原件,CMV为增强子;hSOD1、hSOD3 cDNA为功能基因,序列来自NCBI,编号分别如下:
1.1.2 试剂 内切酶、Taq酶购自日本TaKaRa公司;T4 DNA连接酶,购自美国Promega公司;G418培养基(E859,Amresco,美国);胶回收纯化试剂盒(D2500-01,OMEGA,美国);FSH(110044629,宁波三生药业有限公司);PVDF膜购自美国Pall公司;ElISA试剂盒等购自上海生工;其他试剂无特殊说明,均购自美国Sigma 公司。
1.1.3 主要实验仪器和器械 基因扩增仪(S1000型,BIO-RAD,美国);DNA电泳槽、电泳仪(NJ400型,南京新校园仪器);Multiporator多功能细胞电转染仪(Eppendorf,德国);凝胶成像仪(Tanon-2500,上海天能科技有限公司);超净工作台(SJ-CJ-1BQ型,苏州净化仪器设备厂);倒置显微镜和显微操作仪(Leica,德国),体视显微镜(厦门麦克奥迪公司),CO2培养箱(No.3111,Forma Science Inc. 美国),拉针仪(PB-7 Micropipette Puller,Narisgige,日 本),DNA 扩增仪(S1000 Thermal Cycler,Bio-RAD,美国),酶标仪(RT-6000,Rayto,深圳),医用低温保存箱(DW-86L626,青岛海尔公司);常规手术器械等。
1.1.4 实验动物 体成熟的山羊购自江苏省内,饲养于扬州大学兽医学院。
1.2 方法
1.2.1 构建载体与回收片段 合成的hSOD1、hSOD3 cDNA序列(上海生工)插入至本实验室保存的含有上述表达调控元件的乳腺特异性表达载体pCL25的XhoI酶切位点处并在pCL25/hSOD1的NheI酶切位点处插入Neor基因,经测序及序列结果比对,筛选获得与理论序列一致的表达载体。构建成的乳腺特异性表达载体命名为rhSOD1、rhSOD3(图1)。rhSOD1和rhSOD3乳腺特异性表达载体分别以SalI+NotI双酶切获得16.8 kb和16.3 kb的真核表达基因片段[8],经胶回收试剂盒(D2500-01,OMEGA,美国)回收片段,分别溶于灭菌双蒸水,以供细胞转染。
1.2.2 应用电转染制备双基因共整合的奶山羊胎儿成纤维细胞 从液氮灌中取出冻存的原代山羊胎儿成纤维细胞,复苏培养至P2代,待细胞长至铺满板底时,用细胞消化液(0.05% 胰酶+0.04% EDTA)消化收集细胞,离心后用低渗电转染液(Eppendorf,德国)清洗并计数[9];用电转液悬浮细胞至细胞密度至2×106个/mL,分别加入4 μg 的rhSOD1 和rhSOD3片段,将混合液转移至径宽为2 mm电转染杯(Eppendorf,德国),在 250 V,300 μs 条件下电击 2 次,使rhSOD1、rhSOD3共转染山羊胎儿成纤维细胞。电转染24 h后转至6孔细胞培养板,用G418(800 μg/mL,Amresco,美国)的抗性培养液培养,筛选10 d,将筛选到的单克隆细胞株扩大培养,培养48 h后收集1/4的细胞用于PCR整合检测,剩余的细胞冻存于液氮中。

图1 乳腺特异性表达载体 rhSOD1和rhSOD3
1.2.3 胎儿成纤维细胞的转基因检测 用 60 μL/孔细胞裂解液(40 mmol/L Tris-HCl,pH 8.9)于 45℃裂解1 h,取 5 μL 作为模板进行 PCR 反应,检测引物为 CMV-SOD 跨接头引物 CMV-rhSOD1-C 组 和CMV-rhSOD3-C组见表1,PCR 产物进行测序验证。
1.2.4 制备双基因共整合山羊 获得的双基因共整合的单克隆细胞株作为供核细胞,以MII期的山羊卵母细胞经去核处理后作为核受体,进行体细胞核移植,选择状态佳的重构胚,移植到同期发情的受体山羊输卵管中。术后一个月,通过B超检测受体山羊的妊娠状况。
1.2.5 出生的克隆山羊外源基因整合检测 剪取出生小羊的耳尖皮肤,经组织裂解液与蛋白酶K消化5 h 后,提取耳组织DNA。检测引物为CMV-SOD 跨接头引物 CMV-rhSOD1-G 组 和 CMV-rhSOD3-G组见表1。其中,rhSOD 1的 C组与G组的PCR 参数为:95℃ 预变性 5 min;94℃变性 1 min,60℃退火1 min,72℃延伸 1 min,共 33个循环;最后 72℃延伸 10 min。
rhSOD 3的 C组与G组的PCR参数为:95℃ 预变性 5 min;94℃变性 1 min,58℃退火 1 min,72℃延伸 1 min,共 33个循环;最后 72℃延伸 10 min。

表1 PCR检测所用引物
1.2.6 Western blotting检测 采集SOD-1 与正常山羊的乳汁样品,离心(4℃,5 000 r/min,40 min)吸取乳清,尽量避免吸取下层浑浊物。取30 μL乳清和6 μL 6×SDS-PAGE电泳上样缓冲液混匀,煮沸10-15 min,冷却后依次加入凝胶孔内,同时设置正常山羊乳清作为阴性对照,PBS作为空白对照,重组人SOD1(Thermo Fisher,美国)和重组人SOD3(CUSABIO,武汉)作为阳性对照,运行电泳使蛋白分离;再通过膜转印将蛋白转移至 PVDF 膜上,将PVDF膜转置于洁净的平皿中加入 10 mL 含5% FBS的TBST封闭液,使其充分浸没,4℃ 过夜封闭;第2天早上取出后用TBST冲洗3次;置于15 mL 以1∶2 000 稀释的兔抗人 SOD1 或兔抗人 SOD3 抗体,37℃摇床孵育1.5 h 后TBST冲洗3次;再将膜浸没于以1∶1 000稀释的羊抗兔酶标二抗IgG-HRP,37℃ 摇床孵育1.5 h后用TBST冲洗3次,通过 TCL显色并记录。
1.2.7 转基因山羊乳汁中 rhSOD 的 ELISA 检测 收集SOD-1和正常山羊第 5、10、15和20 d 的乳汁,离心(4℃,5 000 r/min,40 min)吸取乳清。通过酶联免疫吸附法测定 rhSOD1 和 rhSOD3 的表达水平,同时将 hSOD1 或 hSOD3 标准品设为阳性对照,正常山羊乳清为阴性对照,PBS为空白对照。本实验选用兔抗人SOD1或兔抗人SOD3 作为一抗,使用时经抗体稀释液以1∶2 000比例稀释,37℃孵育1 h;弃去一抗后,加入经抗体稀释液以1∶1 000 稀释的羊抗兔酶标二抗 IgG-HRP,37℃孵育1 h;通过TMB 显色,应用酶标仪测定 OD450值。
1.2.8 转基因山羊表达产物的体外活性检测 用WST-8试剂盒测定羊奶中总的重组人SOD酶活性,实验步骤参照说明书进行。在吸光度为450 nm 处,测OD值,并计算乳清中所含总的重组人SOD酶活性。
2 结果
2.1 获得转hSOD1、hSOD3基因的山羊胎儿成纤维细胞系
分别用5 μg的 rhSOD1、rhSOD3片段共转染奶山羊胎儿成纤维细胞,通过用含G418的培养液进行筛选10 d,共获得19株单克隆转基因细胞,经PCR检测后筛选出其中rhSOD1与rhSOD3双基因整合的单克隆细胞株6株(其中rhSOD1、rhSOD3扩增产物的片段大小分别为673 bp和414 bp)见表2。PCR鉴定结果,见图2。

表2 胎儿成纤维细胞整合数据分析
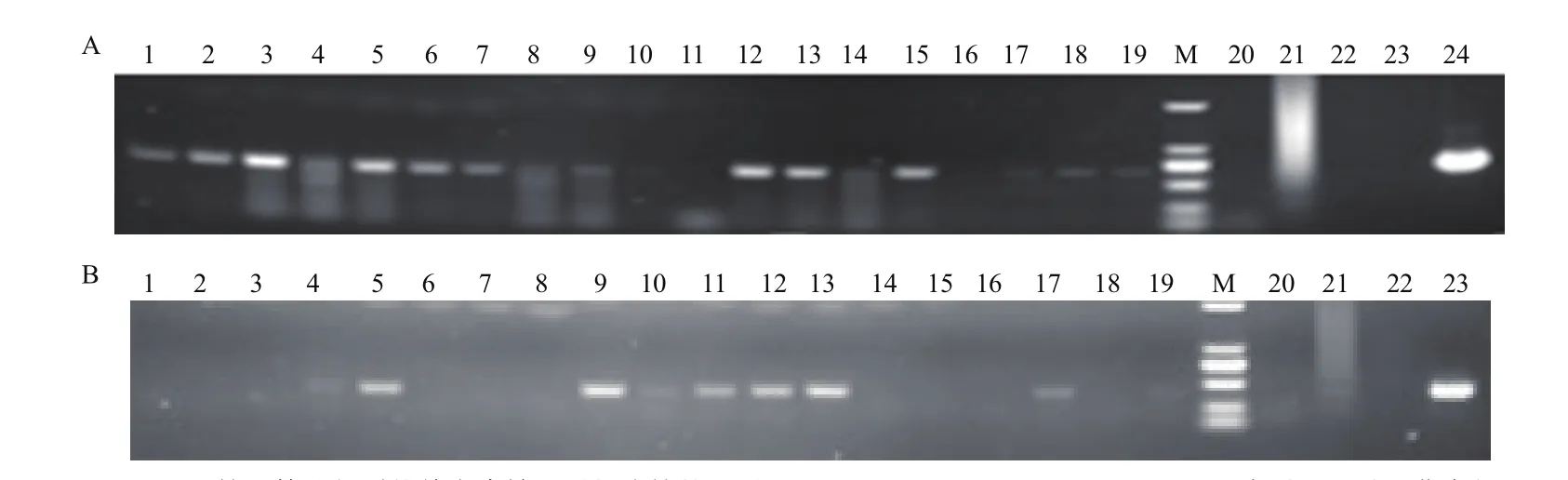
图2 胎儿成纤维细胞细胞系rhSOD1、rhSOD3基因的PCR检测
2.2 双基因整合克隆山羊的出生
本实验通过体细胞核移植技术制备转 rhSOD1、rhSOD3 双基因克隆羊。我们共进行了2次克隆实验,超排6只供体山羊,获得27枚MII期卵母细胞,得到23枚重构胚,移植2只受体山羊。在术后35 d 通过B超检查发现一只受体山羊呈妊娠阳性,待自然分娩,产下一只雌性羔羊(图3),记编号为SOD-1。

图3 转双基因克隆山羊
2.3 克隆山羊的PCR检测结果
提取SOD-1的基因组,通过PCR初步检测及序列分析表明该克隆羊整合了 rhSOD1、rhSOD3 双基因,其中rhSOD1、rhSOD3扩增产物的片段大小分别为621 bp和592 bp。PCR检测结果如图 4。
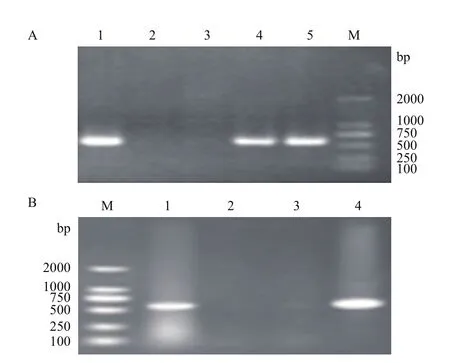
图4 rhSOD1、rhSOD3双基因共整合山羊的检测鉴定
2.4 rhSOD在乳汁中的特异性表达
转基因山羊SOD-1和正常山羊的乳清经 Western blotting 检测,结果(图5)表明,在转基因山羊SOD-1的奶样中检测到rhSOD1和 rhSOD3,而在正常山羊的奶样中,没有检测到相应的蛋白。rhSOD1和rhSOD3的大小分别约为16 kD 和32 kD。
2.5 转基因山羊乳汁中rhSOD 的ELISA检测结果
SOD-1的乳清经 ELISA 检测,检测到 rhSOD1和 rhSOD3, 含 量 分 别 为 88.81± 8.36 mg/L和267.82± 12.67 mg/L。图6、图7和表3、表4中结果均为乳清样品经PBS稀释10倍后实验所得。

图5 Western blot检测分析转基因山羊乳中rhSOD的表达

图6 rhSOD1的ELISA检测图
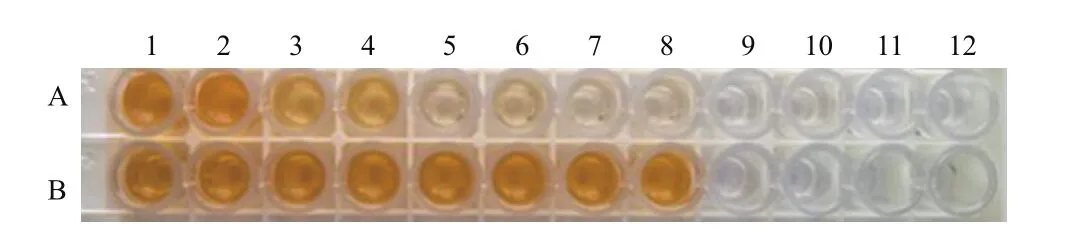
图7 rhSOD3的ELISA检测图
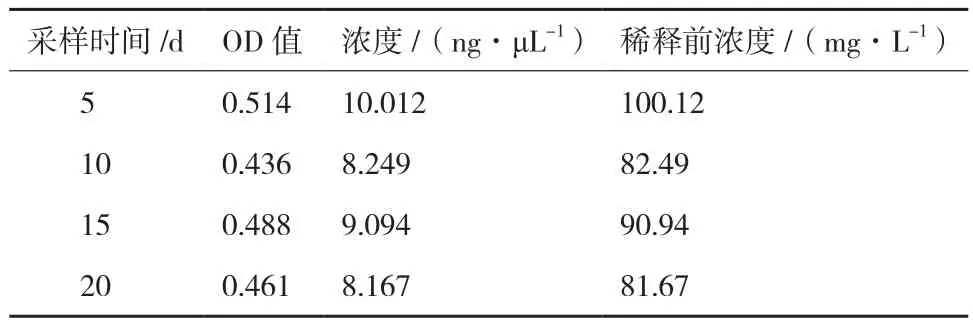
表3 检测乳清样品中rhSOD1的浓度
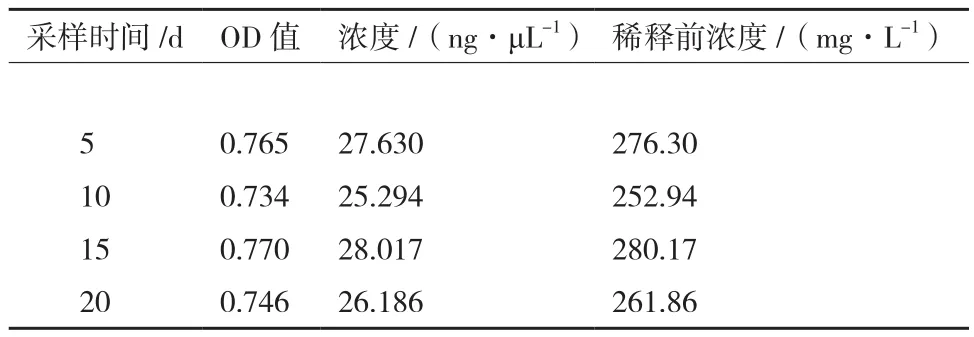
表4 检测乳清样品中rhSOD3的浓度
2.6 转基因山羊乳汁中rhSOD的体外活性检测
经WST-8试剂盒检测,结果(表5)显示,转基因山羊乳清中SOD总活性的平均值为1432±157 U/mL,正常山羊乳清的SOD活性为3.4 U/mL。表明该双转基因克隆山羊的表达产物具有较好的生物学活性。

表5 转基因山羊乳清中rhSOD的酶活性
3 讨论
目前,国内外报道的多数 rhSODs是由大肠杆菌[10-11]、毕赤酵母[12]、酿酒酵母[13-14]、昆虫细胞[15]、中国仓鼠卵巢细胞[16]、植物[17-18]及鸡[19]等系统表达,而应用转基因动物乳腺生物反应器同时表达rhSOD1 和 rhSOD3 尚未见报道。本实验通过Western blot分析发现,表达的hEC-SOD分子量约为32 kD,而hEC-SOD的理论分子量为26.7 kD,从两者的差异来看,在转基因山羊奶中表达的 hEC-SOD蛋白为该蛋白的糖基化形式[19]。研究发现,在山羊奶中检测到的 rhSODs 与野生型hSODs具有相似的分子量和生物学活性,表明 rhSODs在乳腺上皮细胞中能正确折叠和进行多种修饰,更接近天然结构;同时,可以避免大肠杆菌系统中可能存在内毒素污染问题的发生[12,20]。与之相比,上述原来的表达系统还存在其他缺陷,如在毕赤酵母、昆虫细胞和CHO细胞中表达的重组蛋白,其糖基化过程不是错误的就是不完整的[21]。
山羊奶中某些氨基酸含量较高(特别是含硫),以及丰富的饱和短链脂肪酸和矿物质(主要是K、Ca、Mg、Fe 和 Cu)。因此,与牛奶相比具有更高的缓冲容量和更丰富的营养价值[22]。1998年,Gui等[23]在SODs的稳定性研究中发现,采用经典的巴氏杀菌法杀菌后仍然可以保持其生物活性,说明该转基因羊奶可以用于生产鲜乳制品。2009年,Milesi等[24]报道口服SODs可能存在缓解疼痛的效果,尤其是在减轻压力和缓解疲劳上。由此推出,口服含SODs的山羊奶具有极高的营养价值与有益的护理作用。
双载体系统在多种物种间都能有效表达,如大肠杆菌、果蝇[25-26]、中国仓鼠卵巢细胞[27]和家蚕[28]等。然而,在中大型动物生物反应器上运用双载体来表达重组蛋白是少见的。本研究构建的双载体表达系统在山羊乳腺中能有效表达,表明这两个载体均保持完整,且独立表达,互不影响。这是第一个在转基因羊奶中同时表达具有生物活性的hCuZn-SOD和hEC-SOD的研究,并且转基因克隆山羊及其后代没有表现出异常,说明我们的表达载体和rhSODs没有影响山羊的正常生长发育与繁殖。
应用可选择标记基因(Selectable marker gene,SMG)是筛选转基因细胞系和生产转基因山羊的关键步骤。目前的研究表明,仅用一种转基因含标记基因(SMG)来筛选出具有双基因的转基因细胞系是可以的。这一发现可以提高转基因效率,减少工作量。例如,在我们的研究中hSOD1用新霉素抗性基因标记,而hSOD3不采用标记基因,两者在共转染后会出现4种情况:(1)只转成功hSOD1;(2)只转成功hSOD3;(3)hSOD1和hSOD3均转成功;(4)均未转失败,但是空的。其中,能存活下来的只有情况1和3,大大缩短时耗。因此,我们设计仅用一个载体含标记基因的双载体表达系统来制备转基因动物。在我们的研究中,rhSOD1在3'位点有一个新霉素抗性基因,而rhSOD3没有,将双转基因山羊与野生型公羊交配,以期获得rhSOD3单基因整合的山羊不带标记基因。这将是在不需要SMG的情况下提高转基因山羊上调基因的有效方法。
在本研究中,我们通过SCNT技术成功制备出能同时表达hSOD1和hSOD3转基因克隆山羊。结果表明,将两个独立的载体共整合入供体细胞中,其转基因细胞系具有去分化和发育的潜力。
4 结论
本研究表明,整合了hSOD1或hSOD3功能基因的两个乳腺特异性表达载体均可在转基因山羊奶中表达,且重组蛋白保持其生物学活性。本研究通过一个载体标记Neo基因的双载体表达系统共转染到山羊胎儿成纤维细胞中,获得了双转基因细胞系,并应用体细胞核移植制备出双转基因山羊。在乳腺中表达 rhSDODs 鲜有报道,本研究为未来大规模生产rhSODs用于食品、化妆品、医疗等领域开辟了一条新路径。
