泰山4种优势造林树种叶片凋落物分解对凋落物内细菌群落结构的影响
2019-06-04李传荣张彩虹
路 颖,李 坤,梁 强,李传荣,张彩虹,*
1 国家林业局泰山森林生态系统定位研究站,泰安 271018 2 山东农业大学农业生态与环境重点实验室,泰安 271018
凋落物分解是森林土壤有机质和养分的主要来源之一,为微生物提供了丰富的营养源[1-2]。不同的森林凋落物可以通过形成不同的微环境直接影响土壤细菌群落结构的组成,从而影响其分解速率[3-5]。目前关于凋落物分解过程中微生物群落变化的研究主要是关注土壤中微生物群落结构[6-7],而对分解过程中凋落物内微生物群落结构的研究涉及较少[8]。细菌作为微生物中数量最大、种类最多的一类,具有含氮量高、含碳量低的特点,对土壤养分的形成与分解有促进作用[9-11]。研究认为细菌在凋落物分解中的贡献被低估,当分解到后期时,凋落物养分降低,细菌群落生物量升高[12-13]。目前细菌结构及多样性研究逐渐受到关注[14-15]。
长期以来,土壤微生物研究受技术手段的限制,无法真实地、更全面地反映土壤微生物群落多样性[16],特别是在凋落物分解过程中[17]。新一代高通量测序技术在整体水平上破译了土壤微生物群落结构,将有助于获得土壤微生物群落结构的更全面而完整的信息,已经成为研究土壤微生物多样性的常规手段[6,18]。目前,应用Illumina Miseq高通量测序技术研究凋落物内微生物群落结构方面的内容仍然较少。
泰山森林生态系统作为暖温带落叶森林生态系统的代表,已经受到研究者的关注。该系统树种组成单一,结构简单,往往是由一种乔木组成的纯林,林地内凋落物层稀薄导致土壤肥力较低,不利于森林群落长期持续地发展。这就要求深入了解林内养分的循环情况。因此,本研究采用高通量测序技术对细菌16S rDNA V4—V5区扩增产物进行双端测序,分析了泰山四种优势造林树种叶片凋落物分解对细菌群落结构的影响,为研究叶凋落物分解的微生物控制机制提供理论依据。
1 研究材料和方法
1.1 研究区概况
研究地点位于泰山森林生态系统观测研究站(117°05′—117°09′E,36°17′—36°20′N),本站位于山东省药乡林场。属于暖温带大陆性季风气候,年均气温18.5℃,年均降水量758 mm,主要集中在6—9月。中低山丘陵地貌,主要土壤类型为中性至酸性棕壤,土层较薄,厚度为20—30 cm。地带性植被类型为暖温带落叶阔叶林,目前森林覆盖率达81.57%,植被覆盖率达90%以上。主要森林类型为油松(Pinustabulaeformis)、侧柏(Platycladusorientalis)、赤松(Pinusdensiflora)、刺槐(Robiniapseucdoacacia)、麻栎(Quercusacutissima)的人工林。
1.2 研究方法
1.2.1试验设计及样品分析
样品收集:本项目采用泰山站附近4种主要树种的叶片凋落物作为分解的材料。为了保证后期分解试验的顺利开展,在试验开始之前收集刺槐(RP)、麻栎(QA)、赤松(PD)和油松(PT)的叶凋落物。叶凋落物收集采用林内收集筐的方式,于2015年9—10月在各物种的纯林内布设10个凋落物收集筐,并使收集筐分布广泛来减少误差,将收集到的同种凋落物混合均匀,以备使用。将收集到的叶凋落物置于室内风干备用。取小部分样品在65℃烘箱内烘干至恒重,计算分解底物风干/烘干换算系数比(计算含水量)。并测定初始样品的C、N、P和木质素含量。
试验布设及取样:采用通用的凋落物袋的方法,根据分解时间的长短以及所测指标的用量,每个凋落物袋中装入风干的样品6 g,并根据样品量选择凋落物袋的大小为15 cm×15 cm(网孔大小为1 mm×1 mm)[19]。2016年7月,采用随机区组设计将分解袋布设于6个重复的试验区内,小区大小为10 m×10 m,相邻小区设置5 m×5 m的隔离带,每个小区包含所有4个处理。将样品置于土壤表层,先清理掉土壤表面的凋落物,然后用自制U型钉将凋落物分解袋固定于土壤表面。试验持续时间为一年,2017年7月取样。取样时,每个小区中每种处理取1袋,清除凋落物表面粘附的土壤和长入的杂草。其中3袋重复样品标记后立即存于液氮中,用于测定微生物细菌群落。样品DNA的提取以及细菌多样性数据的分析由北京诺禾致源科技股份有限公司完成。另外的3袋重复样品在实验室内去除其中的杂质,65℃烘干至恒重,然后称重,并测定其灰分含量,用于矫正干重。同时测定样品的C、N、P和木质素含量。
干重剩余率用Olson[20]负指数衰减模型y=ae-kt进行拟合。式中,y为干重残留率,a为修正参数,k为分解系数,t为分解时间。凋落物中C、N含量采用元素分析仪(Vario Max CN),P含量采用钼锑抗比色法,木质素含量根据中国国家标准(GB/T 2677.8—1994; GB/T 10337—2008),采用逐步提取和重量分析法。简而言之,样品用苯酚乙醇溶液浸提后,用72%浓硫酸溶液水解,然后将悬浮物过滤掉,用蒸馏水漂洗残余物质直至在BaCl2溶液中澄清。
1.2.2样品DNA提取和测序
样本基因组DNA的提取采用CTAB方法,采用琼脂糖凝胶电泳检测DNA纯度和浓度。16S rDNA V4—V5 区引物 515F/907R,将 Bar-code 序列通常加在515F的5′末端,引物如下:515F:5′-GTGCCAGCMGCCGCGGTAA-3′;907R:5′-CCGTCAATTCCTTTGAGTTT-3′。PCR 扩增体系:2*taq PCR mix:25 μL;Primer F(10 μmol/L):1 μL;Primer FR(10 μmol/L):1 μL;gDNA:2.5 μL;H2O:8 μL。PCR反应程序为:95℃预变性5 min;34个循环包括(94℃,1 min;57℃,45 s;72℃,1 min);72℃,10 min;16℃,5 min。New England Biolabs 公司的Phusion® High-Fidelity PCR MasterMix with GC Buffer和高效高保真酶进行PCR,确保扩增效率和准确性。委托北京诺禾致源测序公司(Novegene,China) 进行高通量测序。
1.3 数据处理
利用Uparse软件(Uparse v7.0.1001)对所有样品的全部有效数据进行聚类,选择97% 相似水平的OTU代表序列进行分析。利用Qiime软件(Version 1.35.1)计算样品的α多样性指数,反映不同树种叶片凋落物分解过程中细菌群落的丰度和多样性,包括Chao1指数、ACE指数、Coverage指数、Simpson指数和Shannon指数。利用R软件(Version2.15.3)进行叶片分解细菌群落的NMDS分析。用Anosim方法对组间群落相似度进行非参数检验[21]。不同叶片凋落物初始化学元素、分解速率以及主要细菌优势类群相对丰度、细菌多样性之间的差异采用单因素方差分析。叶片凋落物性状和细菌群落的NMDS用Canoco 5.0进行分析。
2 结果分析
2.1 不同物种叶凋落物分解过程的差异
从表1可以看出,选择的4种叶凋落物初始化学性质之间存在显著差异。C含量表现出针叶树种(赤松PD、油松PT)显著高于阔叶树种(刺槐RP、麻栎QA)(P<0.05);N含量、N/P比麻栎树种显著低于其他3个树种(P<0.05),而C/N比麻栎显著高于其他3个树种(P<0.05);木质素含量和木质素/N比赤松树种均显著低于其他树种(P<0.05),其中油松木质素含量最高,显著高于其他3个树种(P<0.05),麻栎的木质素/N比最高,显著高于其他3个树种(P<0.05)。
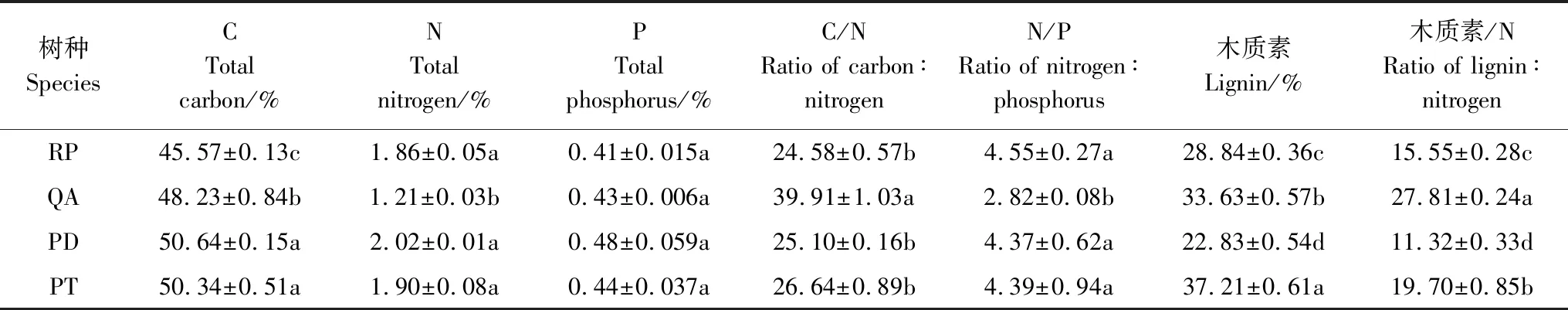
表1 叶片凋落物初始化学元素含量的差异
RP:刺槐,Robiniapseucdoacacia;QA:麻栎,Quercusacutissima;PD:赤松,Pinusdensiflora;PT:油松,Pinustabulaeformis;同列不同的小写字母代表不同处理之间在0.05水平差异显著
对4种树种叶凋落物分解一年后化学元素含量与初始化学元素含量进行对比分析,结果如图1所示。选择的4种叶凋落物分解一年后化学元素含量与初始化学元素相比均存在显著差异。C含量均显著降低(P<0.05);N含量除赤松升高不显著之外,其他3个树种均显著升高(P<0.05);P含量除刺槐升高不显著之外,其他3个树种均显著升高(P<0.05);木质素含量除赤松降低不显著之外,均表现为显著降低(P<0.05)。
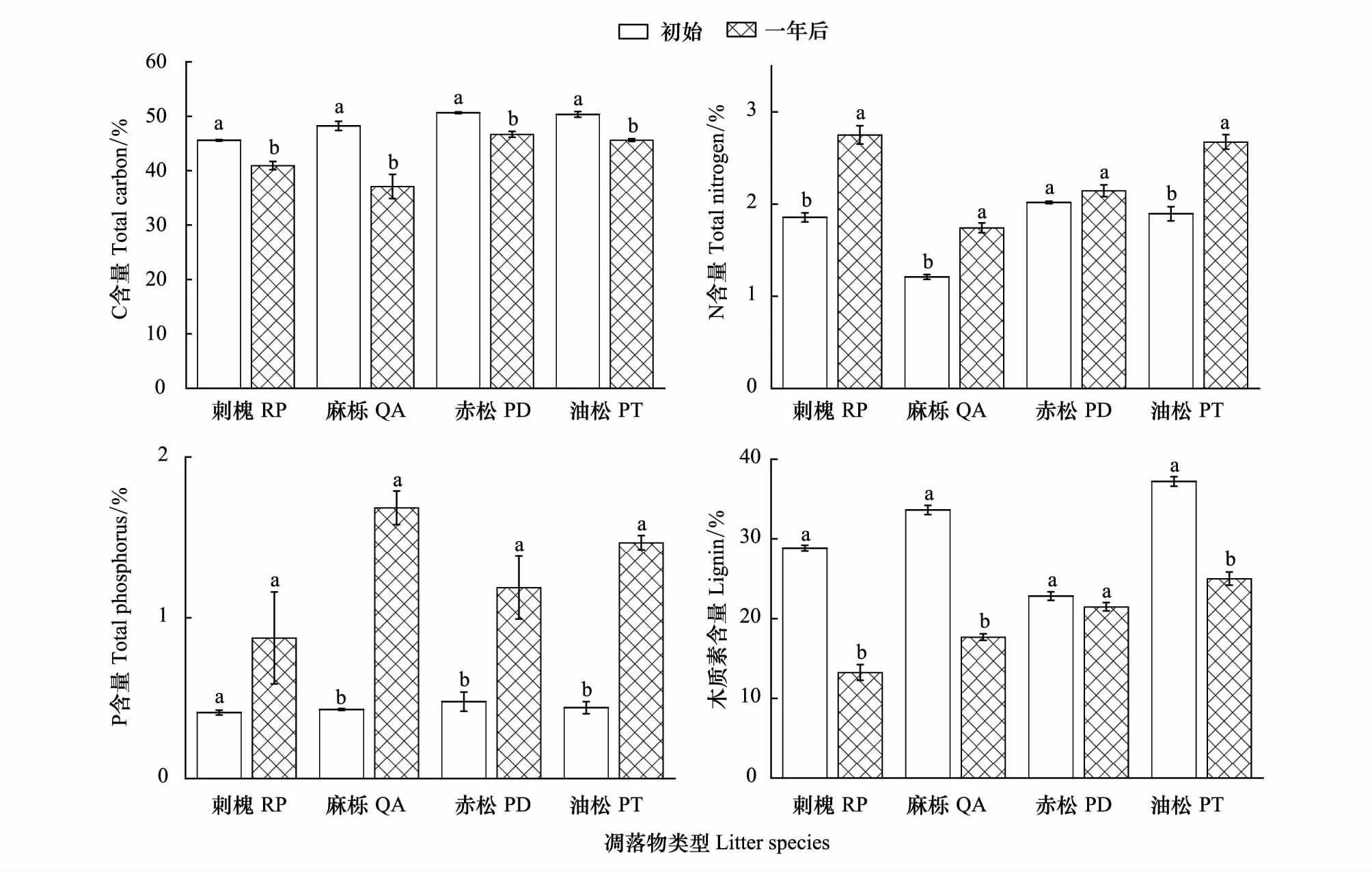
图1 4种叶凋落物分解一年后化学元素含量与初始化学元素差异Fig.1 Differences in element content between initial and after decomposing in one year for four leaf litterRP:刺槐,Robinia pseucdoacacia;QA:麻栎,Quercus acutissima;PD:赤松,Pinus densiflora;PT:油松,Pinus tabulaeformis;不同的小写字母代表不同处理之间在0.05水平差异显著
泰山4种主要优势造林树种叶凋落物分解速率之间差异显著(P<0.05)。图2可见,刺槐分解速率显著高于其他3个树种(P<0.05),而麻栎、油松、赤松之间差异不显著(P>0.05),分解快慢表现为刺槐>赤松>油松>麻栎。
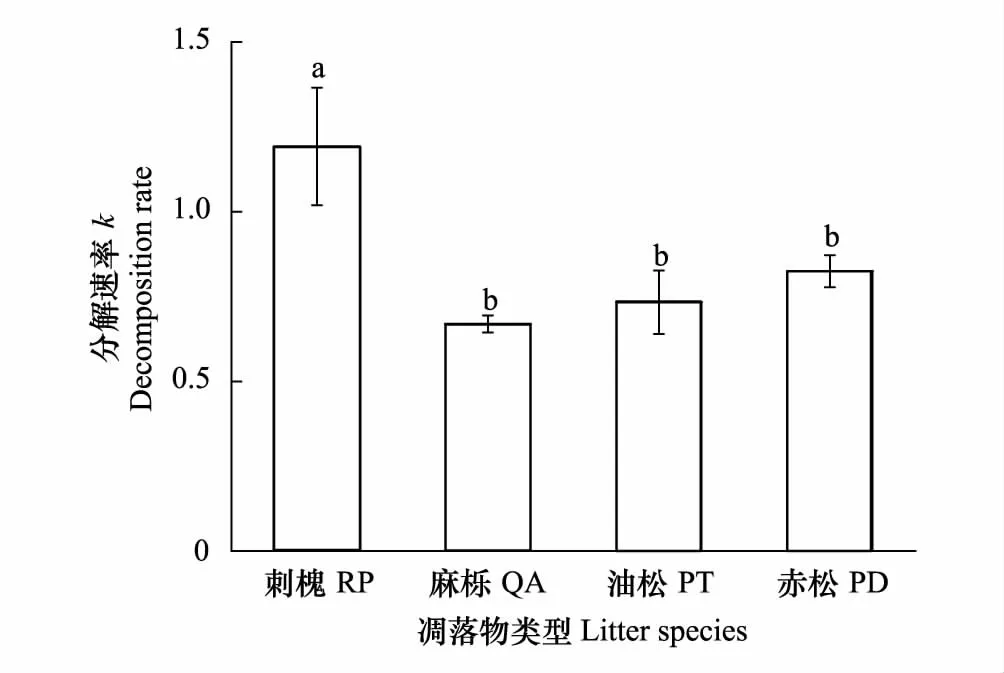
图2 4种植物叶片凋落物分解速率k之间的差异Fig.2 Difference in decomposition rate k between four plants
2.2 高通量测序数据的优化分析
利用Qiime软件做Rarefaction 分析,制作稀释曲线(图3)。由图3可见,随着测序序列数目的增加,12个测序样本的曲线基本趋向平稳,表明测序趋于饱和,测得的数据量渐近合理,能较真实地反应这12个样品中的微生物群落,结合表4中的样品覆盖率,说明测序结果中包含了大多数微生物类群,更多的测序数据对新的OUT贡献率较小,基本可以反映叶凋落物分解过程中微生物群落结构组成,但可能仍有少量微生物种类未被发现。
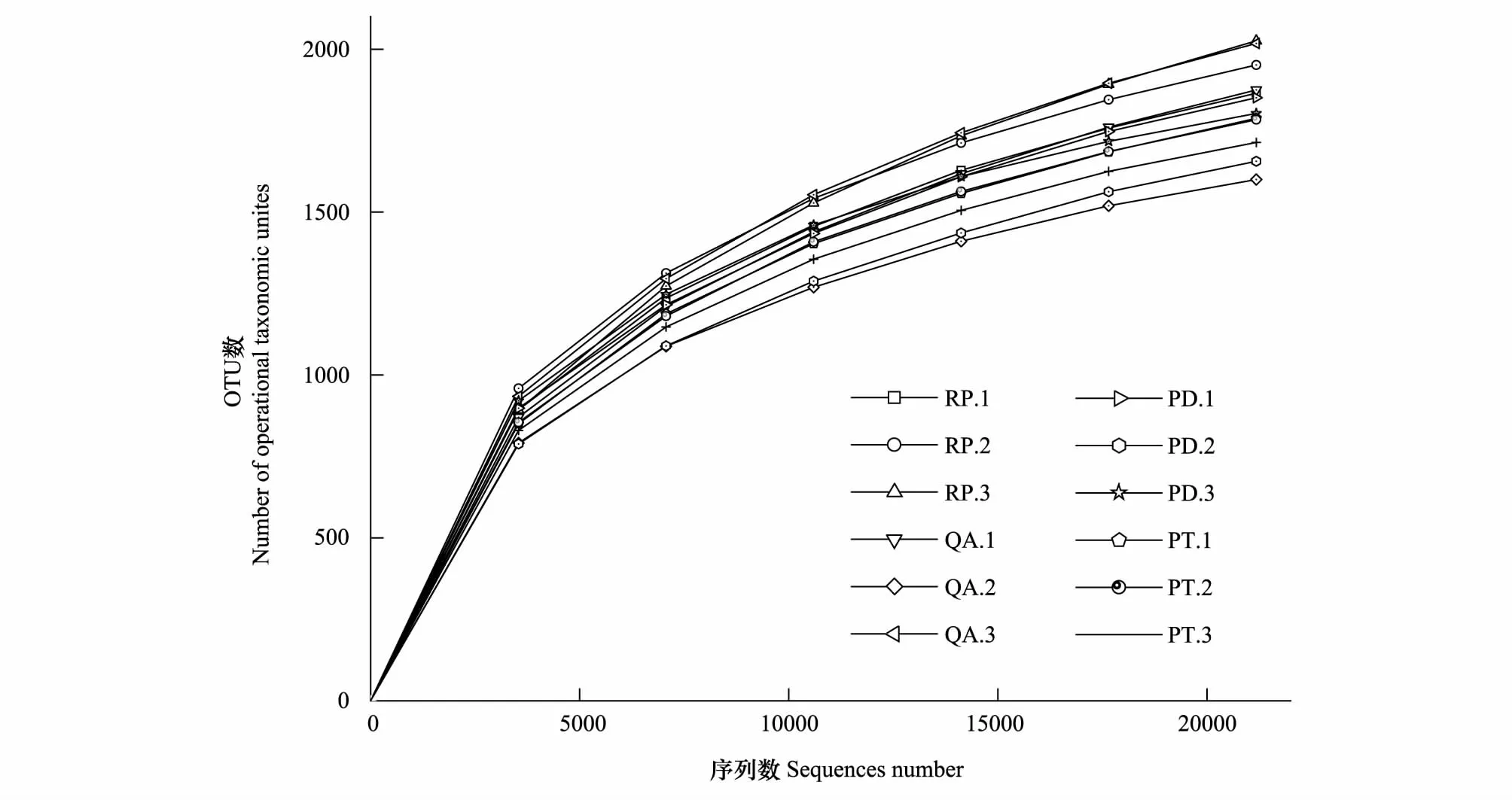
图3 稀释曲线Fig.3 Rank AbundanceRP:刺槐,Robinia pseucdoacacia;QA:麻栎,Quercus acutissima;PD:赤松,Pinus densiflora;PT:油松,Pinus tabulaeformis;数字1.2.3表示同一处理的3个重复
2.3 细菌群落结构分析
高通量测序的结果显示所有样品一共获得643440条有效序列,其中最少序列为37636条,最多序列为71004条(平均序列条数为53620条)。这些序列分属于35门,92纲,121目,246科,410属,206种。根据分类学注释结果,分别在门和纲水平下进行样品物种丰度的统计分析。从图4可见,在门水平上,叶片凋落物分解中细菌类群多集中于变形菌门(58.8%,Proteobacteria)、放线菌门(15.3%,Actinobacteria)、拟杆菌门(11.9%,Bacteroidetes)、酸杆菌门(3.7%,Acidobacteria),占总序列的89.7%,其中变形菌门占绝对优势。在纲水平上,平均相对丰度大于5%的类群为α-变形菌纲(37.2%,Alphaproteobacteria)、β-变形菌纲(10.6%,Betaproteobacteria)、不明放线菌纲(11.1%,unidentified-Actinobacteria)、鞘脂杆菌纲(9.8%,Sphingobacteria)、γ-变形菌纲(8.6%,Gammaproteobacteria)、δ-变形菌纲(5.6%,Deltaproteobacteria)。

图4 叶片分解对细菌优势群落相对丰度的影响Fig.4 The relative abundance of dominant bacterial communities after one year of leaf litter
细菌群落的NMDS分析结果显示(图5),Stress为0.084,说明NMDS可以准确反映样品间的差异程度。样品的空间差异明显,4个树种之间油松和赤松表现出较高的相似性,聚类位置较为接近。即除油松和赤松间差异较小外,其他树种间差异程度均较大。用Anosim方法对组间群落相似度进行非参数检验。结果也显示(表2),除油松和赤松外,细菌群落结构均存在显著差异,与图5结果一致。

表2 组间细菌群落结构差异Anosim显著性检验
R值介于(-1,1)之间,R-value大于0,说明组间差异显著。R-value小于0,说明组内差异大于组间差异

图5 叶片分解细菌群落的非度量多维尺度(NMDS)分析 Fig.5 Non-Metric Multi-Dimensional Scaling (NMDS) analysis of bacterial community in leaf decomposition
由图6可知,在门的水平上,刺槐叶凋落物分解一年后相对丰度最大的变形菌门显著低于麻栎和赤松(P<0.05),而放线菌门显著高于其他3个树种(P<0.05);麻栎叶凋落物分解中变形菌门和酸杆菌门显著高于其他3个树种(P<0.05),而拟杆菌门显著低于其他3个树种(P<0.05);赤松和油松在4个门中差异均不显著(P>0.05)。在纲的水平上,刺槐叶凋落物分解中不明放线菌纲显著高于其他3个树种(P<0.05),麻栎叶凋落物分解的鞘脂杆菌纲的相对丰度显著低于其他3个树种(P<0.05)。

图6 4种处理之间主要细菌优势类群相对丰度的差异Fig.6 Differences in relative abundances of major bacterial dominant groups between the four treatments
群落结构的变化主要是由优势种的变化引起的,我们选择4个处理细菌群落中相对丰度前5位的优势种进行进一步分析,结果如表3所示。由表可知,Bradyrhizobiumelkanii和Luteibacterrhizovicinus在4个处理中都为优势种;Sphingomonassoli和Streptomycesprunicolor是刺槐处理特有的优势种;Labrysmiyagiensis和Sphingomonassanxanigenens是麻栎特有的优势种;油松和赤松的优势种较为相似,其中Chitinophagapinensis是赤松所特有,而Cercisgigantea是油松所特有。

表3 4种叶凋落物细菌群落中优势种的相对丰度差异
2.4 叶片凋落物分解对细菌多样性的影响
从表4可以看出,叶凋落物分解一年后微生物基因序列的覆盖率均达到96.8%以上,说明所测定序列可以充分反映样本细菌群落的种类和结构。4个树种叶凋落物分解一年后细菌丰富度(OUT、观测到的物种数、Chao1和ACE)和系统发育多样性(PD)之间有显著差异(P0.05),且阔叶树种刺槐和麻栎高于针叶树种赤松和油松。菌群多样性香浓维纳指数麻栎最低,显著低于其他3个树种(P0.05),表现为刺槐>赤松>油松>麻栎。

表4 叶凋落物分解一年后细菌多样性统计分析
2.5 叶片凋落物性状与细菌群落NMDS分析
利用Canoco5.0软件对叶片凋落物性状和细菌群落进行NMDS分析(图7),结果显示,Stress值为0.0005,说明本分析具有很好的代表性,叶片凋落物性状与细菌群落之间的影响特别适合用NMDS进行评估。在所研究的21个因子中, 根据NMDS分析结果显示, 分解速率k值与初始C/N比相关性最大,其次是与初始的木质素/N比和菌群多样性香浓维纳指数;菌群多样性香浓维纳指数与叶片凋落物初始木质素/N比相关性最大,其次是初始木质素含量和C/N比;细菌群落覆盖率及菌群丰度指数(Chao1、ACE)与分解一年后的N含量、木质素含量以及C含量相关性较大;细菌群落物种数与分解一年后N含量、N/P比以及P含量相关性较大。
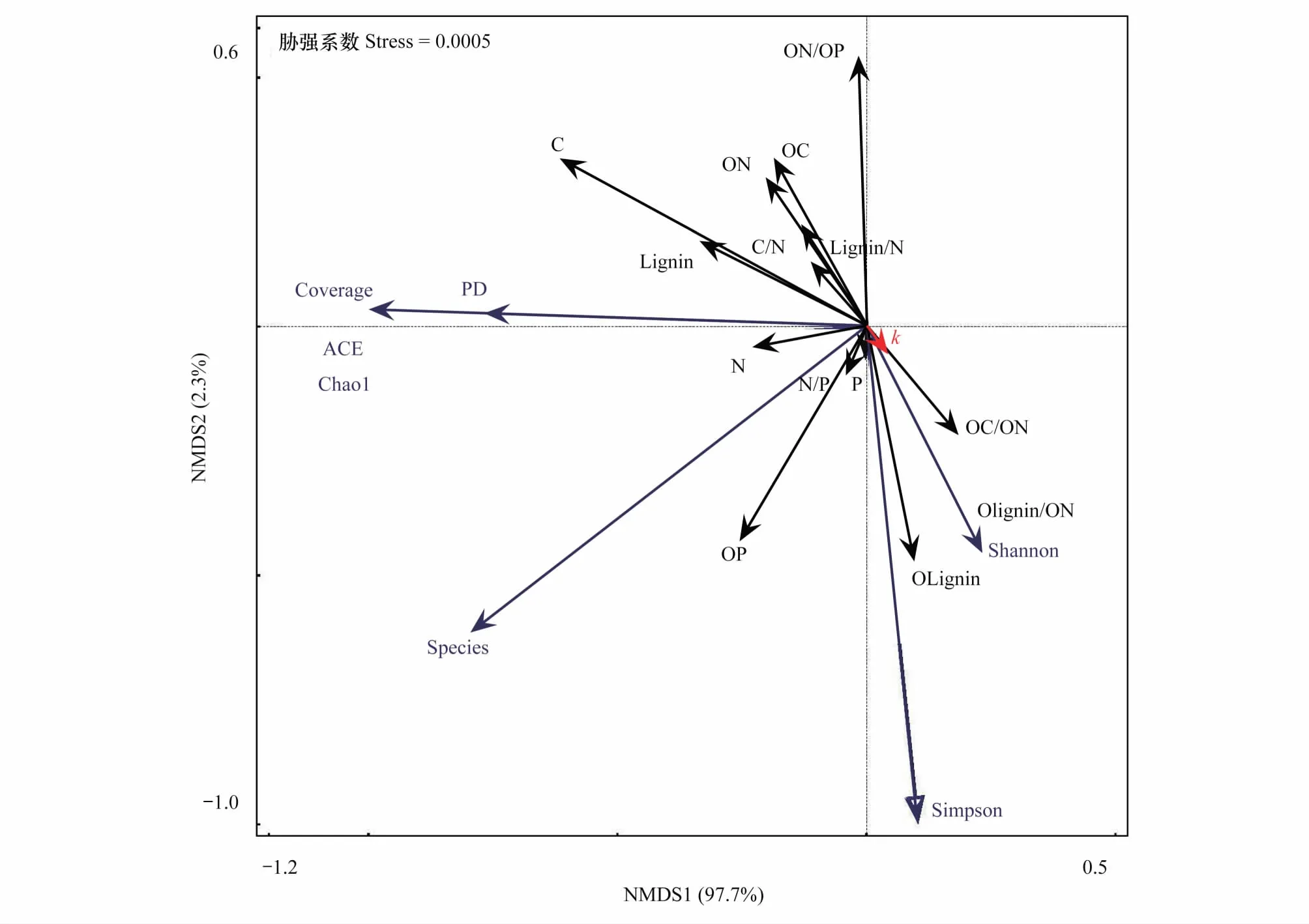
图7 叶片凋落物性状和细菌群落的非度量多维尺度(NMDS)分析Fig.7 Non-Metric Multi-Dimensional Scaling (NMDS) analysis of leaf litter characters and bacterial communitiesC:总碳含量,Total carbon;N:总氮含量,Total nitrogen;P:总磷含量,Total phosphorus;C/N:碳氮比,Ratio of carbon: nitrogen;N/P:氮磷比,Ratio of nitrogen: phosphorus;Lignin:木质素含量,Lignin;Lignin/N:木质素氮比,Ratio of lignin: nitrogen;OC:初始总碳含量,Original total carbon;ON:初始总氮含量,Original total nitrogen;OP:初始总磷含量,Original total phosphorus;OC/ON:初始碳氮比,Ratio of original carbon∶original nitrogen;ON/OP:初始氮磷比,Ratio of original nitrogen∶original phosphorus;OLignin:初始木质素含量,Original lignin;OLignin/ON:初始木质素氮比,Ratio of Original lignin∶Original nitrogen;Species:物种数,Observed-species;Coverage:覆盖率,Coverage;Chao1:Chao1指数,Chao1 index;ACE:ACE指数,ACE index;PD:PD指数,PD index;Shannon:香浓维纳指数,Shannon-Wiener index;Simpson:Simpson指数,Simpson index;k:分解速率,decomposition rate k
3 讨论
3.1 不同造林树种叶片凋落物化学元素含量的差异
凋落物性质与物种密切相关[22]。选择的4种叶片凋落物初始化学性质之间存在显著差异(表1)。研究表明,凋落物中C含量越低,分解速率越快[19]。本研究中C含量表现出针叶树种(赤松PD、油松PT)显著高于阔叶树种(刺槐RP、麻栎QA),其中刺槐的C含量最低,这可能是刺槐分解较快的原因。大量的研究发现,凋落物初始N含量以及与N相关的底物质量指标和凋落物分解速率有很好的相关关系,C/N比和木质素/N比等指标常被用于预测凋落物的分解速率[23-24]。本研究结果显示,N含量、N/P比麻栎树种显著低于其他3个树种,而C/N比、木质素/N比麻栎显著高于其他3个树种,这也可能是麻栎分解较慢的原因。由于N、P有效性在不同生态系统间的差异,因此有些研究者认为N和P对凋落物分解限制的相对重要性也不同,当N/P比低时受N限制,当N/P比高时受P限制(通常认为N/P比<14时受N限制,N/P比>16时受P限制,当N/P比在14和16 之间受到N、P的共同限制)[25]。本研究结果N/P比均<14,所以在本研究区域凋落物分解受N含量限制较多。
选择的4种叶凋落物分解一年后化学元素含量与初始化学元素相比均存在显著差异(图1)。结果显示,4种树种叶片凋落物C含量均显著降低,与赵谷风等[26]对青冈常绿阔叶林凋落物分解过程中营养元素动态研究结果一致。叶片凋落物分解一年后,4种叶片凋落物中N、P含量总体均呈增大趋势,与葛晓敏[27]、施昀希[28]等研究的结果相吻合。N和P在含量上的增加都是十分普遍的。N含量的提高与微生物固N、降水及菌根的吸收等作用有关[29]。有研究表明,凋落物分解的初级阶段经常需要富集P,因为新鲜凋落物中的P养分不足以维持分解者的生长,而凋落物分解速率常与P及其相联系的凋落物质量指标显著相关[3,30]。木质素在凋落物分解过程中属于难分解成分[19],在木质素含量高(>25%) 的凋落物中,木质素是预测凋落物分解的较好指标[31]。本研究结果显示,木质素含量除赤松降低不显著之外,均表现为显著降低。覃扬浍等[32]对漓江流域岩溶区檵木群落不同恢复阶段凋落物分解初期动态研究发现,经过一年分解后,乔林阶段木质素含量较初始含量有所减少,这与本研究结果一致。
3.2 不同造林树种叶片凋落物分解一年后细菌群落结构与群落多样性的差异
前人研究认为细菌在分解后期起主要作用[13,33]。叶凋落物细菌群落NMDS分析(图5)与Anosim组间细菌群落结构差异显著性检验(表2)均显示,除油松和赤松外,细菌群落结构均存在显著差异。分解一年后,主要的优势细菌门是变形菌门、放线菌门、拟杆菌门和酸杆菌门(图4)。朱平等[5]在青藏高原北麓河流域分析草甸、草原和荒漠草原土壤细菌群落结构差异发现主要优势菌群为变形菌门、放线菌门、酸杆菌门、拟杆菌门4个门类,与本研究结果一致。许多研究也表明酸杆菌门、变形菌门、放线菌门细菌是不同植被土壤中的优势群落[11,34]。例如翟婉璐、丁新景等研究表明变形菌门、酸杆菌门和放线菌门分别是林地和黄河三角洲人工林土壤中主要优势群落[15,35]。这应该与酸杆菌门、变形菌门、放线菌门3门细菌的生态幅有关,它们的生态幅较宽因此受环境影响也较小[36-37]。变形菌门细菌是土壤环境中的一大类细菌群落,部分变形菌门细菌能够利用有机物分解产生的氨气、甲烷等营养物质进行生长代谢活动[38]。本研究中,叶片凋落物分解一年后细菌相对丰度最大的是变形菌门,被视为树叶分解转化的主要功能细菌,该研究结果与先前研究结果相一致[39]。放线菌大部分属于腐生菌,Crawford等[40]的研究表明放线菌门的部分细菌种群能够产生分解木质素的酶,具有分解木质素和纤维素的能力,起到分解植物有机残体的作用。分解后期叶片凋落物残留主要是一些难分解的木质素等,刺槐的放线菌门相对丰度最大(图6),这也可能是刺槐分解最快的主要原因。拟杆菌门的细菌能破坏复杂的生物大分子,因此其与木质纤维素凋落物的分解相关[41]。本研究中,麻栎中拟杆菌门的相对丰度显著低于其他3个树种(图6),这主要由于麻栎初始木质素含量以及木质素/N比含量较低(表1),不利于拟杆菌门的生长。有研究表明酸杆菌门细菌在不同pH土壤中相对丰度不同,在酸性土壤中丰度较高,碱性土壤中较低[42]。本研究样地土壤pH值6.5左右[43],呈弱酸性,所以酸杆菌门相对丰度较高。其中麻栎中酸杆菌门的相对丰度显著高于其他3个树种(图6),而C含量也相对较低,这与前人研究略有差异[44]。这可能是因为前人研究的是可溶性有机碳,而我们测得是凋落物内全碳含量。Magill等[45]对森林土壤的研究表明,土壤中N含量的增加会使酸杆菌门的多样性增加。而本研究结果显示麻栎的N含量最低而酸杆菌门的相对丰度却最大,与前人结果相反。这可能与研究条件不同有关,我们研究的是凋落物内N含量而不是土壤中N含量。
在纲的水平上,叶片凋落物分解一年后,α-变形菌纲、β-变形菌纲、不明放线菌纲、鞘脂杆菌纲、γ-变形菌纲、δ-变形菌纲相对丰度较高,其中α-变形菌纲的相对丰度最大(图4)。α-变形菌包括大量的参与C、N循环的细菌、这些细菌的增加对生态系统氮的稳定性和土壤能量的平衡起到重要的作用,对植物生长具有重要意义[35]。研究结果显示,刺槐分解中不明放线菌纲显著高于其他3个树种(图6,P<0.05),这与前面放线菌门的结果一致(图4)。麻栎凋落物叶分解的鞘脂杆菌纲的相对丰度显著低于其他3个树种(图6,P<0.05)。鞘脂杆菌纲有利于凋落物中纤维素的降解[46],这可能是麻栎分解最慢的原因(图2)。
在种的水平上,Bradyrhizobiumelkanii和Luteibacterrhizovicinus在4个树种中都为优势种(表3)。埃氏慢生根瘤菌(Bradyrhizobiumelkanii)是主要的固氮菌种,C/N比是调控地上植物群落与固氮微生物群落动态的关键因子[47]。本研究结果也显示在4个树种中埃氏慢生根瘤菌的相对丰度与叶片凋落物初始C/N比相一致。Luteibacterrhizovicinus属于黄单胞菌科(Xanthomonadaceae),是主要产几丁质酶的菌株[48],有助于叶片凋落物的分解。除此之外,每个树种也都有自己所特有的优势种(表3)。不同树种中优势种的差异也可能是造成物种间群落结构差异的一个重要原因。四种叶片凋落物分解一年后,细菌丰富度(OUT、观测到的物种数、Chao1、ACE)和系统发育多样性(PD)之间存在差异,且阔叶树种刺槐和麻栎高于针叶树种赤松和油松(表4)。前人对叶片凋落物分解的研究结果也发现针叶凋落物内细菌多样性低于阔叶凋落物[8],与本研究结果一致。不同的树种凋落物中含有不同的碳源和氮源,驱使土壤微生物集群定向进化,进而改变土壤肥力,阔叶林之间微生物群落结构组成相近[39]。其原因可能是阔叶林树叶分解引入土壤中碳含量比针叶林高,且阔叶林中包含更为丰富的碳源种类,导致了阔叶林下土壤微生物多样性高于针叶林[49]。
3.3 细菌群落多样性与叶片凋落物化学性质的关系
细菌在凋落物分解上的贡献受到凋落物化学组成的影响[12]。菌群多样性香浓维纳指数与叶片凋落物初始木质素/N比相关性最大,其次是初始木质素含量和C/N比(图7)。前人大量研究也表明,细菌群落多样性与分解底物初始化学性质相关,但结论并不一致[50]。Hawke和VMlance[51]认为C/N比能够调节土壤微生物繁衍和养分释放之间的平衡。陈法霖等[6]通过研究凋落物分解过程中的土壤微生物群落发现,细菌占微生物群落的比重与凋落物初始C/N比、木质素/N比呈显著负相关。一般来说,新鲜凋落物的C/N比高于微生物分解者,微生物需要从周围环境(土壤或降水) 获取养分来维持其自身的生长需求[52]。细菌群落覆盖率及菌群丰度指数(Chao1、ACE、PD)与分解一年后的N含量、木质素含量以及C含量相关性较大;细菌群落物种数与分解一年后N含量、N/P比以及P含量相关性较大(图7)。Zhao等[53]的研究发现分解过程中细菌群落结构受到凋落物内C含量的调节,而凋落物N含量并不会影响细菌群落结构。本结果显示菌群多样性与凋落物内N含量有很大相关性,与其结果不一致。这可能是由于研究环境条件的差异,本研究关注的是叶片凋落物在森林中的分解,而该研究关注的是叶片在淡水中的分解。而且研究方法也不同,本研究结果是基于高通量测序,更能真实地、全面地反映微生物群落多样性。Zhao等[44]认为细菌丰度与磷浓度正相关。研究还发现细菌群落数与P含量相关性较大,与其结果一致。不过与N相比,人们对P与微生物结构和功能的关系了解较少[54],应该更进一步的研究。
叶片凋落物性状和细菌群落的NMDS分析结果也显示(图7),分解速率k值与菌群多样性香浓维纳指数有很大的相关性。这与前人研究结果一致[8,55]。此外,研究还表明分解速率k值与初始C/N比相关性最大,其次是与初始的木质素/N比。通常C/N 比和木质素/N比高的凋落物分解较慢[1],4种树种中麻栎的C/N比和木质素/N比都最高,且分解最慢,与前人结果一致。在本研究区域泰山森林生态系统中,对于细菌群落多样性和叶片凋落物化学性质两个因素来说,分解速率与凋落物化学性质相关性更大一些。
