热钾碱溶液脱除沼气中CO2的反应动力学
2019-06-04张良佺欧阳书情毛琰昊盖希坤杨瑞芹单胜道
张良佺 欧阳书情 毛琰昊 盖希坤 杨瑞芹 单胜道
(浙江科技学院生物与化学工程学院, 杭州 310023)
0 引言
沼气作为一种可再生能源,主要通过有机废水、动物粪便以及其他农业废弃物厌氧污泥发酵产生,主要成分为CH4和CO2。其中CH4体积分数在40%~70%范围内,CO2体积分数在15%~35%范围内,由于CH4含量较低,CO2含量高,限制了沼气的应用。通过对沼气进行净化和提纯处理,脱除CO2后可获得高纯度甲烷气,因而可广泛应用于车用能源、化工原料、天然气等领域。
沼气提纯方法目前主要分为化学吸收法和物理吸收法。化学吸收法因吸收速率快、吸收容量高,是目前捕集CO2的主要方法。化学吸收法中常用的吸收剂是碱性化学吸收液,主要分为热钾碱和有机胺类[1-9]。
当前,针对热钾碱吸收CO2,学者们的研究主要分为3方面[10-14]:吸收过程基本化学性质、吸收过程热力学性质、吸收过程动力学性质。基本化学性质研究目前多集中于新型吸收剂开发,如基于基团贡献法对吸收剂进行筛选;热力学研究主要包括针对吸收反应过程热效应的测定、工业装置的节能降耗以及热力学模拟,也有学者从热力学基本理论出发,对CO2吸收过程提出了新的反应机理[15]。作为工业反应器设计和操作优化的基础,化学反应动力学方程的建立极为重要。由于CO2吸收过程反应温度不高,通常在50~70℃之间,较低的温度水平使得反应速率常数对温度变化的敏感度增大,反应活化能的准确测定变得极为困难。因此,众多学者依据不同反应过程原理,采取不同型式的反应器和工艺,结合不同的操作条件,对CO2吸收过程的动力学行为进行了研究[16-20]。
上述研究所建立的动力学方程都是基于DANCKWERTS[21]于1970年提出的3独立反应机理,该机理认为CO2与OH-之间的反应是整个过程的控制步骤,其速率就是整个吸收过程的速率,其他反应则达到平衡。
当前,对于沼气系统中CO2的脱除动力学研究尚未见文献报道,CH4组分对CO2吸收速率的影响以及活化能及反应级数的变化情况均需进行系统研究。在此背景下,本文采取CH4和CO2混合气体模拟沼气,根据前期研究所提出的4反应串并联机理建立本征动力学方程,基于吸收双膜理论建立宏观动力学方程,并据此进行实验设计,获得反应活化能、指前因子等模型参数,以期为工业反应器设计和操作优化奠定基础。
1 实验方法

图1 二氧化碳气体吸收测定工艺流程图Fig.1 Process flow chart of carbon dioxide gas absorption measurement1.气体钢瓶 2.减压阀 3.调节阀 4.过滤器 5.质量流量计6.止逆阀 7、16.压力变送器 8.玻璃增湿器 9.双驱动搅拌吸收器 10.恒温水浴箱 11.吸收剂瓶 12.截止阀 13.皂膜流量计 14.吸收液取样阀 15、17.交流电动机
实验测定动力学工艺流程如图1所示。气体(CH4与CO2混合气)由钢瓶通过减压阀输出,经过滤器过滤除去其中的水分,通过质量流量计控制气体流量,在质量流量计出口处安装一压力变送器检测管路气体压力,然后气体进入增湿器,增湿器安放在恒温水浴箱中维持一定的温度,经增湿后的气体进入吸收瓶(即双驱动反应器),吸收瓶中存放一定浓度的热钾碱溶液,在一定的温度和一定的搅拌速率下,气液两相接触,吸收过程发生,到达规定的反应时间后,吸收液经取样阀取出,并准确量取体积,吸收后的气体经皂膜流量计放空。
双驱动搅拌吸收器是一个气液接触界面已知的设备,由玻璃制成,内管直径为70 mm,外套管直径为90 mm,高200 mm,内外套管之间通过恒温水保温,以保持反应器内反应温度一定,气相搅拌桨、液相搅拌桨的转速分别通过数显调速器调节。吸收器中液面的位置应控制在液相搅拌桨上桨的下缘1 mm左右,以保证桨叶转动时正好刮在液面上,以达到更新表面的目的。吸收液从吸收剂瓶一次准确加入。
2 结果与讨论
2.1 CO2吸收反应本征动力学方程
通过前期研究,获得CO2吸收反应机理
式中ki——i反应的速率常数

由此可推导CO2吸收反应动力学方程

式中K1、K2——反应平衡常数
(-rCO2)——CO2吸收本征反应速率
ci——i组分在吸收液中浓度
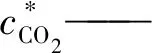
溶液中H2O是大量的,故cH2O很高,因此可以认为在整个反应过程中为定值,又由于CO2为非极性分子,在极性分子水中溶解度很小,同时OH-离子浓度远高于H+离子浓度,故也可以认为OH-离子浓度在整个反应过程中保持定值。令
k=k1cH2O+k2cOH-
则
该方程实际上是CO2吸收过程总速率方程,为拟一级可逆反应。
2.2 吸收反应宏观动力学方程
根据文献[15]分析,当气相搅拌转速较高(140 r/min以上)时,可以认为气膜传质阻力完全消去,气相主体中CO2分压与气液相界面处的分压相等;对溶液而言,溶液中H2O和OH-离子浓度较高,可以认为在整个吸收反应过程中基本保持不变,因此只需对溶液中CO2浓度进行分析计算即可,各反应组分在气液相中浓度分布如图2所示。

图2 液膜内各反应组成浓度分布示意图Fig.2 Diagram of concentration distribution of reaction components in liquid film
根据双膜论,对CO2在液膜中的吸收反应作物料衡算,公式为
式中DCO2——液膜内CO2扩散系数,m2/s
无因次化,设
得
边界条件

求解得
宏观反应速率
式中kL——CO2在液膜中的传质系数

当γ>3时,thγ≈1,则
在相界面处达到平衡
pCO2=HCO2cCO2,i
式中HCO2——CO2溶解度系数


Eob——表观活化能
R——普通气体常数
T——吸收反应温度

2.3 宏观动力学方程模型修正及参数求解
定义转化度为
即
由于溶液为非理想溶液,故需对上述宏观动力学方程进行修正,修正模型如下:


模型3
模型4
模型5
模型6
模型7
模型8
模型1属于2参数模型;模型2~6为3参数模型;模型7、8为4参数模型。
2.4 实验设计
为获得宏观动力学模型中各参数值,实验因素取4个,分别为反应温度、碳酸钾的初始浓度、反应时间以及甲烷与二氧化碳混合气中CO2体积分数,其中混合气按沼气组成配制,CO2体积分数在15%~36%范围,各因素水平为3,正交表表头设计为L9(34)形式。实验时其它条件为:气相转速140 r/min、液相转速120 r/min。实验原始数据如表1所示。

表1 实验原始数据Tab.1 Raw data
2.5 模型计算及参数求解
模型中各变量计算如下:
(1)NCO2的计算
NCO2=nCO2/(St)
其中
故
式中nCO2——CO2总吸收量,mol
S——反应的截面积,m2
VL——吸收液总体积,mL
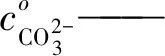
(2)转化度f的计算

(3)CO2平衡分压的计算

式中p——系统总压
转化度f、CO2分压差及吸收速率NCO2计算数据如表2所示。
以4参数模型7为例,说明模型中各参数的求解,则
其中
式中m——转化度的校正系数
n——吸收分压差即推动力的校正系数

构造函数

表2 模型变量观测值Tab.2 Overview of model variable observations

下角标i表示实验序号。
令
则
F(a,b,m,n)=∑(a+bwi+mxi+nyi-zi)2
根据
则

式中N——实验次数
求解,得各模型参数计算值如表3所示。

表3 各宏观动力学模型参数估值Tab.3 Parameter estimation for each macro dynamic model
模型7动力学方程为
其余宏观动力学模型不一一罗列。
2.6 模型验证与筛选
2.6.1模型的统计学验证与筛选
定义残差Er为:Er=(NCO2-NCO2,cal)/NCO2,cal×100%,其中NCO2,cal表示模型计算值,以模型7为例,各实验点残差如表4所示。
其余模型残差计算不再一一罗列,将各模型于每一实验点上残差列表,如表5所示。由表5各模型残差数据可知:模型1、2、5、6残差很大,最大值分别为84.746 5%、45.385 6%、54.433 3%、38.489 3%,都远超过了10%,说明模型存在较大的不足之处,不能与实际情况相符合。探讨其原因,可发现这4种模型有如下特点:模型1属2参数模型,未做任何校正;模型2、5、6属于3参数模型,参数n对分压差项进行了校正,4类模型的共同点都忽略了溶液非理想性对吸收过程的影响。由其存在的残差可说明,分压差已不是构成残差的主要原因,它能够反映吸收过程真实的推动力,由此可推测,构成残差的主要因素可能是溶液的非理想性。

表4 模型7各实验点残差Er计算Tab.4 Calculation of residual value Er for each experimental point for model 7

表5 各模型各实验点上残差ErTab.5 Residual Er values at each experimental point of each model %
模型3、4、7、8绝对值最大的残差为-9.758 5%,其绝对值小于10%,可见这4种模型都能够比较好地反映实际情况。虽然模型3、4属于3参数模型,7、8属于4参数模型,但它们有一共同点,都是对转化度f进行了相应的校正,由此可见,溶液的非理想性确实是造成吸收速率变化的主要因素。但模型3参数m=-6.262 9,模型4参数m=7.366 8,可见随着溶液转化度f增大,吸收速率是加快的。
模型3、4相互之间没有根本性的差别,模型7、8也是一样,从残差大小以及正负分布来看,模型7、8最大残差为7.813 3%,正负分布也比较均匀,都是4正5负;而模型3、4残差分布不是十分均匀,6正3负,其原因在于模型7、8除了对转化度f进行校正以外,还对分压差进行了校正,从而提高了模型的精度。
进一步分析发现:分压校正系数n与1偏离不大,如模型7的n=1.121 6,模型8的n=1.097 8,可见若将对溶液非理想性的校正称为“粗调”的话,则对分压差的校正只能称为 “微调”,所以在准确度以及残差分布方面能取得更好的结果。
但伴随着准确度的提高,模型的简洁性却受到损害,同时物理意义也不明确。综合比较,两类模型各有优缺点,在保证残差能够满足一定精度要求的前提下,尽量保持模型的简洁,应该成为模型筛选的一条重要准则,所以建议选取模型3或4。
比较模型3、4,可发现两者还存在细微差别,最大残差绝对值,模型3为9.758 5%,大于模型4的8.931 0%,同时模型3的m为负数,模型4的m为正数,故从统计学角度最终建议选取模型4为最优模型。
2.6.2模型适应性实验验证
通过改变实验条件扩展实验范围以验证所选模型的适应性,本文进行了两组实验,实验序号记为10、11:反应时间分别为2.8、3.3 h;K2CO3初始浓度分别为1.1、1.3 mol/L;反应温度分别为65、55℃。实验结果如表6所示。
由表6数据可见,各优选模型对实验范围的变化具有较好的适应性,其残差都在预期的范围内,而模型7、8比模型3、4具有更小的残差。

表6 模型适应性验证残差ErTab.6 Model adaptability validation residuals Er values %
通过综合比较,本文最终选择模型4为最优模型,其动力学方程如下

2.7 本征动力学方程的建立
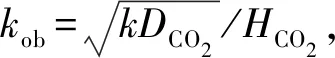
CO2在水中的扩散系数及亨利系数计算公式为
最后得
活化能E=54.47 kJ/mol,而指前因子k0=3.222 8×109m3/(mol·s)。
本征动力学方程为

2.8 CO2吸收反应机理判断

其中

式中W——碳酸钾质量分数
各物理量计算结果如表7所示。
现对上述9组正交实验数据分别计算γ值,如表8所示。由表中数据可见,实验序号为2时吸收反应液的膜内转化系数γ=3.999 0(>3),为所有实验点中最小值,该序号对应的操作条件为反应温度为50℃,碳酸钾初始浓度为1.2 mol/L,反应时间为3 h,气相转速为140 r/min,液相转速为120 r/min。
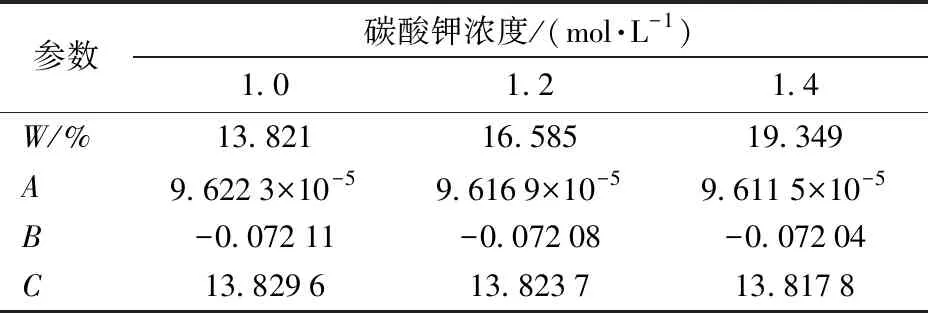
表7 不同碳酸钾溶液浓度时A、B、C参数Tab.7 A, B and C parameters at different concentrations of potassium carbonate
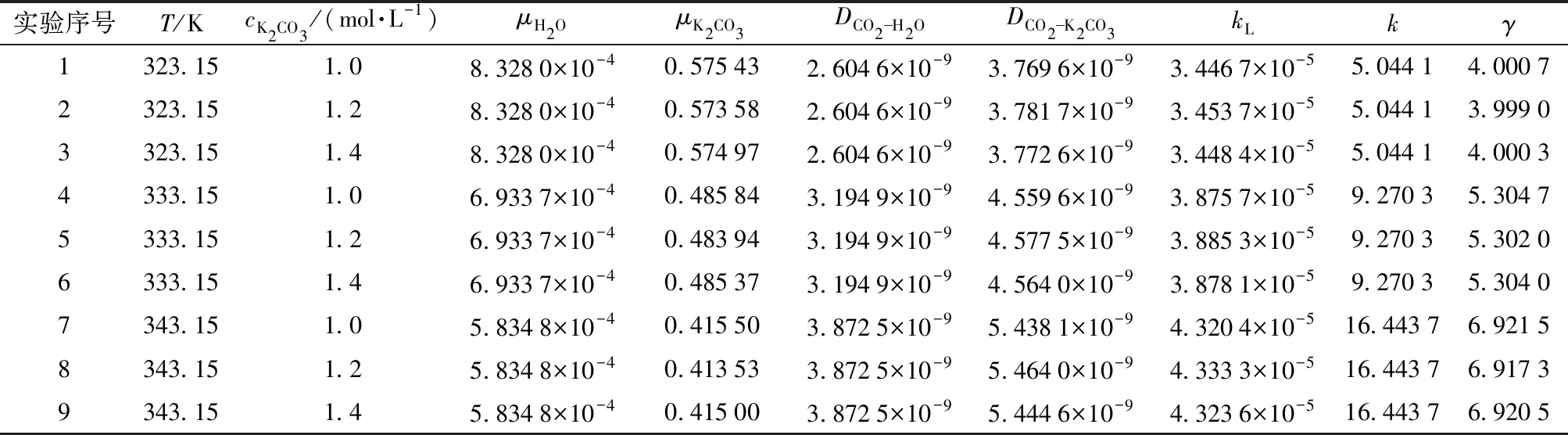
表8 本征反应速率常数和膜内转化系数γTab.8 Intrinsic reaction rate constants and intra membrane conversion coefficient γ values
由于γ值远大于2,可见CO2吸收为快速反应过程,反应主要在液膜内进行,该特点为后续的工业规模反应器选型提供了重要的依据。
3 结论
(1)建立了CO2吸收反应的宏观动力学方程,通过对分压差以及转化度的校正,构建了8种具有不同参数的修正模型,通过正交实验求解了各模型参数,比较了各模型残差的大小及分布,同时对各模型进行了适应性验证,最终筛选出理想的宏观动力学模型。其表观活化能为19 383.94 J/mol,表观指前因子为3.042 9×10-5mol/(m2·s·Pa)。
(2)在建立宏观动力学模型的基础上,获得了吸收反应本征动力学方程,其本征活化能为54.47 kJ/mol,指前因子为3.222 8×109m3/(mol·s)。
(3)计算了膜内转化系数γ,该值大于2,表明CO2吸收反应为快速反应,反应主要集中在液膜内完成。
