有氧运动和四叶参干预对糖尿病大鼠海马Cytc和caspase-3的影响
2019-06-03
运动医学与康复学院,山东第一医科大学(山东省医学科学院),山东 泰安 271016
海马组织对血糖非常敏感,糖尿病大鼠海马神经元中可观察到神经细胞凋亡[1]及线粒体功能障碍[2]。线粒体调控凋亡通路和能量代谢[3],在神经细胞存亡过程中起关键作用,其损伤或功能障碍与糖尿病密切相关。线粒体内膜外侧的细胞色素c(cytochrome c,Cyt c)不仅是呼吸链中的电子载体,而且是重要的凋亡起始因子[4],在细胞凋亡信号刺激下释放到胞浆中活化半胱氨酸基-天冬氨酸基-特异性蛋白酶(cysteinyl aspartate-specific proteases,caspases),其中caspase-3是凋亡发生的标志酶,负责大量底物的蛋白水解及其它许多caspases的激活。本研究拟用糖尿病大鼠模型,采用免疫印迹及RT-PCR方法观察运动及中药干预对糖尿病大鼠海马Cyt c和caspase-3蛋白及mRNA表达的影响,以期为糖尿病治疗提供理论基础,并进一步揭示糖尿病改善的中枢机制。
1 材料与方法
1.1 实验动物
健康雄性Wistar大鼠50只,体重158~174 g,由北京维通利华实验动物有限公司提供,自由摄食饮水,自然光照。动物房温度为21~25℃,相对湿度为40%~60%。
1.2 主要试剂和仪器
链脲佐菌素为Sigma产品,四叶参购自泰山四大名药开发有限公司,血糖测试仪购自美国强生公司,一抗为兔抗大鼠Cyt c抗体和兔抗大鼠caspase-3抗体,购自美国CST公司,二抗为羊抗兔IgG,北京中杉金桥产品,RT-PCR逆转录试剂盒购自日本TaKaRa公司,BCA蛋白定量试剂盒购自博士德公司,其它为国产分析纯。
1.3 糖尿病大鼠模型的制备及分组
大鼠适应性饲养1 w后,给予高脂高糖膳食4 w,然后一次性腹腔注射30 mg/kg链脲佐菌素,3 d后尾静脉随机血糖高于16.7 mmol/L为糖尿病大鼠造模成功。设置糖尿病对照组(DM)、运动组(DMT)、中药组(DML)、运动+中药组(DMTL)。另设置正常对照组(C)。每组6只。
1.4 运动与中药干预方案
采用跑台运动干预,速度为15 m/min,跑台坡度为5°,每次训练60 min,隔日上午训练,持续训练8 w;DML及DMTL大鼠进行中药干预,每日灌胃四叶参多糖200 mg/kg,其余组灌服等体积的生理盐水,持续8 w。
1.5 免疫印迹法检测海马Cyt c和caspase-3蛋白表达
取50 μg蛋白上样,SDS-PAGE电泳,电转移至PVDF膜上,用5%脱脂奶粉室温封闭2 h,PBST洗膜3次,加入Cyt c和caspase-3一抗(封闭液1∶1500稀释)4℃孵育过夜;加二抗(1∶5000)室温摇床孵育2 h,ECL发光显影,条带灰度值反映蛋白表达。
1.6 RT-PCR检测海马Cyt c和caspase-3 mRNA
取大鼠海马组织,剪碎研磨,用Trizol法提取RNA,RT-PCR方法检测Cyt c和caspase-3 mRNA。引物设计:Cyt c上游:5’-ATGCCAAGTCAAAGAATC-3’,下游5’-GAGGGCAGTAAGCATAAC- 3’;caspase-3上游:5’-GGAATGTCATCTCGCTCTG-3’,下游5’-GTCCCACTGTCT GTCTCAAT-3’;β-actin上游:5’-TGAACCCTAAGGCCAACCGTGAA-3’,下游5’-ACCCAAGAAGGAAGGCTGGAAAA-3’。PCR反应条件:94℃预变性2 min;95℃ 30 s,55℃ 30 s,72℃ 30 s,30个循环;72℃ 5 min。PCR产物加样于1.8%琼脂糖凝胶,凝胶成像系统扫描定量电泳条带灰度值。
1.7 数据处理
2 结 果
2.1 血糖检测结果
与C组相比,DM组大鼠血糖水平显著升高(P<0.01);与DM组相比,DMT和DMTL组大鼠血糖水平显著降低(P<0.01),DML组大鼠血糖水平无明显变化(P>0.05)。见表1和图1。
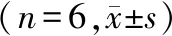
表1 各组大鼠血糖水平比较
注:与C组比较,**P<0.01;与DM组比较,##P<0.01。

图1 各组大鼠血糖水平比较
注:与C组比较,**P<0.01;与DM组比较,##P<0.01。
2.2 Cytc和caspase-3蛋白检测结果
与C组相比,DM组大鼠海马Cyt c释放及caspase-3蛋白表达显著增加(P<0.05);与DM组相比,DMT和DMTL组大鼠Cyt c释放及caspase-3蛋白表达显著减少(P<0.05),DML组无显著性变化(P>0.05)。见表2和图2。
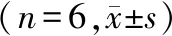
表2 各组大鼠Cyt c和caspase-3蛋白表达变化
注:与C组比较,*P<0.05;与DM组比较,#P<0.05。
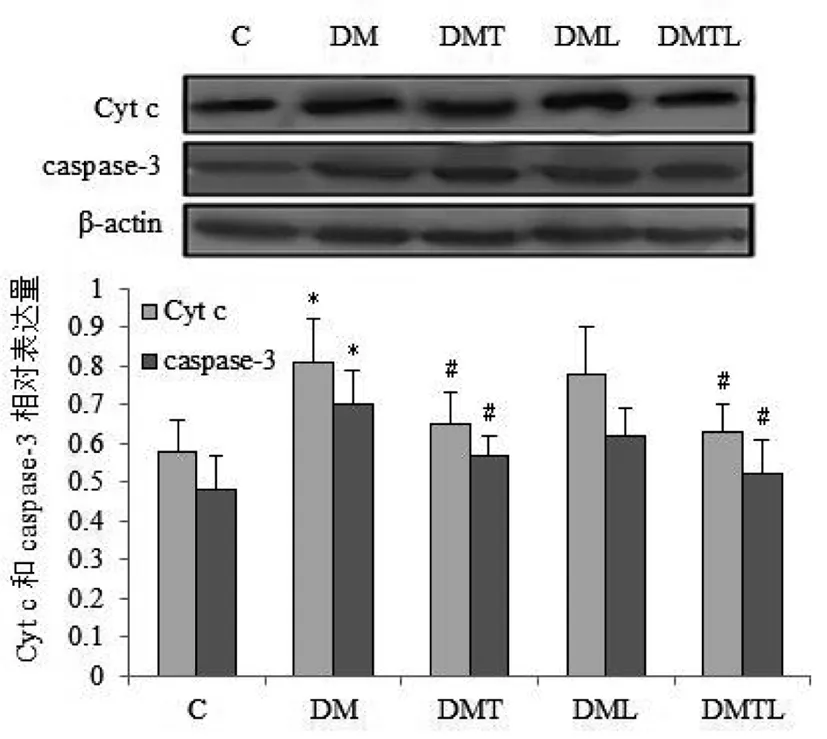
图2 各组大鼠海马Cyt c和caspase-3蛋白表达比较
注:与C组比较,*P<0.05;与DM组比较,#P<0.05。
2.3 Cytc和caspase-3 RT-PCR检测结果
与C组相比,DM组大鼠海马Cyt c和caspase-3 mRNA表达显著增加(P<0.05);与DM组相比,DMT和DMTL组大鼠海马Cyt c和caspase-3 mRNA表达减少(P<0.05),DML组无显著性变化(P>0.05)。见表3。
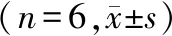
表3 各组大鼠海马Cyt c和caspase-3 mRNA相对表达量
注:与C组比较,*P<0.05;与DM组比较,#P<0.05。
3 讨 论
糖尿病是一种致病机制复杂的慢性疾病,随着社会生活水平的不断提高,呈现逐渐年轻化的趋势。细胞凋亡在众多致病机制中发挥了极其重要的作用[1],而线粒体途径是一条经典的细胞凋亡途径。
由核基因编码的Cyt c是一种水溶性蛋白,定位于线粒体内膜外侧,不能通过外膜,是氧化呼吸链中的一个基本成分。在凋亡信号刺激下,释放到胞浆中的Cyt c与ATP及凋亡蛋白激活因子-1相结合,活化caspases而诱导细胞凋亡[5]。本实验结果表明,糖尿病大鼠海马Cyt c释放显著增加,这可能是引起海马细胞凋亡及糖尿病致病机制之一;运动干预及中药辅助运动干预能够降低糖尿病大鼠血糖水平,减少Cyt c基因表达及蛋白释放,提示运动是改善糖尿病的一种有效方法,运动干预及中药辅助运动干预对糖尿病的改善作用与其减少线粒体Cyt c释放继而抑制细胞凋亡有关。Cyt c可能通过线粒体外膜上的凋亡诱导通道、外膜破裂或通过膜上的通透性转换孔而被释放入胞浆[6]。本实验室前期研究发现,糖尿病大鼠海马线粒体通透性转换孔开放程度显著增加,推测这可能是Cyt c释放的主要通道。
Cyt c释放是细胞凋亡的上游事件,细胞凋亡的最终执行者是caspases。Caspase-3被认为是凋亡的标志酶,通过裂解特异性底物使细胞走向凋亡[7]。本实验研究发现,糖尿病大鼠海马组织caspase-3基因和蛋白表达均显著增加,表明高血糖可导致海马神经细胞凋亡,caspase-3激活及蛋白表达增加可能是糖尿病致病机制之一。本实验还发现,运动干预及中药辅助运动干预使糖尿病大鼠血糖水平下降,caspase-3的基因和蛋白表达下降,提示运动改善血糖的作用可能通过下调海马caspase-3表达从而抑制细胞凋亡而实现的。单纯8 w中药干预对血糖的调节及Cyt c和caspase-3表达没有起到显著影响,但存在改善趋势,需要延长中药干预时间或增加干预剂量进一步加以研究。
综上,运动及运动和四叶参联合共同干预能够抑制Cyt c释放,减少caspase-3表达,这可能与糖尿病大鼠血糖水平的改善相关。
