食管癌组织中IDO1的表达及犬尿酸对间皮素CAR-T细胞功能的影响
2019-06-03刘裕琳申春一
刘裕琳,张 震,曹 玲,申春一,张 毅
1)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 2)郑州大学第一附属医院肿瘤中心 郑州 450052 3)河南省肿瘤免疫和生物治疗重点实验室 郑州 450052 4)郑州大学基础医学院免疫学教研室 郑州 450001 5)郑州大学生命科学学院 郑州 450001
免疫疗法被认为是继手术、放疗、化疗及靶向治疗之后的肿瘤第五大治疗手段[1],如今免疫治疗已在多种肿瘤中展现出良好的治疗效果,并成为部分肿瘤的一线疗法[2]。嵌合抗原受体修饰T细胞(chimeric antigen receptor T cells,CAR-T)是一种可以模拟T细胞受体(T-cell receptor,TCR)功能的人工受体T细胞,当嵌合抗原受体的抗体(配体)与肿瘤细胞表面的抗原(受体)结合时,通过铰链区和跨膜区将信号传递至胞内并转化为活化信号,激活的效应细胞通过分泌穿孔素或细胞因子杀伤肿瘤细胞[3-4]。CAR-T细胞治疗在白血病等血液系统肿瘤中效果良好。但在实体瘤治疗中,CAR-T细胞的进展一直相对滞后,并且在治疗中存在很大的局限性,一个重要的原因就是在实体瘤中由于多种免疫逃逸种机制的作用,易形成肿瘤免疫抑制微环境,使CAR-T细胞功能受到了抑制[5-6]。吲哚加双氧酶1(indoleamine 2,3-dioxygenase 1, IDO1)属于含血红素的单体氧化还原酶类,是介导人必需氨基酸色氨酸转化为犬尿酸的代谢限速酶[7],IDO1的代谢产物犬尿酸在发挥免疫抑制功能中起到重要的作用,最近有研究[8]发现清除体内的犬尿酸可以逆转IDO1诱导的T细胞功能抑制,但是犬尿酸是否会影响CAR-T细胞的功能尚不明确。中国是世界上食管癌发病率、死亡率最高的国家之一[9],并且患者的5 a生存率不超过20%。CAR-T细胞治疗的出现,给食管癌的治疗带来了新的希望[10]。本文对食管癌组织中IDO1的表达与患者生存状况进行了分析,观察犬尿酸对间皮素CAR-T功能的影响。
1 材料与方法
1.1数据库及临床资料食管癌的基因表达数据及临床资料均来自TCGA(The Cancer Genome Atlas,https://tcga-data.nci.nih.gov/)数据库。从TCGA数据库中收集186例食管癌肿瘤组织和12例正常食管黏膜组织中IDO1的基因表达数据;收集肿瘤患者10 a随访资料(终点为死亡),剔除14例生存资料不完整的肿瘤患者,根据IDO1表达的中位数将患者分为高表达组(n=86)和低表达组(n=86),绘制肿瘤患者的生存曲线。
1.2细胞的培养人胚肾293T细胞系和表达间皮素的食管癌细胞系KYSE510购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库,CD8+T细胞及间皮素CAR-T细胞从健康供者外周血中分离或转染得到。293T细胞用DMEM-H培养基(美国Invitrogen公司)培养,KYSE510细胞、CD8+T细胞及间皮素CAR-T细胞用RPMI 1640培养基(美国Invitrogen公司)培养,培养基中分别加入体积分数10%的胎牛血清(美国Gibco公司)和100 U/mL的青霉素和50 g/L的链霉素,细胞均培养于37 ℃含有体积分数5%CO2的培养箱中。
1.3间皮素CAR-T细胞的制备及转染效率鉴定人外周血单个核细胞的获取及CD8+T细胞的磁分选参考文献[11]。采用序列合成方法将识别间皮素抗原的间皮素-scFv连接至CD3和CD28的信号区,再将其克隆入慢病毒载体中,构建含间皮素抗原受体基因及其重组表达载体,并测序验证间皮素CAR载体构建成功。培养人胚肾293T细胞密度达到70%~80%时,采用病毒包装的方法将质粒混合物滴入293T细胞中,继续培养48、72 h后收集含病毒的上清液,感染CD8+T细胞,获得间皮素CAR-T细胞。取间皮素CAR-T细胞于1.5 mL离心管中,PBS洗涤后直接上流式细胞仪检测转染效率,转染效率达58.5%可以用于后续实验。
1.4间皮素CAR-T细胞表面分子的检测收集符合实验的间皮素CAR-T细胞,分为对照组和犬尿酸处理组(加终浓度为200 μmol/L犬尿酸),培养48 h后,收集2组细胞于1.5 mL离心管中,用PBS洗涤,再分别避光加入CD8-APC-Cy7、CD28-APC和PD-1-PE-Cy7流式抗体(美国Biolegend公司)4 ℃孵育20 min,上流式细胞仪检测。
1.5间皮素CAR-T细胞胞内因子分泌的检测分别在两细胞中加入佛波酯(PMA,50 mg/L)及离子霉素(750 mg/L),培养箱中孵育1 h后,加入阻断剂布雷非德菌素A(brefeldin A,BFA)(美国Sigma公司),充分混合,继续培养 5 h。收集细胞于1.5 mL离心管中,用PBS洗涤,用固定剂重悬,4 ℃避光孵育30 min。离心弃上清后,加入破膜剂,4 ℃避光孵育30 min。离心弃上清后再加入破膜剂重悬细胞,分别避光加入CD8-APC-Cy7、IFN-γ-PE-Cy7和IL-2-APC流式抗体4 ℃孵育15 min,上流式细胞仪检测。
1.6间皮素CAR-T细胞杀伤能力的检测将2组间皮素CAR-T细胞与KYSE510按效靶比10∶1共孵育,6 h后收集细胞,PBS清洗,避光加入CD8-APC-Cy7和CD107a-APC流式抗体,上流式细胞仪检测KYSE510细胞凋亡率,表示间皮素CAR-T细胞的杀伤能力。
1.7统计学处理采用SPSS 19.0或GraphPad Prism 7进行数据分析,应用Kaplan-Meier法绘制食管癌患者生存曲线并行log-rank检验,应用两独立样本的t检验比较2组间皮素CAR-T细胞表面分子、细胞内因子分泌水平和细胞杀伤能力的差异,检验水准α=0.05。
2 结果
2.1食管癌组织中IDO1的表达与患者预后的关系IDO1在食管癌组织中的表达(2.647 ±0.139)高于食管正常组织(0.798±0.142)(t=3.368,P<0.001)。食管癌患者中IDO1低表达组和高表达组的生存曲线差异有统计学意义(χ2=4.547,P=0.033),IDO1低表达组中位生存期(42.1个月)较高表达组的中位生存期(18.9个月)更长(图1)。
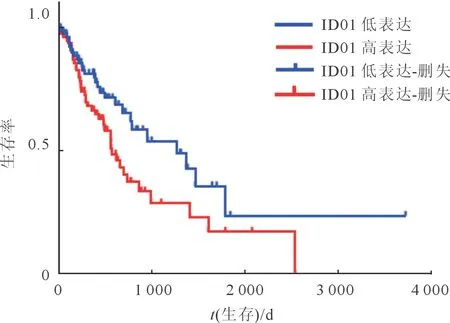
图1 2组食管癌患者的生存曲线
2.2犬尿酸对间皮素CAR-T细胞表面分子和细胞内因子分泌的影响见表1。由表1可知,与对照组相比,犬尿酸处理组间皮素CAR-T细胞表面抑制性分子PD-1表达上调,而激活性分子CD28的表达下降,细胞内因子IL-2和IFN-γ分泌减少。
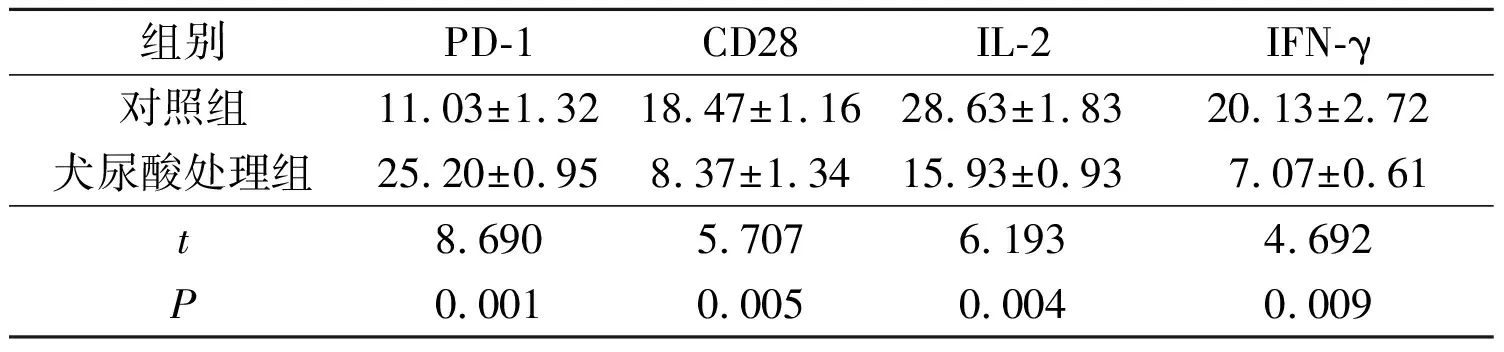
表1 2组间皮素CAR-T细胞表面分子和细胞内因子水平的比较(n=3)
2.3犬尿酸对间皮素CAR-T细胞杀伤能力的影响见表2。由表2可知,与对照组比较犬尿酸处理组间皮素CAR-T细胞杀伤功能标志物CD107a表达降低KYSE510细胞凋亡率降低。
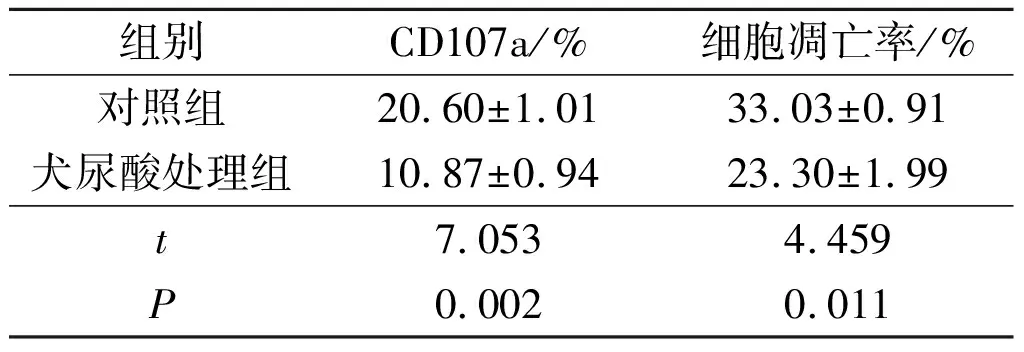
表2 犬尿酸对间皮素CAR-T细胞杀伤能力的影响(n=3)
3 讨论
间皮素CAR-T细胞治疗已经在多种实体瘤中开展了多项临床试验,在Ⅰ期临床试验中,间皮素CAR-T细胞治疗都显示出良好的安全性和可行性[12],但是却并未像血液系统肿瘤一样,展现出良好的治疗效果。CAR-T细胞治疗血液系统肿瘤效果较好的一个重要原因是CAR-T细胞发挥治疗作用的部位是患者体内的淋巴和血管,这些部位都是血液细胞经常所处的环境,有足够的资源供它们存活和攻击肿瘤细胞。然而,许多实体瘤所处的微环境比较复杂,并且容易形成免疫抑制的微环境,抑制CAR-T细胞的功能,不利于CAR-T细胞发挥作用[13]。在杀伤性细胞的胞浆里有很多溶细胞颗粒(如CD107a),当杀伤细胞活化时,CD107a会被释放到细胞接触面,促使靶细胞死亡;因此,检测间皮素CAR-T细胞表面的CD107a可以反映其杀伤能力。本研究发现,在食管癌组织中免疫抑制分子IDO1 表达水平增高,并且IDO1表达水平越高,食管癌患者的预后越差。因此IDO1的表达可能是食管癌微环境中影响CAR-T细胞治疗的一个重要因素。
有研究报道,在肿瘤微环境中,多种细胞因子可以诱导IDO1的表达,如IFN-γ[14]、IL-1和TNF-α等[15]。在实体瘤治疗过程中,CAR-T细胞释放大量的IFN-γ来发挥杀伤肿瘤的作用,而由于肿瘤负反馈调节机制的存在,肿瘤组织中 IDO1表达明显上调来逃逸免疫系统的监视。研究[16]显示,EGFR CAR-T细胞治疗的脑胶质瘤复发患者中,许多免疫抑制分子高表达,特别是IDO1和FoxP3,也有部分患者IL-10、PD-L1和TGF-β表达较高。另有研究显示IDO1表达上调,其代谢产物犬尿酸也大量增加,犬尿酸可以与芳烃受体结合,从而引起一系列生物效应,包括抑制T细胞的活性[17],诱导树突状细胞的激活以及诱导Treg的产生等[18-19]。本研究结果显示,犬尿酸可以直接抑制CAR-T细胞的细胞活性和杀伤肿瘤细胞的能力,因此很有可能是CAR-T细胞治疗过程中诱导的IDO1表达上调抑制了CAR-T细胞的功能。
综上所述,IDO1在食管癌组织中的表达高于正常组织,并且其表达与肿瘤患者的不良预后有关。IDO1能够通过其代谢产物犬尿酸抑制间皮素CAR-T细胞的活性和杀伤肿瘤的能力,提示在间皮素CAR-T细胞治疗过程中,如果可以将IDO1抑制剂与间皮素CAR-T细胞联合使用,可能增强间皮素CAR-T细胞的治疗效果。
