黄芪水提物对慢性肾功能衰竭模型大鼠的改善作用及其对MAPK信号通路的影响Δ
2019-05-31汪卫红许烨李志明远方
汪卫红,许烨,李志明,远方
(辽宁中医药大学附属医院肾内科,沈阳110032)
慢性肾功能衰竭(CRF)是由各种原发性或继发性肾脏疾病导致的肾功能不可逆性减退,甚至功能丧失,其中代谢产物潴留、电解质紊乱、酸碱平衡失调及内分泌异常等是各种肾脏疾病终末阶段的共同表现[1-2]。临床上主要采用透析、肾移植或相应的对症治疗(如静脉输注5%碳酸氢钠溶液纠正酸中毒、重组促人红细胞生成素纠正贫血或骨化三醇治疗肾性骨病等)等以缓解CRF症状,但上述治疗方案不良反应均较严重,且无法从本质上阻止CRF的进展[3]。大量研究表明,中医药疗法可改善肾功能并延缓CRF的进展,对CRF的治疗具有重要意义[4-6]。黄芪为豆科植物蒙古黄芪[Astragalus membranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao]或膜荚黄芪[Astragalus membranaceus(Fisch.)Bge.]的干燥根,具有补气升阳、固表止汗、利水消肿、生津养血等功效[7]。黄芪的主要成分为黄芪甲苷、黄芪多糖及多种类黄酮类化合物。现代药理研究表明,黄芪及其水提物具有抗氧化、抗凋亡等作用,可改善CRF并调节糖尿病肾病模型大鼠的肾功能,但其作用机制尚未见深入探讨[8-9]。有研究指出,丝裂原活化蛋白激酶(MAPK)信号通路相关调控蛋白p38 MAPK、c-Jun氨基末端激酶(JNK)、细胞外调节蛋白激酶(ERK)在CRF模型大鼠体内的磷酸化程度明显增高,且可加重其氧化应激及炎症反应,促进细胞凋亡[10],但黄芪对CRF模型大鼠的MAPK信号通路是否具有调节作用尚未见相关报道。为此,本研究通过建立CRF大鼠模型,探讨黄芪水提物对其氧化应激、炎症反应、细胞凋亡以及MAPK信号通路的影响,以期为黄芪的临床应用提供实验及理论依据。
1 材料
1.1 仪器
RM2235型石蜡切片机(德国Leica公司);BS-180型全自动生化分析仪、MR-96A型酶标仪(深圳迈瑞生物医疗电子股份有限公司);UV-5600型紫外-可见分光光度计(上海元析仪器有限公司);7500型实时聚合酶链反应(Real-time PCR)仪(美国ABI公司);Mini-Sub Cell GT Cell型水平核酸电泳仪、Trans-Blot SD型半干式蛋白转膜仪、ChemiDoc MP型凝胶成像系统(美国Bio-Rad公司);5810R型离心机(德国Eppendorf公司)。
1.2 药材、药品与试剂
黄芪饮片购自安徽亳州药材市场(批号:170926),经辽宁中医药大学翟延君教授鉴定为豆科植物蒙古黄 芪[A.membranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao]的干燥根。
贝那普利原料药(阳性对照,批号:Y0001025,纯度:>98%)、腺嘌呤(批号:A8626)均购自美国Sigma公司;血肌酐(Scr)、尿素氮(BUN)、尿酸(UA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒(南京建成生物工程研究所,批号分别为20170409、20170418、20170511、A001-1-1、A007-1-1、A003-1);白细胞介素1β(IL-1β)、IL-6、肿瘤坏死因子α(TNF-α)酶联免疫吸附测定(ELISA)试剂盒和全蛋白提取试剂盒(南京凯基生物科技发展有限公司,批号分别为KGERC007、KGEMC003、KGERC102a、KGP2100);小鼠抗人β-肌动蛋白(β-actin,内参)、磷酸化p38 MAPK(pp38 MAPK)、ERK1/2、磷酸化JNK(p-JNK)抗体以及兔抗人p38 MAPK、磷酸化ERK1/2(p-ERK1/2)、JNK抗体(美国Cell Signaling Technology公司,批号分别为3700、9216、4696、9255、8690、4377、9258);辣根过氧化物酶(HRP)标记兔抗小鼠IgG二抗、HRP标记羊抗兔IgG二抗(北京博奥森生物技术有限公司,批号分别为bs-0368R、bs-0295G);RevertAidTM第1链cDNA合成试剂盒、TrizolTM试剂(美国Thermo Fisher Scientific公司,批号分别为K1682、108304);TransStart®Top Green qPCR SuperMix试剂盒(北京全式金生物技术有限公司,批号:AQ131-02);二喹啉甲酸(BCA)蛋白定量试剂盒、免疫印迹发光(ECL)试剂盒(碧云天生物技术有限公司,批号分别为P0009、P0018S);三羟甲基氨基甲烷盐酸盐(TBST)溶液(北京索莱宝科技有限公司,批号:T1085);蛋白上样缓冲液(大连美仑生物技术有限公司,批号:MA0003);其余试剂均为分析纯,水为蒸馏水。
1.3 动物
SPF级雄性SD大鼠60只,体质量200~250 g,购于辽宁长生生物有限公司[动物生产许可证号:SCXK(辽)2015-0001]。所有动物均分笼饲养,室温维持在20~25℃,湿度为50%,每日光照12 h。
2 方法
2.1 黄芪水提物的制备
称取黄芪饮片500 g,粉碎,浸泡过夜后,分别用10倍量(g/L)水煎煮2次,每次2 h,滤过,合并滤液,减压回收溶剂,得浸膏53.4 g(得率为10.68%)。将上述浸膏用水溶解,得质量浓度为1 g/mL(按生药量计)的黄芪水提物,置于4℃冰箱中保存,备用。
2.2 分组、造模与给药
所有大鼠均适应性饲养1周后,随机分为对照组(10只)和造模组(50只)。对照组大鼠灌胃等体积生理盐水;造模组大鼠均参照文献[11-12]方法建立CRF模型:即灌胃25%腺嘌呤混悬液(以水为溶剂)200 mg/kg,每天1次,连续28 d。造模后,将造模组大鼠随机分为模型组、贝那普利组(2 mg/kg;以水为溶剂;剂量设置参考文献[13])以及黄芪水提物低、中、高剂量组(1.5、3、6 g/kg,按生药量计;以水为溶剂;剂量按临床成人剂量的3、6、12倍换算而得),每组10只。对照组和模型组大鼠均灌胃等体积生理盐水,各给药组大鼠均灌胃相应药物;每天1次,连续28 d[13]。
2.3 样品的采集
末次给药12 h后,处死各组大鼠,于腹主动脉采血,10 000 r/min离心10 min,分离血清,于-20℃保存,备用。剥离各组大鼠的肾脏,用磷酸盐缓冲液(PBS,pH 7.4)清洗,剔除周围脂肪组织,用锡纸包裹后,于-80℃冰箱中保存,备用。
2.4 血清肾功能指标及炎症因子的检测
采用比色法以全自动生化分析仪检测各组大鼠血清Scr、BUN、UA含量,采用ELISA法以酶标仪检测各组大鼠血清IL-1β、IL-6、TNF-α水平。严格按照相应试剂盒说明书操作。
2.5 氧化应激相关指标的检测
称取各组大鼠肾组织200 mg,加生理盐水适量,制成匀浆,10 000 r/min离心5 min,取上清液作为待测样品,分别采用羟胺法、可见分光光度法及硫代巴比妥酸法(TBA)以紫外-可见分光光度计检测各组大鼠肾组织中SOD、CAT活性和MDA水平。严格按照相应试剂盒说明书操作。
2.6 凋亡相关因子mRNA表达的检测
采用Real-time PCR法检测。采用Trizol法提取各组大鼠肾组织总RNA 100 mg,加入TrizolTM试剂1 mL,反复吹打,按第1链cDNA合成试剂盒说明书反转录得cDNA。以所得cDNA为模板,参照TransStart®Top Green qPCR SuperMix试剂盒说明书进行扩增,各待测基因引物由北京赛诺科为生物科技有限公司设计、合成(引物序列见表1)。反应体系(共20 μL):cDNA 2 μL,上、下游引物(10 μmol/L)各0.4 μL,2×Top Green qPCR SuperMix 10 μL,ddH2O 7.2 μL。反应条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共循环30次;72℃再延伸1 min。以β-actin作为内参,采用2-ΔΔCt法计算各基因的相对表达量(Ct表示目标扩增产物达到设定阈值所经历的循环数),本研究以Bax、Bcl-2 mRNA相对表达量的比值(Bax/Bcl-2)及Caspase-3 mRNA的相对表达量作为量化指标。

表1 引物序列Tab 1 Primer sequence
2.7 MAPK信号通路相关调控蛋白表达的检测
采用Western blotting法检测。将各组大鼠肾组织剪碎,按全蛋白提取试剂盒说明书提取总蛋白,于4℃下以12 000 r/min离心20 min,使用BCA蛋白定量试剂盒对蛋白进行定量,加入蛋白上样缓冲液以体积比1∶1进行稀释,于100℃下变性10 min,经十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳后,转移至聚偏二氟乙烯(PVDF)膜上,以5%脱脂奶粉室温封闭1 h,用TBST溶液清洗,分别加入p38 MAPK、p-p38 MAPK、ERK1/2、p-ERK1/2、JNK、p-JNK、β-actin一抗(加入量均为1∶1 000),于4℃下孵育过夜,用TBST溶液清洗3次,每次5 min,随后加入相应二抗[β-actin、p-p38 MAPK、ERK1/2、p-JNK:HRP标记兔抗小鼠IgG二抗,p38 MAPK、p-ERK1/2、JNK:HRP标记羊抗兔IgG二抗;加入量均为1∶1 000],室温孵育1 h后,用TBST溶液清洗,以ECL显色后,使用凝胶成像系统成像,采用Image J 1.8.0软件分析各蛋白条带的灰度值,以相应蛋白与内参条带的灰度值比值来表示该蛋白的相对表达量。
2.8 统计学方法
采用SPSS 18.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。P<0.05为差异有统计学意义。
3 结果
3.1 黄芪水提物对CRF模型大鼠血清肾功能指标含量的影响
与对照组比较,模型组大鼠血清Scr、BUN、UA含量均显著升高,差异均有统计学意义(P<0.01)。与模型组比较,各给药组大鼠血清上述肾功能指标含量均显著降低,差异均有统计学意义(P<0.05或P<0.01);而各给药组组间比较,差异均无统计学意义(P>0.05),详见表2。
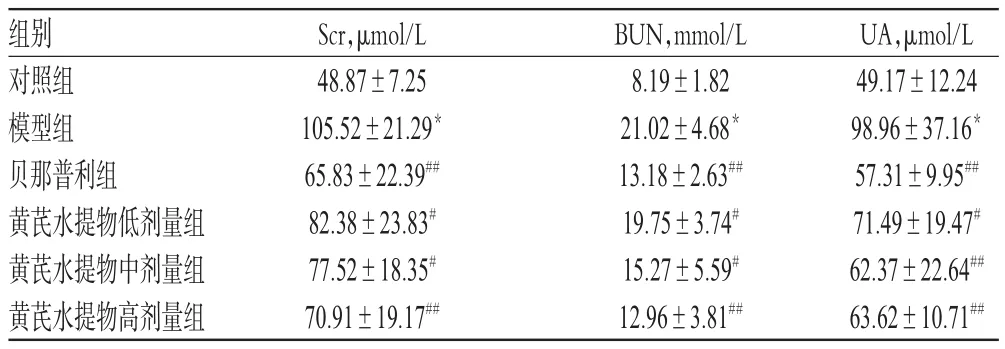
表2 各组大鼠血清中Scr、BUN、UA含量比较(x±s,n=10)Tab 2 Comparison of serum contents of Scr,BUN and UAin rats of each group(x±s,n=10)
3.2 黄芪水提物对CRF模型大鼠血清炎症因子水平的影响
与对照组比较,模型组大鼠血清炎症因子IL-1β、IL-6、TNF-α水平均显著升高,差异均有统计学意义(P<0.01)。与模型组比较,各给药组大鼠上述炎症因子水平均显著降低,差异均有统计学意义(P<0.05或P<0.01);而各给药组组间比较,差异均无统计学意义(P>0.05),详见表3。
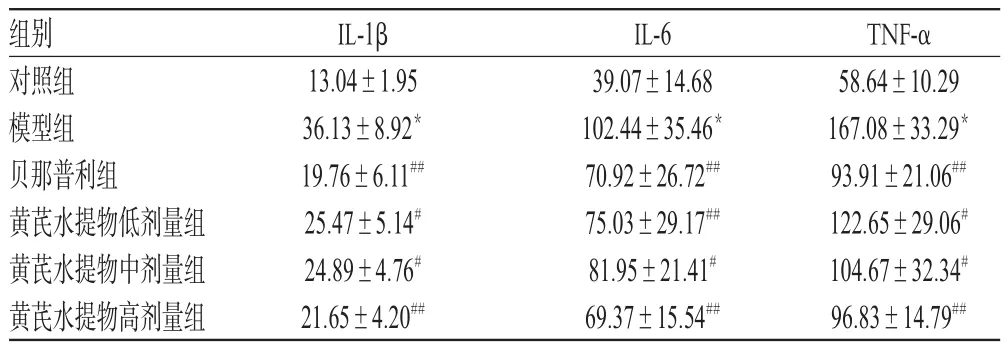
表3 各组大鼠血清中IL-1β、IL-6、TNF-α水平比较(x±s,n=10,ng/L)Tab 3 Comparison of serum levels of IL-1β,IL-6 and TNF-α in rats of each group(x±s,n=10,ng/L)
3.3 黄芪水提物对CRF模型大鼠肾组织中氧化应激相关指标的影响
与对照组比较,模型组大鼠肾组织中SOD、CAT活性均显著降低,MDA含量显著提高,差异均有统计学意义(P<0.01)。与模型组比较,贝那普利组及黄芪水提物中、高剂量组大鼠肾组织中SOD、CAT活性均显著升高,MDA含量均显著下降,且贝那普利组MDA含量显著低于黄芪水提物高剂量组,差异均有统计学意义(P<0.05或P<0.01);而其余给药组上述指标组间比较,差异均无统计学意义(P>0.05),详见表4。
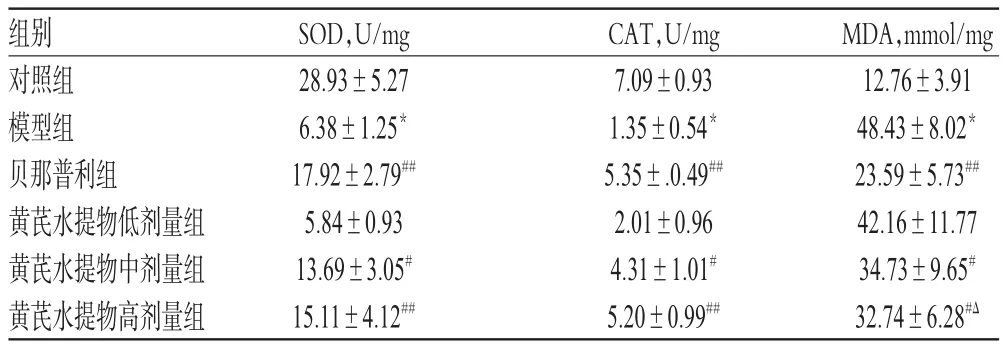
表4 各组大鼠肾组织中SOD、CAT活性和MDA含量比较(x±s,n=10)Tab 4 Comparison of SOD and CAT activities,MDA contents in renal tissue of rats in each group(x±s,n=10)
3.4 黄芪水提物对CRF模型大鼠肾组织中凋亡相关因子mRNA表达的影响
与对照组比较,模型组大鼠肾组织中Bax/Bcl-2及Caspase-3 mRNA的相对表达量均显著升高,差异均有统计学意义(P<0.01)。与模型组比较,各给药组大鼠肾组织中Bax/Bcl-2以及贝那普利组和黄芪水提物中、高剂量组大鼠肾组织中Caspase-3 mRNA的相对表达量均显著降低,且贝那普利组Bax/Bcl-2显著低于黄芪水提物高剂量组,差异均有统计学意义(P<0.05或P<0.01);而其余给药组上述指标组间比较,差异均无统计学意义(P>0.05),详见表5。
3.5 黄芪水提物对CRF模型大鼠肾组织中MAPK信号通路相关调控蛋白表达的影响
与对照组比较,模型组大鼠肾组织中p-p38 MAPK、p-ERK1/2、p-JNK蛋白的相对表达量均显著升高,差异均有统计学意义(P<0.01)。与模型组比较,各给药组大鼠肾组织中p-p38 MAPK、p-ERK1/2、p-JNK蛋白的相对表达量均显著降低,差异均有统计学意义(P<0.05或P<0.01);而各给药组其余指标组间比较,差异均无统计学意义(P>0.05),详见图1、表6。

表5 各组大鼠肾组织中Bax/Bcl-2和Caspase-3 mRNA相对表达量比较(x±s,n=10)Tab 5 Comparison of Bax/Bcl-2 and mRNA related expression of Caspase-3 in renal tissue of rats in each group(x±s,n=10)

图1 各组大鼠肾组织中MAPK信号通路相关调控蛋白表达的电泳图Fig 1 Electrophoregrams of the expression of MAPK signaling pathway-related regulatory proteins in renal tissue of rats in each group
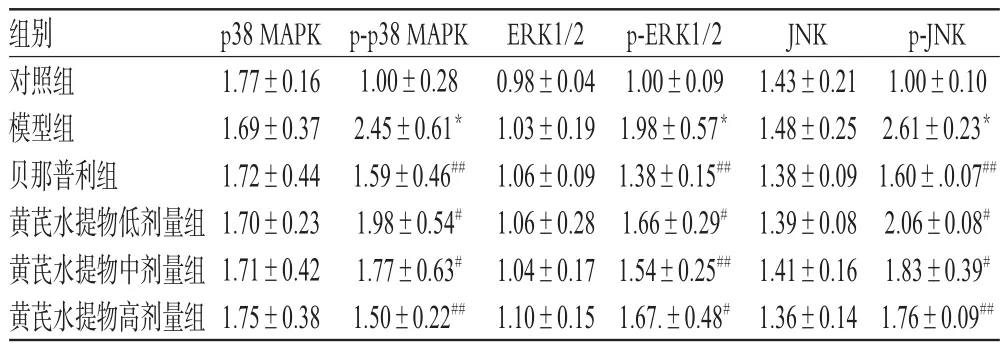
表6 各组大鼠肾组织中p38 MAPK、p-p38 MAPK、ERK1/2、p-ERK1/2、JNK、p-JNK表达水平比较(x±s,n=10)Tab 6 Comparison of the expression of p38 MAPK,p-p38 MAPK,ERK1/2,p-ERK1/2,JNK and p-JNK in renal tissue of rats in each group(x±s,n=10)
4 讨论
CRF是各种慢性肾脏疾病所致肾功能恶化的结局之一,其主要生理表现为肾小球滤过率降低,肾小球和肾小管遭到破坏,从而导致机体代谢产物(如Scr、BUN等)聚集,最终进展为尿毒症[14]。目前主要的治疗方案无法从根本上解决肾组织的损伤,且费用较高、副作用明显,患者极其痛苦[15]。因此,探索治疗CRF的新途径、新药物显得尤为重要。CRF属中医“关格”“肾劳”“溺毒”“水肿”“癃闭”等范畴,其病因病机皆与脾肾有关,脾肾两虚易致浊毒内蕴[16]。《素问·通评虚实论》曰:“邪气盛则实,精气夺则虚”,表明CRF属“本虚标实”之证。黄芪是中医治疗CRF必不可少的一味药材,其味甘、性微温,归脾肺经。《珍珠囊》曰:“黄芪甘温纯阳,其用有五:补诸虚不足,一也;益元气,二也;壮脾胃,三也;去肌热,四也;排脓止痛,活血生血,内托阴疽,为疮家圣药,五也”。《本草汇言》赞其为“补肺健脾,实卫敛汗,驱风运毒之药也”。可见,黄芪具补中益气之力强之意,为治疗CRF之要药[17]。血管紧张素转换酶抑制剂贝那普利是临床治疗CRF的主要药物,可减少患者蛋白尿,并改善其肾功能[18],故本研究将其作为阳性对照药物。
Scr是肌肉在人体内代谢的产物,主要由肾小球滤过排出体外,肾功能不全时,Scr在体内蓄积使得其含量有所升高;BUN是血浆中除蛋白质以外的一种含氮化合物,其经肾小球滤过而排出体外,当肾功能不全失代偿时,BUN含量将升高;UA为嘌呤代谢的终产物,在肾功能减退时,血中UA含量将升高[19-20]。由此可见,Scr、BUN、UA是临床上反映患者肾功能损伤的重要指标。本研究考察了黄芪水提物对CRF模型大鼠血清Scr、BUN、UA含量的影响。结果显示,模型组大鼠血清Scr、BUN、UA含量均较对照组显著升高;经不同剂量黄芪水提物处理后,各给药组大鼠血清Scr、BUN、UA含量均较模型组显著降低。这提示黄芪水提物可提高CRF模型大鼠的肾小球滤过率,加快Scr、BUN、UA等代谢产物的排出。
血清炎症因子(IL-1β、IL-6、TNF-α)的表达水平是反映机体炎症反应的常用指标[21]。IL-1β可参与炎症反应后期纤维化的形成过程,并可促进内皮细胞和巨噬细胞中蛋白激酶的活性,加重肾脏损伤;IL-6是与肾小球疾病关系最为密切的炎症因子,主要由巨噬细胞、单核细胞、T细胞等分泌;TNF-α由巨噬细胞分泌,可损伤肾小管内皮细胞,刺激成纤维细胞增殖,从而加快了肾纤维化的形成[22]。本研究采用ELISA法检测了各组大鼠血清中IL-1β、IL-6、TNF-α水平。结果显示,模型组大鼠血清IL-1β、IL-6、TNF-α水平均较对照组显著升高。这提示CRF可引发较为严重的炎症反应,与文献结果[21]基本一致。经不同剂量黄芪水提物处理后,各给药组大鼠血清IL-1β、IL-6、TNF-α水平均较模型组显著降低。这提示黄芪水提物可有效抑制CRF模型大鼠的炎症反应。
现代医学研究指出,除炎症反应外,氧化应激和细胞凋亡在CRF的发病机制中亦扮演了重要的角色[23-24]。CRF患者体内抗氧化酶活性的降低可导致其机体内氧自由基无法被及时清除,使得氧自由基过剩,进而加重氧化应激反应[15]。其中,SOD是反映氧化应激状态的重要指标,CAT能有效清除生物体内的自由基,两者是减轻氧化应激损伤的主要屏障;MDA能客观反映过氧化物致损伤的严重程度[25]。本研究对各组大鼠肾组织中氧化应激相关指标进行了考察。结果显示,与对照组比较,模型组大鼠肾组织中SOD、CAT活性均显著降低,MDA含量显著提高。经不同剂量黄芪水提物处理后,与模型组比较,贝那普利组及黄芪水提物中、高剂量组大鼠肾组织中SOD、CAT活性均显著升高,MDA含量均显著下降,且贝那普利组MDA含量显著低于黄芪水提物高剂量组。这提示黄芪水提物可抑制CRF模型大鼠肾组织中的氧化应激反应,但作用可能弱于阳性对照药物。
细胞凋亡是细胞内在的一种程序性死亡,是维持机体细胞间平衡的关键因素,也是CRF发生的重要机制之一[23-24]。在凋亡发生过程中,Bcl-2与Bax以二聚体形式存在,当Bcl-2表达多时抑制细胞凋亡,而当Bax表达多时则促进细胞凋亡[26]。Caspase-3是凋亡效应蛋白酶,在细胞凋亡过程中表达量有所增加,并诱导激活下游的Caspase效应分子,从而启动凋亡的发生[27]。本研究采用Real-time PCR法检测了各组大鼠肾组织中Bax、Bcl-2和Caspase-3 mRNA的相对表达量。结果显示,模型组大鼠肾组织中Bax/Bcl-2及Caspase-3 mRNA的相对表达量均较对照组显著升高。这提示CRF可导致大鼠肾组织促凋亡因子Bax、Caspase-3的表达增加,而使抑凋亡因子Bcl-2的表达降低,与文献结果[28]基本一致。经不同剂量黄芪水提物处理后,与模型组比较,各给药组大鼠肾组织中Bax/Bcl-2以及贝那普利组和黄芪水提物中、高剂量组大鼠肾组织中Caspase-3 mRNA的相对表达量均显著降低,且贝那普利组Bax/Bcl-2显著低于黄芪水提物高剂量组。这提示黄芪水提物可通过调控Bax、Bcl-2、Caspase-3等凋亡相关因子mRNA的表达来降低CRF模型大鼠肾组织的细胞凋亡水平,但这种作用可能弱于阳性对照药物。
MAPK级联反应是胞内信号转导的重要途径,广泛存在于真核细胞内,参与调节细胞生长、氧化应激、炎症反应和细胞调亡等过程[29]。在MAPK家族成员中,最早得以证实的是ERK转导途径,其是MAPK信号转导的经典通路,能调控肾小管上皮细胞间充质转分化,抑制ERK1/2蛋白的磷酸化,能够改善肾小管上皮细胞间充质转分化而减轻肾纤维化程度[30]。除ERK1/2之外,MAPK家族还包括p38 MAPK、JNK两个成员。其中,p38 MAPK作为MAPK信号通路中的一员,是控制炎症反应的主要因子,在应激条件下参与细胞凋亡、免疫调节及炎症反应过程。有研究表明,p38 MAPK与氧化应激程度及肾纤维化进展密切相关[31]。JNK家族是MAPK信号通路成员,可被炎症因子(如IL-6、TNF-α等)、氧化损伤等多种因素激活,JNK信号通路在细胞凋亡、氧化应激反应以及多种人类疾病的发生与发展过程中起着至关重要的作用[32]。为探讨黄芪水提物抗CRF作用与MAPK信号通路的相关性,本研究采用Western blotting法检测了MAPK信号通路中p38 MAPK、p-p38 MAPK、ERK1/2、p-ERK1/2、JNK、p-JNK蛋白的表达情况。结果显示,模型组大鼠肾组织中p-p38 MAPK、p-ERK1/2、p-JNK蛋白的相对表达量均较对照组显著升高。经不同剂量黄芪水提物处理后,与模型组比较,各给药组大鼠肾组织中p-p38 MAPK、p-ERK1/2、p-JNK蛋白的相对表达量均显著降低。这提示黄芪水提取可通过抑制p38 MAPK、ERK1/2及JNK蛋白的磷酸化来抑制MAPK信号通路,从而缓解CRF的进展。
综上所述,黄芪水提物对CRF模型大鼠具有一定的改善作用,可抑制其炎症反应、氧化应激和细胞凋亡,其作用机制可能与抑制MAPK信号通路相关调控蛋白的表达有关。本研究虽初步探讨了黄芪水提物治疗CRF模型大鼠的可能机制,为黄芪用以CRF的临床治疗提供了理论和实验依据,但并未阐明其发挥作用的主要活性单体。本课题组后续将深入探讨其活性单体,并进一步阐明其具体作用机制。
