基于网络药理学探讨骨碎补治疗骨质疏松症的作用机制Δ
2019-05-31林适吴潇烁陈柏行陈超吴宇航周琦石何才勇
林适,吴潇烁,陈柏行,陈超,吴宇航,周琦石,何才勇,#
(1.广州中医药大学第一临床医学院,广州510006;2.广州中医药大学第一附属医院一骨科,广州 510405)
骨质疏松症(Osteoporosis,OP)是一种严重危害人类健康、以骨量及骨组织微结构异常为特征的代谢性骨疾病,其可引起骨脆性增加,增加患者骨折风险[1-2]。随着社会人口老龄化,OP的发生率不断上升,严重影响了老年人的健康及生活质量[3]。由于其高发病率、高致残率的特点,OP已经成为世界普遍关注的公共卫生问题[3]。目前,针对OP的防治药物以骨吸收抑制剂、骨生成促进剂、骨矿化物为主(包括降钙素、双膦酸盐、氟化物等),但这些药物只能改善患者临床症状、延缓病情,并不能从根本上改善骨代谢情况,亦不能恢复成骨与破骨进程的动态平衡,并且存在一定的副作用[2]。
目前,中医药治疗OP已引起了国内外学者的关注[4]。已有研究表明,骨碎补总黄酮能增强成骨细胞的活性,调节骨代谢过程中的细胞因子,降低破骨细胞活性,促进肠道对钙的吸收和钙在骨内的沉积[5],有望用于OP的治疗。但中药具有多组分特性,其作用于机体的机制也相对复杂,通过动物实验或细胞试验的方法研究中药分子机制相对困难,而且会耗费大量人力物力。随着系统生物学的发展,越来越多的相关研究成果使明确中医药发挥疗效的分子机制成为可能[6-8]。因此,本研究基于网络药理学的方法,分析骨碎补的有效活性成分、作用靶点及其可能的作用机制,同时通过网络分析的方法进一步预测骨碎补抗OP的靶点,并对相关靶点进行通路富集分析,探讨骨碎补治疗OP的潜在作用机制。
1 资料与方法
1.1 骨碎补中活性化合物及其作用靶点预测
通过中药系统药理学成分分析平台(BATMANTCM)数据库(http://bionet.ncpsb.org/batman-tcm)和GeneCards数据库(https://www.genecards.org/)来预测骨碎补作用靶点。BATMAN-TCM是一个在线中药分子机制的生物信息学分析工具,它的主要功能有中药成分靶点预测、靶点的功能分析、相关网络的可视化及中药的对比分析[9],可通过“相似产物靶点相近”的原理进行靶点预测,用“留一法”(Leave-one-drug-out)互作交叉验证进行预测的验证,用已验证过的化合物与蛋白的相互作用作为“金标准”来进行互作验证[9]。GeneCards是一个综合数据库,参考了UniProt、AKS、PharmGKB等几大数据库对于基因的分析数据,可提供简明的基因组、蛋白质组、转录、遗传和功能上所有已知的和预测的人类基因[10]。本研究首先以“GUSUIBU”为检索词在BATMAN-TCM数据库中检索获得骨碎补的化合物;同时,在BATMAN-TCM数据库中设置Cut-off值为20、P≤0.05,来预测骨碎补作用靶点;然后在GeneCards数据库中设置候选靶点为“人类”,根据从BATMAN-TCM数据库得到的化合物进行靶点筛选;最后,取两个数据库获得靶点的交集,得到骨碎补相关作用靶点。
1.2 OP相关疾病靶点检索
检索 TTD、DrugBank、OMIM、GAD、PharmGKB、CTD这6个公认的在线数据库,设置关键词为“Osteoporosis”,进行OP的已知相关疾病靶点检索。对从这6个数据库获得的检索结果进行汇总、对比分析并取交集,最终获得OP疾病相关靶点。
1.3 骨碎补-OP疾病交集靶点相互作用网络构建
对“1.1”“1.2”项下获得的骨碎补相关作用靶点和OP已知疾病靶点取交集,提取整理交集靶点基因,通过STRING在线数据库(http://string-db.org/)进行蛋白相互作用(Protein-protein interaction,PPI)网络的构建;同时,运用网络可视化软件Cytoscape 3.6.1对获得的PPI网络数据进行处理分析获得关键靶点,对生物分子的相互作用网络进行可视化展示,并通过力导向算法使网络节点分布合理[11],获得清晰的可视化框架。
1.4 基因本体论分析
基因本体论(Gene ontology,GO)是用于描述基因产物功能并广泛应用于生物信息学领域的一个本体[12]。作为一个广泛用于基因功能分类的系统,其涵盖生物学的3个方面:生物途径、细胞组分、分子功能[12]。本研究采用在线分析工具DAVID(https://david.ncifcrf.gov/)对骨碎补-OP疾病交集靶点进行GO富集分析,通过统计学超几何分布定量评估存在于各GO注释中的蛋白质群,以P值反映蛋白质生物功能的显著性(P<0.05表示有显著性)。DAVID是一个生物信息数据库,整合了生物学数据和分析工具,为大规模的基因或蛋白列表提供系统综合的生物功能注释信息,帮助用户从中提取生物学信息[13]。笔者在输入目标基因列表后,目标基因会关联到生物学注释上,进而从无数个关联的注释中筛选出骨碎补-OP疾病交集靶点富集最具显著性(P<0.05为具有显著性)的生物学注释[13]。
1.5 KEGG通路富集分析
本研究应用在线分析工具KOBAS(http://kobas.cbi.pku.edu.cn/)对骨碎补-OP疾病交集靶点进行KEGG富集分析[14]。KEGG数据库可通过输入目标靶点,筛选出显著富集的通路[15]。通路P值小于0.05时,则认为其是具有显著性的关键通路;P值越小,则其显著性程度越高。
1.6 关键基因的筛选及其对OP治疗作用的预测
关键基因是指在生物学过程中发挥了举足轻重作用的基因,并可在相关通路中调控其他基因发挥作用的过程[16]。关键基因是基于PPI网络拓扑结构筛选而得。但运用Cytoscape 3.6.1软件构建蛋白/基因的互作网络后,往往会因为基因/蛋白等分子节点之间的相互连线而掩盖关键基因[17],因此需通过 MCC、DMNC、Degree、EPC、BottleNeck等算法对网络结构和节点进行计算分析[17],得到骨碎补治疗OP的关键基因。其中的MCC算法是一种较新的算法,在预测重要基因方面更有优势[18],因此本研究采取MCC算法进行关键基因的筛选,所得基因的分值越高,则其显著性越高。
2 结果
2.1 骨碎补-OP疾病交集靶点的预测结果
通过BATMAN-TCM检索得到骨碎补化合物7个,分别为柚皮素(Naringenin)、菜油甾醇(Campesterol)、豆甾醇(Stigmasterol)、柚皮苷(Naringin)、γ-谷固醇(Gamma-Sitosterol)、芸香柚皮苷(Narirutin)、桔皮苷(Hesperidin);同时获得其作用靶点共395个。通过GeneCards数据库筛选获得靶点234个。通过TTD等6个数据库共筛选获得OP的疾病靶点共761个。取上述三者的交集,最终获得骨碎补-OP疾病交集靶点共136个,其网络可视化图谱见图1(图中,矩形和三角菱形分别为骨碎补及其化合物,圆形为筛选获得的交集靶点)。
2.2 骨碎补-OP疾病交集靶点的GO分析结果
GO分析结果显示,136个骨碎补-OP疾病交集靶点的生物途径主要包括Response to chemical(化学反应)、Steroid metabolic process(类固醇代谢过程)、Cellular response to chemical stimulus(细胞对化学刺激的应答)等;基因所处细胞组分主要包括Extracellular space(细胞外间隙)、Extracellular region part(胞外区部分)、Cytoplasmic part(细胞质)等;分子功能主要包括Heme binding(血红素结合)、Tetrapyrrole binding(四吡咯结合)、Monooxygenase activity(单氧酶活性)等,详见表1。
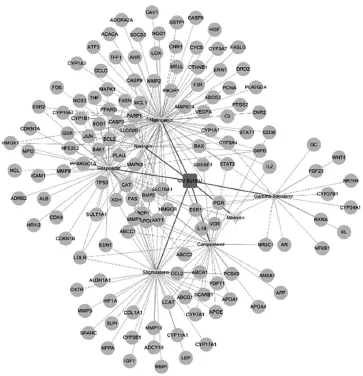
图1 骨碎补-OP疾病交集靶点DPI可视化图谱Fig 1 PPI visualization map of D.rhizoma-OP disease intersection target
2.3 KEGG通路富集分析结果
对136个骨碎补-OP疾病交集靶点的KEGG通路富集分析结果显示,P值小于0.05的骨碎补治疗OP所涉及的信号通路有136个,主要与骨代谢、内分泌、炎症、肿瘤、细胞凋亡等相关。显著性程度排前7位的信号通路见表2,排前80位的信号通路结果见图2(图中,圆形节点为信号通路,其大小越大,则表示通路显著性程度越高)。
2.4 关键基因分析结果
根据MCC算法获得显著性程度排前30位的靶点作为骨碎补-OP疾病交集靶点中的关键基因,按显著性由高到低排序分别为ALB、AKT1、JUN、BCL2、CASP3、PTGS2、NFKB1、MAPK8、MAPK1、IGF1、FOS、MMP9、CYCS、CCL2、IL1B、PPARG、EDN1、LEP、CAT、APOE、ESR1、IL2、NOS3、ICAM1、CASP8、BAX、PARP1、PCNA、CDKN1A、CASP9,详见图3(图中,圆形节点为非关键基因,六边形为关键基因,关键基因节点颜色由浅至深以及节点大小由小至大均表示节点在网络中的重要性升高);富集关键基因数目≥5个的通路见表3。

表1 骨碎补-OP疾病交集靶点GO分析结果Tab 1 GO analysis of D.rhizoma-OP disease intersection target

表2 KEGG通路富集分析中显著性程度排前7位的信号通路Tab 2 Top 7 signaling pathways in the list of significance degree in KEGG pathway enrichment analysis
3 分析与讨论
OP在老年人中非常常见,而随着社会人口老龄化的加剧,OP患者数量也将不断增加。从中医病机来看,OP与肾虚关系密切[4]。研究发现,补肾类中药具有促进成骨细胞增殖、抑制破骨细胞活性、调节雌激素水平及其受体、促进骨髓间充质干细胞(MSCs)成骨并抑制其成脂,调节骨保护蛋白(OPG)/核因子κB受体活化因子(RANK)/核因子κB受体活化子配体(RANKL)系统和钙磷代谢等作用[19]。补肾类中药具有补肾阳、强筋骨、益精髓等作用,对临床治疗OP具有重要意义[4,19-20]。骨碎补就是可用于治疗OP的补肾类中药,已有研究证实其总黄酮具有抗OP的潜力[20]。
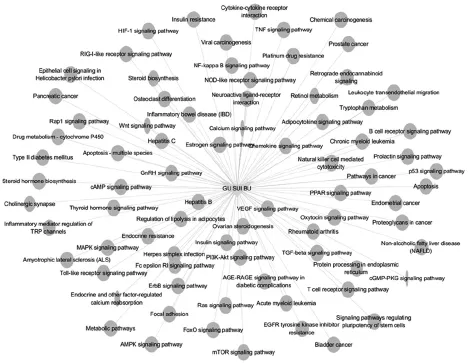
图2 KEGG通路富集分析中显著性程度排前80位的信号通路Fig 2 Top 80 signaling pathways in the list of significance degree in KEGG pathway enrichment analysis
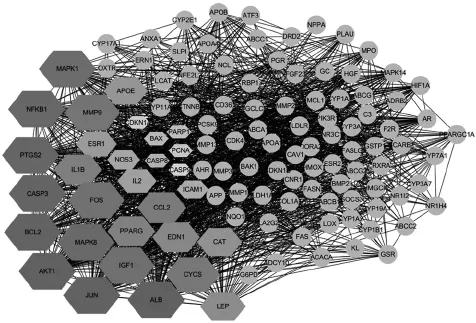
图3 关键基因分析显著性程度排前30位的骨碎补-OP疾病交集靶点可视化图谱Fig 3 Visualization map of top 30 D.rhizoma-OP disease intersection targets in the list of significance degree of key gene analysis
骨碎补属于真蕨目骨碎补科蕨类植物,其味苦,性温,归肝、肾经,具有活血续伤、补肾强骨的功效,在临床上对OP有很好的疗效[20-21]。本研究通过BATMANTCM数据库检索获得骨碎补的7个化合物,进一步通过BATMAN-TCM结合GeneCards数据库检索获得化合物作用靶点,再通过公认的TTD等6个在线数据库检索获得OP疾病靶点,最后取三者交集获得骨碎补-OP疾病交集靶点136个。由图1PPI网络分析结果显示,骨碎补的7个化合物可作用于多个靶点,而PPARG、ESR1、AR等靶点也可与多个骨碎补化合物产生相互作用。这提示骨碎补有效成分之间存在协同作用。

表3 富集关键基因数目≥5个的通路Tab 3 Pathways with more than 5 key enrichment genes
通过KEGG通路富集分析,由表2可见,Pathways in cancer(癌症信号通路)、AGE-RAGE signaling pathway in diabetic complications[晚期糖基化终末产物及其受体(AGE/RAGE)信号通路]、Hepatitis B(乙型肝炎信号通路)、TNF signaling pathway(肿瘤坏死因子信号通路)、Apoptosis(细胞凋亡信号通路)、Proteoglycans in cancer(癌症中的蛋白聚糖信号通路)和Endocrine resistance(雌激素信号通路)是骨碎补对OP发挥作用显著性程度最高的信号通路。这些通路都较为复杂,包括多个下游通路。例如癌症信号通路的下游通路包括Wnt信号通路、Hedgehog信号通路、Notch信号通路、低氧诱导因子1(HIF-1)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、过氧化物酶体增殖物激活受体(PPAR)信号通路、血管内皮细胞生长因子(VEGF)信号通路等。又如AGE/RAGE信号通路可通过调控蛋白激酶C(PKC)、p38 MAPK、转化生长因子β(TGF-β)、核因子κB(NF-κB)以及细胞外信号调节激酶1/2(ERK1/2)信号通路从而调节细胞和系统反应,增加骨基质蛋白的表达[22]。TNF信号通路包括细胞凋亡、细胞存活、炎症和免疫在内的多个细胞内信号通路。TNF主要有TNFR1和TNFR2两种受体,TNFR1信号通路可激活诱导许多基因的激活,主要受两种不同的途径控制:NF-κB途径和MAPK级联途径;TNFR2信号通路可激活NF-κB信号通路,包括磷酸肌醇3激酶(PI3K)依赖性NF-κB信号通路和c-Jun氨基末端激酶(JNK)信号通路。结合图2可见,除了上述复杂的信号通路外,骨碎补活性成分还可直接调控这些通路包含的下游通路。
通过关键基因的筛选及分析,由表3可见,关键基因在以上这些通路中的富集数目有30个,其P值均不大于1.96×10-9,进一步说明这些通路的重要性。
4 结语
骨碎补抗OP作用主要可归结为直接调控骨代谢和间接调节骨代谢两个方面,主要作用于成骨、破骨过程,使两个进程维持平衡。OP的发生与发展的病因主要是成骨和破骨的动态平衡被打破,因此与此相关的信号通路均可能作为抗OP治疗的主要通路。直接调节骨代谢通路包括Wnt信号通路、Notch信号通路、TGF-β信号通路、破骨细胞分化信号通路、MAPK信号通路、Hedgehog信号通路等。其中,Wnt蛋白是一组分泌的糖蛋白,是促进成骨细胞分化和活性的重要调节因子[23]。TGF-β信号通路在骨形成过程中扮演着重要角色,能促进骨母细胞增殖和早期分化,抑制破骨细胞活性[24-26]。Notch信号通路调节MSCs向成骨细胞分化,推动成骨进程,并具有抑制成骨细胞分化及降低骨量的作用[27-29]。MAPKs在成骨细胞发育过程中起着重要作用,通过作用于成骨细胞调节骨形成[30]。Hedgehog信号通路主要参与促进MSCs向成骨细胞及软骨细胞分化,而阻止其向脂肪细胞分化[31-32]。其他显著性程度相对较高的通路如雌激素信号通路、PI3K-Akt信号通路、VEGF信号通路、甲状腺信号通路、HIF-1信号通路等可通过间接调节骨代谢发挥抗OP作用。
综上,骨碎补治疗OP的作用机制呈多靶点、多通路、多系统的特性,除了影响骨代谢相关途径,还可影响体内多种代谢途径。
