胆汁淤积性疾病中低氧诱导因子-2α对心肌营养素-1表达的调节作用*
2019-05-31华相伟黄冰源王绮夏
陈 勇 华相伟 黄冰源 王绮夏 夏 强 马 雄&
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所1(200001) 上海交通大学医学院附属仁济医院肝脏外科2 青岛大学附属医院肝病中心3
背景:研究显示心肌营养素-1(CT-1)在器官损伤保护以及糖、脂代谢等过程中具有重要调节作用。目的:探讨胆汁淤积性疾病中低氧诱导因子(HIFs)对CT-1表达的调节作用。方法:2016年6月—2017年6月于上海交通大学医学院附属仁济医院招募胆道闭锁患儿23例,7名健康活体肝移植供体作为对照组。以免疫组化法和蛋白质印迹法检测肝组织中的HIF-1α、HIF-2α、CT-1细胞定位和表达。在体外实验中,予人脐静脉内皮细胞(HUVEC)强氧化剂H2O2处理,并以RNA干扰技术沉默HIF-2α表达,以蛋白质印迹法和real-time PCR检测HIF-2α、CT-1表达变化。结果:在胆汁淤积患儿肝组织中,HIF-2α和CT-1共同分布于胆管细胞以及基质细胞如血管内皮细胞和炎性细胞,HIF-1α仅偶见于炎性细胞。与健康对照者的肝组织相比,胆汁淤积患儿肝组织中HIF-2α、CT-1表达明显升高。H2O2诱导的氧化应激可显著上调HUVEC HIF-2α、CT-1表达,HIF-2α siRNA则可在转录水平抑制H2O2诱导的CT-1表达。结论:在小儿胆汁淤积性疾病中,CT-1表达受HIF-2α而非HIF-1α调节。胆汁淤积进程中的氧化应激中存在HIF-2α依赖性的CT-1表达调节机制。
作为白细胞介素-6(IL-6)家族成员,心肌营养素-1(cardiotrophin-1, CT-1)已被证明可在多种病理生理过程中发挥多种功能[1-2]。早期研究主要阐述了CT-1对器官损伤的保护作用,如缺血再灌注损伤以及由其他有害因素引起的器官功能衰竭[3-4],最近一些研究指出CT-1也可能参与调节葡萄糖和脂质代谢[5-7]。笔者所在团队前期研究[8]还证实了CT-1在小儿胆汁淤积性肝病中的潜在促纤维化作用,然而其表达调节机制仍有待进一步探索。
氧化应激是多种胆汁淤积性疾病进展的共同特征,可驱动炎症反应和纤维化[9-10]。低氧诱导因子(hypoxia-inducible factors, HIFs)为碱性螺旋蛋白(basic helix-loop-helix, bHLH)-PAS家族成员,是氧化应激状态下的重要转录因子[11-12]。HIF-1α和HIF-2α是HIFs的主要调节亚基,两者既有共同的靶基因,如血管内皮生长因子(VEGF)和葡萄糖转运蛋白1(GLUT1)[11,13],又可调节各自特定的靶基因表达,如磷酸甘油酸酯激酶1(PGK1)和八聚体结合转录因子4(Oct-4)[14-15]。至于CT-1,有报道称HIF-1ɑ参与了心肌细胞CT-1转录水平的表达上调[16]。本研究拟探讨HIFs是否参与了胆汁淤积性疾病中CT-1表达的调节。
材料与方法
一、标本来源
于2016年6月—2017年6月招募行肝移植术的胆道闭锁患儿23例,其中男性12例,女性11例,年龄(24.59±3.60)个月;胆汁淤积经手术和病理证实。对照组肝组织源自同期7名健康活体肝移植供体,其中男性3名,女性4名,年龄(25.86±2.55)岁,临床诊断无肝脏相关疾病,无肝功能障碍症状或体征,无其他严重炎症或全身性疾病。两组肝组织标本均取材于肝移植术中。病例和对照均招募自上海交通大学医学院附属仁济医院,均签署知情同意书。研究方案通过医院伦理委员会审批。
二、细胞株、主要试剂和仪器
人脐静脉内皮细胞(HUVEC, ATCC)。HIF-1ɑ、HIF-2ɑ、CT-1抗体(Abcam plc.);β-actin抗体、HRP标记IgG(Cell Signaling Technology);Lipofect-amineTM2000转染试剂、InvitrogenTMTRIzolTM试剂、ECL发光试剂盒(Thermo Fisher Scientific);HIF-2α siRNA、对照siRNA(上海吉玛制药技术有限公司);逆转录试剂盒、real-time PCR试剂盒(Takara Bio Inc.);CT-1、β-actin PCR特异性引物[生工生物工程(上海)股份有限公司]。Applied BiosystemsTMABI PRISMTM7900HT序列检测系统(Thermo Fisher Scientific)。
三、方法
1. 免疫组化染色:肝组织标本4%甲醛固定24 h,常规脱水,石蜡包埋,4 μm厚切片;石蜡切片60 ℃烤片1 h,脱蜡水化,3% H2O2处理15 min以消除内源性过氧化物酶活性;枸橼酸微波法行抗原修复,自然冷却至室温;滴加山羊血清封闭非特异性结合位点,室温孵育30 min;分别加入HIF-1ɑ、HIF-2ɑ、CT-1一抗,4 ℃湿盒过夜后复温30 min,PBS漂洗3次;滴加HRP标记的二抗,DAB显色,苏木精复染,自然晾干,中性树胶封片。
2. 细胞培养和处理:HUVEC加入含10%胎牛血清和青链霉素双抗的RPMI 1640培养基,置于25 mL 培养瓶中,在5% CO2、37 ℃细胞孵育箱中培养。根据需要以H2O2(0、50、100 μmol/L)处理24 h。参照试剂说明书制备转染复合物(100 pmol siRNA+5 μL LipofectamineTM2000转染试剂+500 μL Opti-MEM培养基),转染HUVEC。HIF-2α siRNA序列:F 5’-GCG CAA AUG UAC CCA AUG ATT-3’, R 5’-UCA UUG GGU ACA UUU GCG CTT-3’。
3. Real-time PCR:以TRIzol试剂提取经不同处理HUVEC的总RNA,逆转录合成cDNA,以之为模板,使用SYBR®Premix Ex TaqTMⅡ(Perfect Real Time)行real-time PCR。引物序列:β-actin(内参)F 5’-TTG ACG GAA GGG CAC CAC CAG-3’, R 5’-GCA CCA CCA CCC ACG GAA TCG-3’; CT-1 F 5’-GGG AGG GAA GTC TGG ACC C-3’, R 5’-CCC GAA GGG GTC TCC CTG-3’。每组设3个复孔。2-△△CT法计算样本目的基因mRNA相对表达量。
4. 蛋白质印迹法:制备肝组织匀浆或收集经不同处理的HUVEC,加入蛋白裂解液裂解10 min,4 ℃ 12 000 r/min离心10 min,取上清液,BCA法定量蛋白浓度。取40 μg总蛋白上样,10% SDS-PAGE电泳分离后转移至PVDF膜,5%脱脂奶粉封闭1 h;分别加入HIF-2α、CT-1、β-actin一抗(工作浓度分别为1∶500、1∶500、1∶3 000),4 ℃孵育过夜;TBST洗膜5 min×5次,加入二抗(工作浓度1∶5 000 ),常温孵育1 h,ECL发光显色。
四、统计学分析
结 果
一、胆汁淤积患儿肝组织HIF-1α、HIF-2α、CT-1表达的细胞定位
为研究HIFs是否调节CT-1表达,首先检测胆汁淤积患儿肝组织中的HIFs和CT-1表达。免疫组化染色结果显示HIF-1ɑ仅在一些炎性细胞中偶然可见,HIF-2α则在胆管细胞以及血管内皮细胞、炎性细胞等基质细胞的细胞核中广泛表达,CT-1表现出与HIF-2α相似的表达分布(图1)。上述结果提示胆汁淤积中的肝组织CT-1表达可能主要受HIF-2α而非HIF-1ɑ调节。
二、胆汁淤积患儿肝组织HIF-2α、CT-1表达升高
进一步采用蛋白质印迹法检测肝组织HIF-2α、CT-1表达水平,结果显示胆汁淤积患儿肝组织两者表达与正常肝组织相比均明显升高(图2)。
三、H2O2刺激上调HIF-2α、CT-1表达
氧化应激在胆汁淤积进展中起重要作用。体外研究以强氧化剂H2O2处理HUVEC诱导氧化应激,蛋白质印迹法和real-time PCR检测显示,HUVEC HIF-2α蛋白表达上调(图3A),CT-1 mRNA和蛋白表达均上调(图3A、3B)。
四、H2O2诱导CT-1表达上调依赖于HIF-2α
为确定HIF-2α对HUVEC CT-1基因的转录激活作用,以RNA干扰技术沉默HIF-2α表达,蛋白质印迹法检测显示,HIF-2α siRNA可显著降低经H2O2(50 μmol/L)刺激的HUVEC中的HIF-2α、CT-1蛋白表达(图4A);更重要的是,real-time PCR检测显示CT-1 mRNA表达亦显著下调(图4B)。上述发现提示,在H2O2诱导的氧化应激中,HIF-2α在转录水平调节CT-1表达。

白色箭头示胆管,黑色箭头示血管内皮

图2 胆汁淤积患儿和健康对照者肝组织HIF-2α、CT-1蛋白表达(蛋白质印迹法)
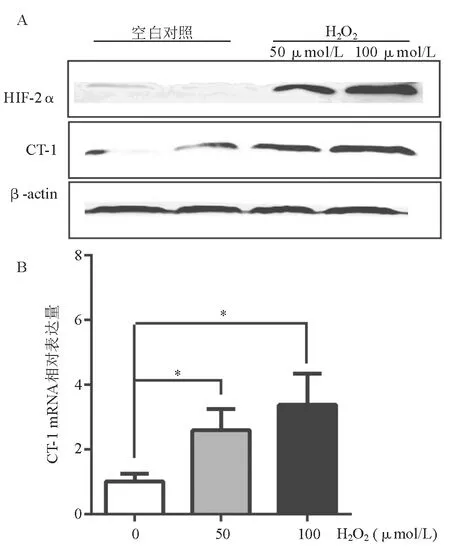
*两组间比较,P<0.05
A:HIF-2α、CT-1蛋白表达上调(蛋白质印迹法);B:CT-1 mRNA表达上调(real-time PCR)
图3 H2O2处理后HUVEC HIF-2α、CT-1表达变化

**两组间比较,P<0.01
A:HIF-2α、CT-1蛋白表达下调(蛋白质印迹法);B:CT-1 mRNA表达下调(real-time PCR)
图4HIF-2α siRNA处理后经H2O2(50 μmol/L)刺激的HUVEC HIF-2α、CT-1表达变化
讨 论
现有研究已证明CT-1在器官损伤保护以及糖、脂代谢等过程中具有重要调节作用。笔者所在团队还证实了CT-1在胆汁淤积中的促纤维化作用。本研究拟进一步探讨胆汁淤积性疾病中CT-1表达的调节机制。
HIFs的HIF-1α和HIF-2α亚基在功能上虽有一定共性,但两者也在许多病理生理过程中表现出独特甚至相反的功能[14-15,17-19],此种差异可能与两者的表达模式不同有关。HIF-1α mRNA表达广泛,HIF-2α mRNA表达则更多地限于特定组织,如内皮细胞和肺间质中[18]。免疫组化分析显示HIF-2α在低氧状态下的脑、心、肺、肾、肝、胰腺和肠组织特定细胞群中均有表达[20]。本团队之前的研究[21]描述了HIF-2α在肝细胞中的作用,证明HIF-2α可促进胆汁淤积期间的肝细胞凋亡。本研究通过免疫组化染色发现HIF-2α在胆道闭锁胆汁淤积患儿肝脏胆管细胞和基质细胞如血管内皮细胞中广泛表达,同时观察到CT-1的表达分布与HIF-2α相似。有趣的是,尽管先前研究[16]证实HIF-1α参与了小鼠心肌细胞的CT-1表达上调,但本研究发现HIF-1α在胆汁淤积中仅偶见于一些炎性细胞。蛋白表达水平的研究结果亦证实HIF-2α和CT-1在胆汁淤积患儿肝组织中表达升高。上述结果提示,在小儿胆汁淤积性疾病中,肝组织CT-1表达上调系受HIF-2α而非HIF-1α调节。
在胆汁淤积进程中,氧自由基相关氧化应激可激活多个促纤维化和炎症反应关键信号通路[22]。HIF-2α是参与胆汁淤积的重要转录因子,可介导对氧化应激的初级转录反应[21]。 此外,氧自由基还有利于各种细胞因子和生长因子的合成和活化[22-24]。先前研究[16]发现氧化应激可刺激CT-1表达,后者作为反应性保护因子对细胞凋亡起保护作用。本研究体外实验证实,强氧化剂H2O2处理可显著上调HUVEC的HIF-2α和CT-1蛋白表达,沉默HIF-2α则可在转录水平抑制H2O2诱导的CT-1表达,提示了氧化应激下CT-1转录上调的HIF-2α依赖性机制。目前已有证据证明HIF-2α活化可促进纤维化进程[25-26],而本研究发现HIF-2α参与介导了氧化应激诱导的CT-1表达上调,由此发挥促纤维化作用。因此,HIF-2α可能分别通过直接和间接途径促进纤维化发生。
综上所述,本研究结果表明,在小儿胆汁淤积性疾病中,CT-1表达受HIF-2α而非HIF-1α调节;胆汁淤积进程中的氧化应激中存在HIF-2α依赖性的CT-1表达调节机制,该机制有望成为胆汁淤积性疾病的新型治疗靶点。
