芥菜浸提液对豇豆连作土壤性质及幼苗生理指标的影响
2019-05-30张福建杨有新范淑英吴超群吴才君
陈 昱 张福建 杨有新 范淑英 王 强 吴超群 王 丰 吴才君
(江西农业大学农学院,江西 南昌 330045)
豇豆(VignaunguiculataL.Walp.)富含维生素B1、维生素B2、维生素C和植物蛋白质等营养成分,其味道鲜美,易栽培、种植范围广,是我国重要的蔬菜品种之一。近年来,豇豆连年种植引发的连作障碍日益严重,导致豇豆苗生长受到抑制,光合作用能力下降,同时土传病虫害加剧,亦造成豇豆产量与品质连年下降[1]。因此,研究如何缓解或消除连作障碍对保证豇豆品质和产量,促进豇豆产业的可持续发展具有重要意义。
植物的化感作用是植物通过茎叶挥发、茎叶淋溶、根系分泌及植物残株的腐解等途径向环境释放化学物质,从而对周围植物(包括微生物)产生直接或间接的、有利或有害的作用,包括对植物生长、发育和种子萌发等的影响[2-3]。大量研究表明,利用农作物间的化学他感作用原理合理安排轮作、间套作等栽培模式可以达到减轻病虫害,提高蔬菜产量和品质的效果,是解决连作障碍最简单有效的方法之一[4-6]。间套作能够通过根系分泌物介导的植物-土壤-微生物三者之间的根际相互关系,改变田间小气候与土壤微生态环境影响土壤理化及土壤病菌的改变[7]。张江红等[8]采用桃树枝条及其浸提液还田处理,发现土壤蔗糖酶、过氧化氢酶、脲酶活性均显著高于对照处理。Makoi等[9]研究发现豇豆与高粱间套作有助于提高豇豆根际土壤中的酸性磷酸酶活性,增强豇豆对磷的吸收,从而提升产量。董淑琦等[10]采用谷子叶片和茎秆的水浸提液处理玉米种子,发现高浓度的谷子秸秆水浸提液抑制玉米根长和芽长生长,而低浓度则表现为促进作用。
研究表明,十字花科植物含有的芥子油被酶水解后生成的异硫氢酸类物质,具有抗菌活性,能够改变土壤微生物结构,从而抑制病害的发生[11-12]。芥菜能显著提高土壤微生物的多样性,降低土壤中真菌和尖孢镰刀菌的数量,改善土壤微生态结构,有利于减轻连作障碍的危害,其中高硫含量的芥菜对黄瓜枯萎病的抑制效果优于低硫含量芥菜[13]。然而,通过芥菜浸提液影响豇豆种子发芽、连作下幼苗生长以及缓解豇豆幼苗连作障碍的作用机制尚鲜见报道。本试验选用豇豆作为试验材料,研究芥菜浸提液对豇豆种子及连作下豇豆幼苗生长的影响及其生理机制,旨在通过植物的化感作用,寻找安全有效减轻豇豆连作障碍的方法,为缓解豇豆连作障碍提供理论依据。
1 材料与方法
1.1 试验材料
试验于2017年5月开始。供试豇豆品种为华赣彩蝶·绿帅;芥菜品种为本地芥菜笋。供试土壤为旱地连作5年红壤土,供试种子和土壤均由江西华农种业有限公司提供。芥菜由江西农业大学生态园蔬菜基地种植所得。将风干芥菜叶研磨得到芥菜干粉,芥菜干粉与蒸馏水按1∶10(m/v)浸泡24 h,过滤除去残渣,得到100 g·L-1芥菜水浸提液,4℃冰箱保存备用。发芽试验在恒温培养箱中进行,温度28±1℃。幼苗试验于组培室中进行,温度25±3℃、光照12 h·d-1。
1.2 试验仪器
UV-2600岛津紫外可见分光光度计,日本岛津企业管理有限公司;SPX-50生化培养箱,杭州绿博仪器有限公司;LA-2400根系扫描仪,上海泽泉科技股份有限公司;HI-2315型电导率仪,HANNA instruments;Five Easy Plus pH仪,梅特勒托利多仪器有限公司;SPAD-502 plus叶绿素仪,柯尼卡美能达(中国)投资有限公司。
1.3 试验设计
1.3.1 豇豆种子发芽试验设计 选取饱满无虫害、大小一致的豇豆种子用温开水洗净后,转移至铺有两层滤纸的培养皿中,每个培养皿20粒种子,然后在培养皿中分别加入10 mL浓度分别为10、20、40 g·L-1芥菜水浸提液,以加入相同体积蒸馏水为对照(CK),共4个处理,3次重复。将培养皿置于28℃恒温箱内催芽,11 h后开始统计发芽率,3 d后测量相关指标。
1.3.2 豇豆幼苗试验设计 选取饱满无虫害的豇豆种子采用温水浸种,洗净后转移至铺有两层滤纸的培养皿中,28℃恒温箱内催芽;选取发芽一致的种子播种于装有豇豆连作土壤的营养钵(直径为10 cm,高11 cm)中,待种子出土开始浇灌豇豆幼苗,每2 d浇灌一次20 mL浓度分别为10、20、40 g·L-1的芥菜水浸提液,对照处理浇灌同体积的蒸馏水,每个处理10盆,3次重复,15 d后测定相关指标并采集土壤和叶片样品。
1.4 测定指标与方法
1.4.1 发芽指标的测定 在20℃恒温箱催芽11 h后开始统计发芽率,每隔3 h统计一次,共6次。后期每隔12 h统计一次,第3天测定胚根长度和侧根数量。按照公式分别计算发芽率、发芽势、发芽指数(germination index, GI)、平均发芽时间(mean germination time, MGT)和活力指数;
发芽率=发芽种子/供种子总数×100%
(1)
发芽势=高峰期时的种子发芽数/种子总数×100%
(2)
GI=Σ(Gt/Dt)
(3)
式中,Gt:第t天的发芽数;Dt:发芽的天数。
MGT=Σ(Gt×Dt)/ΣGt
(4)
活力指数=胚芽长度×发芽指数
(5)。
采用Williamson等[14]所提出的化感效应指数(response index,RI)衡量芥菜浸提液对豇豆种子萌发各项指标的影响。C为对照值,T为处理值;当T≥C时,RI=1-C/T;当T
1.4.2 生长指标的测定 株高、茎粗分别采用卷尺和游标卡尺测量;质量采用天平测定;根系形态指标采用根系扫描仪测定。
1.4.3 土壤指标的测定 土壤pH值采用酸度计法测定,土壤电导率值采用电导率仪测定,其土水比均为1∶5(m/v)。土壤酶活性参照关松荫[15]的方法,脲酶活性测定采用靛酚比色法,以反应24 h后每克土壤中NH3-N的毫克数表示;蔗糖酶活性测定采用3,5-二硝基水杨酸比色法,以24 h后每克土壤中葡萄糖的毫克数表示;多酚氧化酶的活性测定采用邻苯三酚比色法,以2 h后每克土壤中生成的紫色没食子素的毫克数表示;酸性磷酸酶活性测定采用磷酸苯二钠比色法,以24 h后每克土壤中释放出的酚的毫克数表示。
1.4.4 生理指标的测定 酶提取的制备:采用天平称取0.2 g叶片,剪碎放入预先冷却好的研钵中,加入2 mL 0.05 mol·L-1磷酸缓冲液(pH值7.8,含0.2 mmol·L-1EDTA,2%PVP)研磨成匀浆,4℃下,12 000 r·min-1离心10 min,取上清液,低温保存用于测定抗氧化酶活性。蛋白质和H2O2含量均采用试剂盒(南京建成生物工程研究所)法;过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)活性的测定参照Cakmak等[16]的方法并加以改进;超氧化物歧化酶(superoxide dismutase,SOD)活性的测定参照Stewart等[17]的方法;谷胱甘肽还原酶(glutathione reductase,GR)活性的测定参照Foyer等[18]的方法;脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)活性的测定参照Nakano等[19]的方法并加以改进;相对叶绿素(soil and plant analyzer development,SPAD)含量利用相对叶绿素仪测定。
1.5 数据分析
采用Microsoft Office Excel 2013进行数据整理;SPSS 20.0软件进行相关性分析,并运用Duncan新复极差法对显著性差异进行多重比较;采用Graph Pad软件作图。
2 结果与分析
2.1 不同浓度芥菜浸提液对豇豆种子发芽的影响
由表1可知,CK豇豆种子发芽势最高,且显著高于其他处理。40 g·L-1芥菜浸提液处理的发芽势、发芽率和发芽指数均为最低,且显著低于其他处理,而其平均发芽天数则显著增加。活力指数在10 g·L-1芥菜浸提液处理下最高,与CK相比,10、20 g·L-1提液处理分别显著增加46.15%、32.51%,而40 g·L-1芥菜浸提液处理的活力指数则显著降低了82.66%。结果表明,豇豆种子平均发芽天数随着浸提液浓度升高而增加,而发芽势、发芽率、发芽指数、活力指数均随着浓度的升高而降低。

表1 不同浓度芥菜浸提液对豇豆种子发芽的影响Table 1 Effect of different concentrations of aqueous extract of mustard on germination of cowpea seeds
注:不同小写字母表示处理间差异显著(P<0.05)。下同。
Note: Different small letters mean significant difference among treatments at 0.05 level. The same as following.
由图1可知,与CK相比,10、20 g·L-1芥菜浸提液处理下胚根长分别显著增加了44.84%、34.04%,侧根数量分别显著增加了80.82%、55.97%,而40 g·L-1浓度处理下胚根长和侧根数量分别显著降低了36.15%和46.54%。豇豆种子胚根长、侧根数量均随着浸提液浓度的升高逐渐下降。
2.2 不同浓度芥菜浸提液对豇豆种子化感效应评价
由表2可知,10 g·L-1芥菜浸提液处理各指标的化感效应指数均大于0,表明10 g·L-1芥菜浸提液处理对豇豆种子化感效应均为促进效应,故综合效应也表现为促进,其中侧根数量化感效应指数最高,为0.45。20 g·L-1芥菜浸提液处理发芽率、发芽指数化感效应小于0,分别为-0.02和-0.01,其他指标的化感效应指数均大于0,综合效应值也大于0,总体上对豇豆种子化感效应为促进效应。40 g·L-1芥菜浸提液处理各指标的化感效应指数均小于0,表明40 g·L-1芥菜浸提液处理对豇豆种子化感效应均为抑制效应,其中发芽率化感效应抑制作用最强,为-0.86。
2.3 不同浓度芥菜浸提液对连作豇豆幼苗的影响
由表3可知,与CK相比,10、20、40 g·L-1芥菜浸提液处理壮苗指数分别显著增加50.82%、47.54%和40.98%。在10 g·L-1芥菜浸提液处理下,连作豇豆幼苗的株高、茎粗分别较CK显著增加了60.33%、12.24%,而其他处理与CK均无显著差异。10 g·L-1芥菜浸提液处理的鲜重、干重最高,与CK相比,分别显著增加85.87%、77.31%。与CK相比,20 g·L-1芥菜浸提液处理鲜重、干重均显著增加,40 g·L-1芥菜浸提液处理鲜重、干重均高于CK,但与CK间无显著差异。随着芥菜浸提液浓度的升高,豇豆幼苗鲜重、干重逐渐降低。连作豇豆叶片的相对叶绿素含量随着芥菜浸提液浓度的升高而降低,但均显著高于CK,分别增加了26.77%、19.98%和16.66%。

图1 不同浓度芥菜浸提液对豇豆种子胚根生长的影响Fig.1 Effect of different concentrations of aqueous extract of mustard on the growth of the endoderm of cowpea seeds
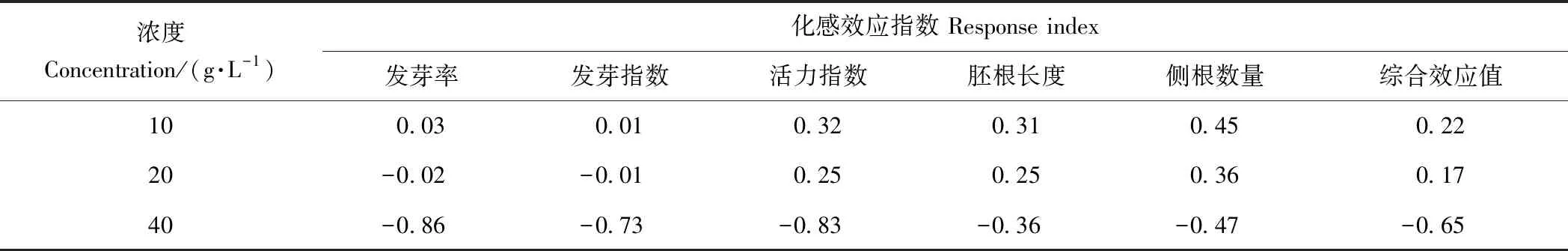
表2 不同浓度芥菜浸提液对豇豆化感效应指数及其综合效应值Table 2 Effect of different concentrations of aqueous extract of mustard on germination of cowpea seeds

表3 不同浓度芥菜浸提液对连作豇豆幼苗生长指标的影响Table 3 Effect of different concentrations of aqueous extract of mustard on growth index of cowpea seedling
2.4 不同浓度芥菜浸提液对连作豇豆幼苗根系形态指标的影响
由图2可知,不同浓度芥菜浸提液处理下,连作豇豆幼苗的根长度、根系表面积、根体积均有所提高。与CK相比,10 g·L-1芥菜浸提液处理的根长度、根系表面积、根尖数、根体积分别显著增加了59.67%、70.37%、26.65%和82.87%;20 g·L-1芥菜浸提液处理除根尖数外,其根长度、根系表面积、根体积分别显著增加了68.94%、74.47%和80.56%。而40 g·L-1芥菜浸提液处理的根长度、根系表面积、根尖数和根体积与CK间均无显著差异。
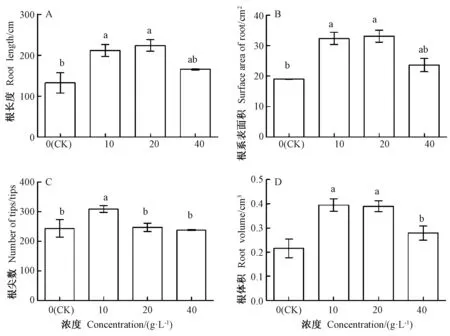
图2 不同浓度芥菜浸提液对连作豇豆幼苗根系形态指标的影响Fig.2 Effect of different concentrations of aqueous extract of mustard on root shape indexes of cowpea seedlings

图3 不同浓度芥菜浸提液对连作豇豆幼苗过氧化氢含量和抗氧化酶活性的影响Fig.3 Effect of different concentrations of aqueous extract of mustard on the content of hydrogen peroxide and antioxidant activity of the cowpea seedling
2.5 不同浓度芥菜浸提液对连作豇豆幼苗过氧化氢含量和抗氧化酶活性的影响
10 g·L-1芥菜浸提液处理的H2O2含量最高,随着芥菜浸提液浓度的升高H2O2含量逐渐下降,且均高于CK。与CK相比,10、20 g·L-1芥菜浸提液处理的H2O2含量分别显著增加60.87%、30.43%,而40 g·L-1芥菜浸提液处理与CK间无显著差异(图3-A)。10 g·L-1芥菜浸提液处理的连作豇豆幼苗叶片SOD活性最高,较CK显著增加5.33%,而其他处理均显著低于CK(图3-B)。10 g·L-1芥菜浸提液处理的连作豇豆幼苗叶片CAT活性最高,较CK显著增加10.29%;随着浸提液浓度升高,CAT活性逐渐下降,20 g·L-1芥菜浸提液处理与CK间无显著差异,而40 g·L-1芥菜浸提液处理显著低于CK(图3-C)。不同浓度芥菜浸提液处理的连作豇豆幼苗叶片POD活性分别较CK显著高10.08%、10.08%和23.64%(图3-D)。各浓度芥菜浸提液处理下连作豇豆幼苗叶片GR活性分别较CK显著高23.08%、128.21%、82.05%,其中20 g·L-1芥菜浸提液处理下最高(图3-E)。10 g·L-1芥菜浸提液处理下,连作豇豆幼苗叶片DHAR活性最高,较CK显著增加8.06%;随着芥菜浸提液浓度的升高,DHAR活性逐渐下降,其中40 g·L-1芥菜浸提液处理显著低于CK(图3-F)。
2.6 不同浓度芥菜浸提液对连作豇豆幼苗土壤pH值和电导率的影响
由图4-A可知,土壤pH值随着芥菜浸提液浓度增加而升高,分别较CK显著增加1.83%、3.47%和6.95%。由图4-B可知,与CK相比,10、40 g·L-1芥菜浸提液处理的土壤电导率分别显著降低17.28%、14.81%,20 g·L-1芥菜浸提液处理的土壤电导率高于CK,但差异不显著。
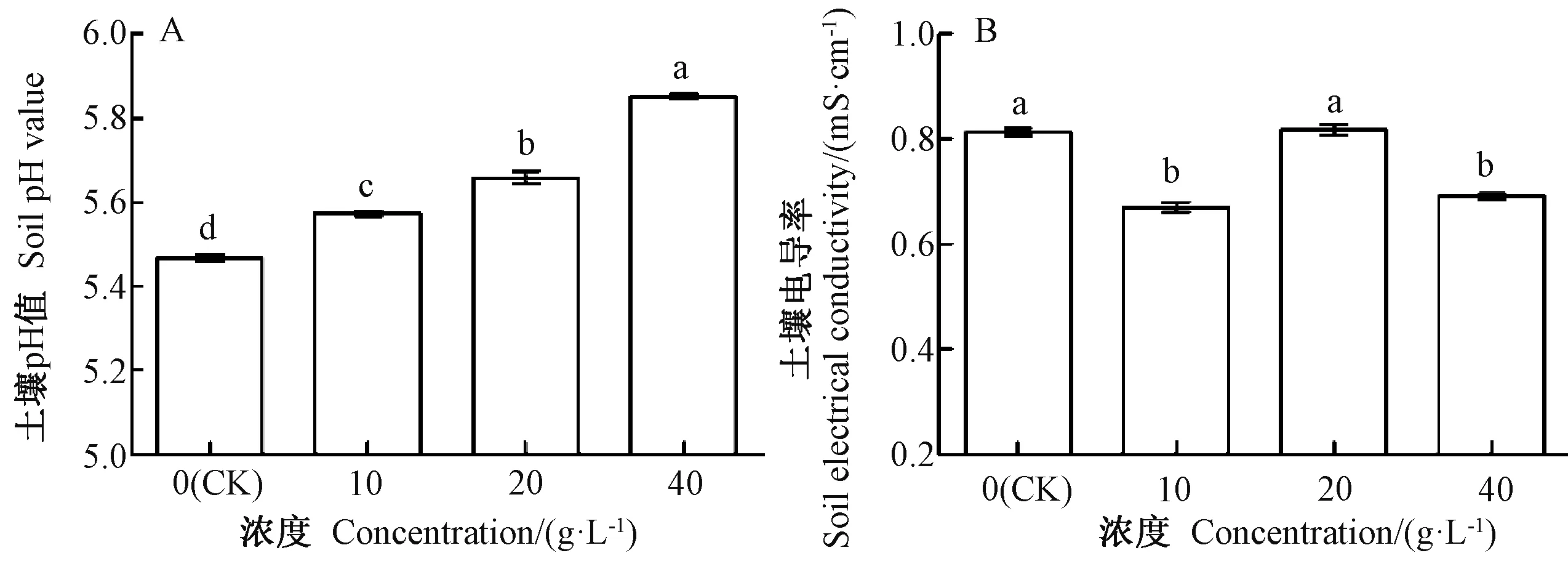
图4 不同浓度芥菜浸提液对连作豇豆幼苗土壤pH值和电导率的影响Fig.4 Effect of different concentrations of aqueous extract of mustard on the soil pH value and conductivity of cowpea seedling soil
2.7 不同浓度芥菜浸提液对连作豇豆幼苗土壤酶活性的影响
由图5-A可知,不同浓度芥菜浸提液处理的连作豇豆土壤脲酶活性均高于CK,其中10、40 g·L-1芥菜浸提液处理分别较CK显著提高26.92%、33.33%。由图5-C可知,与CK相比,各处理土壤多酚氧化酶活性均显著升高,其中20 g·L-1芥菜浸提液处理的多酚氧化酶活性最高。由图5-B、D可知,40 g·L-1芥菜浸提液处理的蔗糖酶和酸性磷酸酶活性均最高,随着芥菜浸提液浓度的增加,蔗糖酶和酸性磷酸酶均呈升高的趋势,且与CK差异显著。
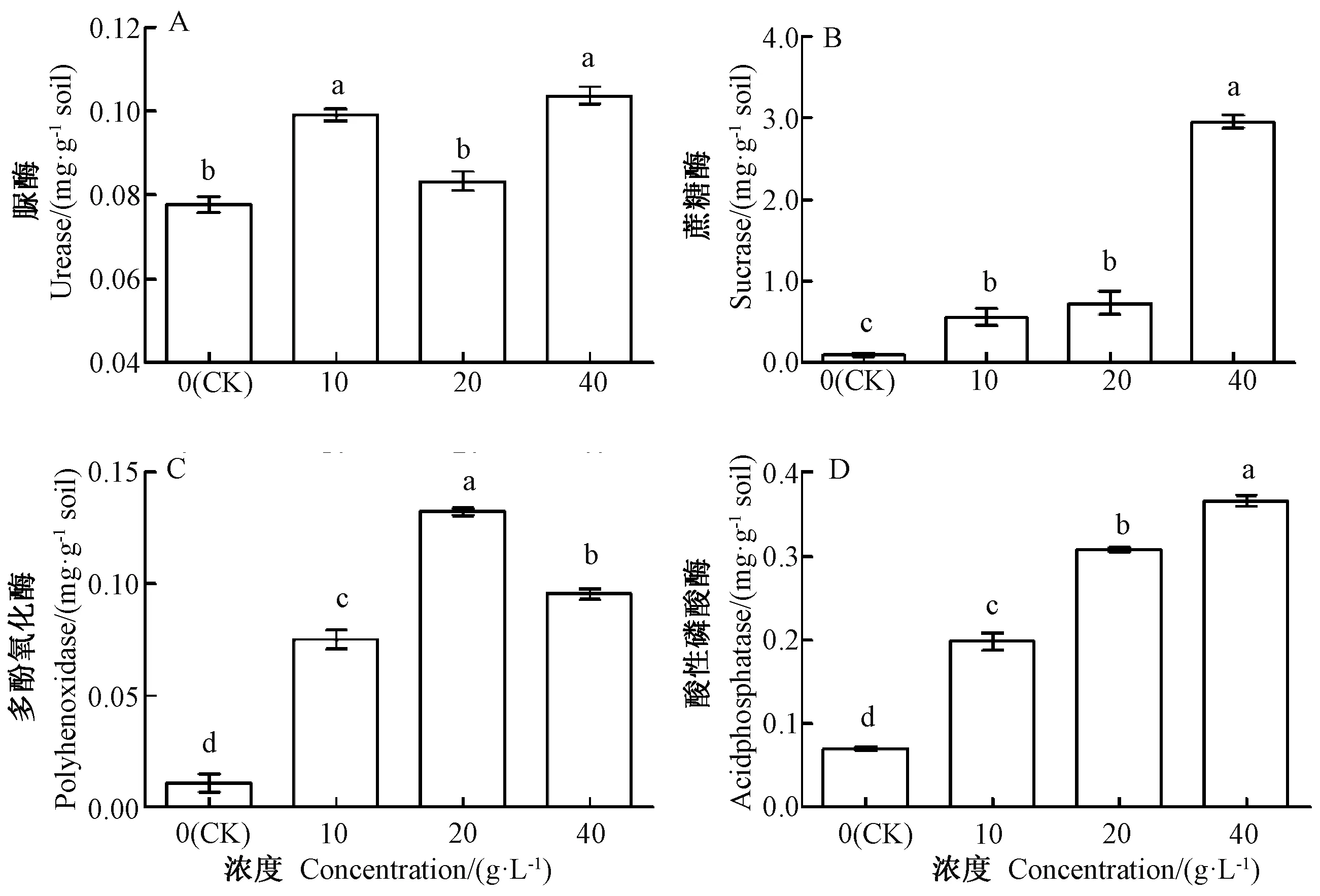
图5 不同浓度芥菜水浸提液对连作豇豆土壤酶活性的影响Fig.5 Effect of different concentrations of aqueous extract of mustard on rhizosphere soil enzymes activities in continuous cropping soil of cowpea
3 讨论
3.1 不同浓度芥菜浸提液对豇豆种子发芽和连作豇豆幼苗生长的影响
植物化感作用对受体的抑制可以通过种子萌发率来表达[20]。研究表明,浸提物或腐解液对植物种子发芽起着“低浓度促进,高浓度抑制”的作用[21-22]。这与本研究结果相同。本研究中,低浓度(10、20 g·L-1)芥菜浸提液降低了豇豆的发芽势,但并未影响发芽率,综合化感效应表现为促进作用;而高浓度(40 g·L-1)芥菜浸提液降低了豇豆的发芽势和发芽率,综合化感效应表现为抑制作用。究其原因,可能是低浓度浸提液影响了种子发芽时吸水膨胀的能力,延长了吸水膨胀所需时间,但对种子内部生理生化过程并未产生显著影响;而高浓度浸提液中渗透势和化感物质含量均较高,不仅影响种子发芽时吸水膨胀的能力,而且抑制种子萌发所需关键酶的活性。植物残体腐解产生的化感作用主要由酚酸引起[23],而大部分酚酸类物质均可抑制淀粉酶活性[24],淀粉酶参与并影响种子的萌发过程[25],所以淀粉酶受到抑制,种子发芽率降低。种子胚根长和侧根数量是反映种苗质量的重要指标。本试验结果表明,不同浓度芥菜浸提液对豇豆种子胚根生长的影响表现出低促高抑的规律,这与红小豆根、茎水浸提液对小麦幼苗根长生长[26]和花椒叶浸提液对苜蓿种子根长生长[27]的研究结果类似。说明低浓度浸提液对豇豆种子胚根生长起到促进作用,随着浓度的升高化感作用变强,幼根对植物代谢产物或其他外部刺激的生理响应更为敏感[28],所以高浓度起到了抑制作用[10]。本试验所用的芥菜水浸提液浓度为10、20、40 g·L-1,而0~10 g·L-1之间对豇豆种子的发芽势和发芽率可能有促进作用,这还有待进一步研究。
生长指标和根系形态指标可以反映植株生长状况,是评价种苗质量的有效指标。红薯叶片浸提液对稗草根长、茎长和生物量等表现出不同程度的促进作用[29]。这与本研究结果相似。本研究中,各浓度芥菜浸提液均能提高连作豇豆幼苗根系形态指标,对株高、茎粗、生物量、壮苗指数等生长指标也有促进作用,其中以10 g·L-1浓度效果最佳。植物叶绿素含量与光合作用密切相关,SPAD与叶片叶绿素含量呈正相关关系,因此,SPAD值直接影响叶片光合速率,其值越高,越有利于植物吸收更多光能进行光合作用[30]。研究发现大蒜根系浸提液浇灌西瓜连作土壤有助于提高光合色素含量,维持光能合理分配,从而提高光合能力[31]。本研究结果表明,各浓度芥菜浸提液均能显著提高连作豇豆幼苗叶片SPAD值,增强豇豆幼苗光合能力,有利于光合产物的积累。浸提液含有的化感物质可能通过促进豇豆幼苗根长生长,根尖数目增多,根系变大,导致根系吸水、吸肥能力增强,对养分进行有效利用;加之豇豆幼苗SPAD值升高,有利于增强光合作用,增加有机物质积累,进而直接影响生长发育,最终豇豆幼苗生长指标均不同程度地提高,有利于减轻连作对豇豆幼苗的危害。
3.2 不同浓度芥菜浸提液对连作豇豆幼苗生理指标的影响
H2O2可以通过多条诱导途径在植物细胞内产生和积累,其中包括激素等信号以及生物、非生物胁迫刺激等途径[32]。生物化学和遗传学研究证实,H2O2是植物逆境胁迫中的一种信号分子[33],可以调节植物对非生物和生物胁迫的反应,其转导作用已被越来越多的研究证实[34-35]。本研究表明,与对照相比,各浓度芥菜浸提液处理均可诱导豇豆幼苗体内H2O2含量升高,并随着浸提液浓度升高,H2O2含量逐渐下降。贾俊英[36]用西芹种子浸提液对黄瓜进行灌根处理,前期黄瓜叶片H2O2的含量均高于对照,认为西芹种子浸提液中的化感物质可以提高黄瓜幼苗的抗病性,而活性氧的积累可以作为一种早期反应,可能会带动保护酶活性的激发、植保素的合成、细胞壁的加厚等一系列的抗病防病反应。这与本研究结果相同。在逆境连作胁迫下,H2O2作为一种信号分子响应逆境胁迫反应,可能触发保护酶活性系统,增强豇豆幼苗的抗逆性。酶促抗氧化系统中的SOD、CAT、GR和DHAR等抗氧化酶能清除植物体内的活性氧,从而保护植物以免受氧化危害[37],因此抗氧化酶是植物抗逆性保护机制的一个重要组成部分。研究发现用几种豆科牧草水浸提液处理多花黑麦草,通过化感作用均提高了多花黑麦草幼苗中POD活性[38]。本研究中,各处理豇豆叶片POD活性均显著高于对照,低浓度处理能提高SOD、CAT活性,而高浓度则降低SOD、CAT活性,各种酶活性对连作胁迫的响应存在差异,这可能与浸提液处理初期豇豆幼苗体内H2O2含量有关。研究表明,抗逆性强的植物体内GR活性通常较高[39]。魏国芹等[40]在H2S对低温胁迫下甜樱桃柱头和子房AsA-GSH循环的研究中认为,GR和DHAR活性的提高有利于增强甜樱桃柱头和子房的抗性,有助于缓解低温伤害。本研究表明,不同浓度浸提液处理连作豇豆幼苗均能提高GR活性,而DHAR活性只在高浓度处理下较低,说明浸提液处理能通过提高GR和DHAR活性,清除豇豆幼苗活性氧,增强豇豆幼苗对逆境胁迫的抗性。可能是浸提液的化感物质产生作用后,诱导豇豆体内H2O2含量短暂应激升高;H2O2是信号级联中的一分子,活性氧的积累作为一种早期反应,会促使豇豆叶片内的保护酶系统启动。而豇豆体内活性氧需要维持平衡,因此一些保护酶被激活,积极地做出系列响应,使得自由基含量保持在一个较低的水平,防止活性氧侵害植物细胞膜,最终提高豇豆幼苗的抗逆性,有利于减轻连作胁迫对豇豆幼苗产生的危害。
3.3 不同浓度芥菜浸提液对连作豇豆幼苗土壤指标的影响
土壤酶的来源主要包括植物根系分泌、微生物以及土壤动物和动植物残体的释放等[15]。土壤酶活性可以作为反映土壤肥力的重要指标,是土壤中的生物催化剂[41],主要包括脲酶、磷酸酶、多酚氧化酶和蔗糖酶等,这些酶都参与土壤有机质的分解转化[42]。本试验结果表明,各浸提液处理均能提高连作豇豆土壤脲酶、磷酸酶、多酚氧化酶和蔗糖酶。这与乔天长等[43]在玉米秸秆还田方面的研究结果类似。而刘苗苗[31]用大蒜根系浸提液浇灌连作西瓜发现,低浓度浸提液能显著提高土壤多酚氧化酶、过氧化氢酶和脲酶活性,而高浓度则相反,这可能是由于高浓度浸提液中化感物质过多,不同植物间化感作用与浓度之间存在一定差异。适宜的土壤pH值和较低的电导率更有利于蔬菜的生长发育[44]。本研究中,各浸提液处理均能不同程度地升高土壤pH值,使其更适合豇豆生长发育。10、40 g·L-1芥菜浸提液处理能显著降低连作豇豆根际土壤电导率,而20 g·L-1芥菜浸提液处理与CK间则无显著差异。梁晓兰等[45]研究发现花椒凋落物浸提液不同程度地提高了土壤pH值,且浸提液浓度越高,土壤pH值升高越快,这与本试验结果一致。通过芥菜浸提液处理,由豇豆根系分泌物介导的植物-土壤-微生物三者之间的根际相互关系,以及豇豆土壤理化性质均发生了改变[7],这可能是因为在芥菜浸提液浇灌连作土壤处理下,投入的有机碳源可以为土壤微生物的生长和繁殖提供碳和能源,土壤中的微生物数量越高,土壤酶活性越高,越有利于维持土壤养分的平衡,改善土壤理化性状[46-47]。
4 结论
本研究结果表明,不同浓度芥菜浸提液对豇豆种子萌发起着低促高抑的作用,芥菜与豇豆之间存在明显的化感作用。浸提液先通过短暂应激升高的H2O2含量,作为一个信号激活保护酶系统,提高抗氧化酶活性从而减轻氧自由基对连作幼苗的伤害,对豇豆幼苗起到保护作用;浸提液还能提高连作豇豆幼苗根系形态指标及生长指标,促进豇豆的生长发育。此外,浸提液内的化感物质通过土壤媒介提高土壤酶活性,维持土壤养分平衡,改善土壤理化性状,为豇豆提供了一个更合适的土壤环境,能有效减轻连作障碍带来的危害。各浓度芥菜浸提液均对豇豆连作胁迫有缓解效果,其中以10 g·L-1芥菜浸提液处理最好,可为今后缓解豇豆连作障碍以及生产实践提供指导。
