miRNA-32启动子区域相互作用蛋白的分析*
2019-05-30吴巍芸
吴巍芸
(广东医科大学附属医院消化内科,广东湛江 524001)
大肠癌是消化系统主要的恶性肿瘤之一。微RNA(miRNA)是一类长18~25 nt 的非编码小分子RNA,广泛参与了生物体多种生理病理过程,如个体发育,细胞增殖、凋亡和分化,代谢与应激反应的调节,肿瘤形成等,在疾病的诊断、治疗、预测预后及药物疗效方面均具有巨大的潜力[1-2]。作者前期研究显示,miRNA-32 在大肠癌组织表达较正常组织显著上调,且与大肠癌淋巴结转移及远处转移相关;生存曲线分析显示,miRNA-32表达增高的患者预后较 miRNA-32 表达不增高的患者差[3-4]。体外研究发现,miRNA-32 过表达可以通过抑制靶基因第 10号染色体缺失的磷酸酶和张力蛋白同源物基因(phosphatase and tension homologue deleted on chromosome ten,PTEN)增强大肠癌细胞的增殖,减少凋亡,促进大肠癌细胞的迁移和侵袭等,参与大肠癌发生、发展过程[3-4]。但miRNA-32在大肠癌中的上调机制尚未清楚。本实验通过DNA pulldown 技术联合质谱鉴定的方法对 miRNA-32启动子区域相互作用蛋白进行分析,进一步用生物信息学方法对相互作用蛋白进行 GO富集分析及 KEGG 通路分析,旨在揭示可能与miRNA-32启动子存在相互作用的蛋白,以期为进一步研究miRNA-32表达调控的机制提供重要的信息。
1 材料与方法
1.1材料
1.1.1细胞株 人大肠癌细胞株HCT-116购自中国科学院细胞库。
1.1.2主要试剂 高纯度质粒小体中量试剂盒、Universal DNA纯化回收试剂盒购自天根生化科技有限公司;高保真Prime STAR DNA聚合酶试剂盒、DNA标记物购自Takara公司;快速银染试剂盒购自碧云天生物技术有限公司;Dynabeads®M-280链霉亲和素购自Thermo公司;聚合酶链反应(PCR)引物由上海生工生物工程公司合成。
1.2方法
1.2.1DNA pulldown 蛋白结合探针制备 PCR扩增miRNA-32所在的宿主基因TMEm245转录起始上游-1 987~-1 bp片段。上游引物:5′-CAG CCT GTT CAA CAT GGT GAA-3′,下游引物:5′- GTA ATG GGA GTC GGG CTA GAA AC -3′ 。并在上游引物 5′用生物素标记。PCR反应条件:94 ℃预变性5 min;循环参数分别为94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,共35个循环;72 ℃充分延伸10 min,1.5%琼脂糖凝胶电泳检测扩增情况。Universal DNA 纯化回收试剂盒纯化、回收扩增的目的片段并测序鉴定。
1.2.2DNA pulldown实验 HCT-116细胞于含10%胎牛血清的RPMI 1640培养基,37 ℃,5% CO2环境中常规培养,细胞生长状态良好时,RIPA裂解液裂解细胞,提取细胞蛋白。m280链霉素亲和磁珠与上述生物素标记的DNA探针冰上孵育4 h结合(实验组),以无生物素标记的DNA探针-磁珠为阴性对照组。再往磁珠-DNA混合物中加入细胞裂解液(约含蛋白1 mg),4 ℃孵育过夜。清洗缓冲液清洗磁珠-DNA探针-蛋白复合物,进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白条带并银染。
1.2.3质谱鉴定和分析 将电泳条带胰酶酶解成肽段,纯化肽段后用质谱仪 Thermo Scientific Q Exactive 分析。质谱原始文件经过MM File Conversion软件处理转换,得到MGF格式文件,然后用MASCOT检索uniprot数据库。质谱鉴定及分析送广州赛哲生物技术有限公司完成。
1.2.4差异表达蛋白GO、KEGG富集分析 对实验组和阴性对照组比较筛选出的差异表达蛋白进行GO、KEGG富集分析。GO 富集包括细胞组成(cellular component),分子功能(molecular function)及生物学过程(biological process)三方面内容。在生物体内,不同基因相互协调行使生物学功能,基于 KEGG 通路分析有助于更进一步了解基因生物学功能。GO富集与KEGG通路检验时,当P<0.05的GO功能条目及主要KEGG信号通路被认为是显著富集。
2 结 果
2.1DNA pulldown获取miRNA-32启动子区域相互作用蛋白 用生物素标记的DNA探针-磁珠复合物pulldown能与DNA 相互作用的蛋白。pulldown后的样品进行 SDS-PAGE分离,实验组与阴性对照组相比存在蛋白条带差异(input为阳性对照组),见图1。
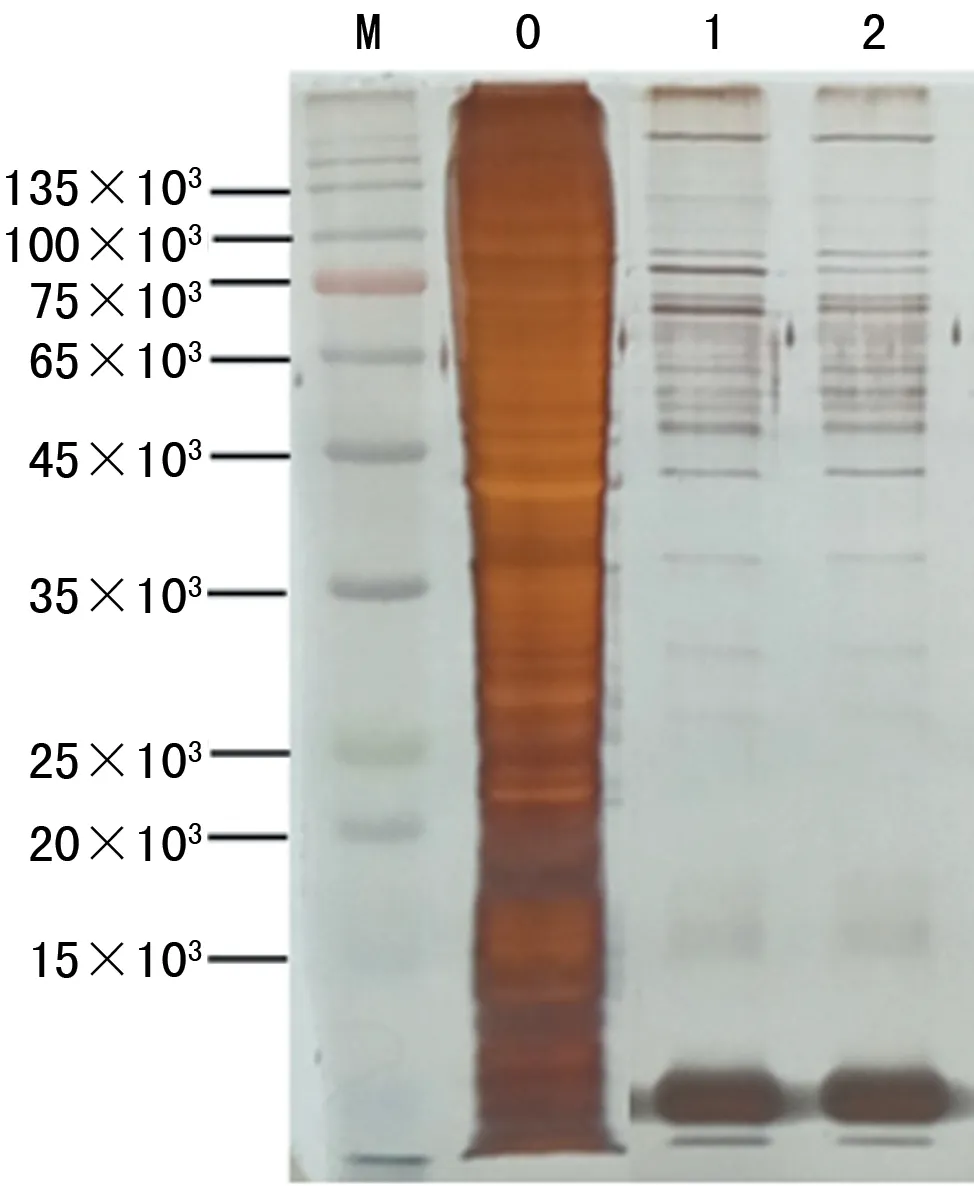
M:DNA标记物;1:input;2:生物素标记探针实验组;3:非生物素标记探针组(阴性对照组)
图1DNApulldown实验
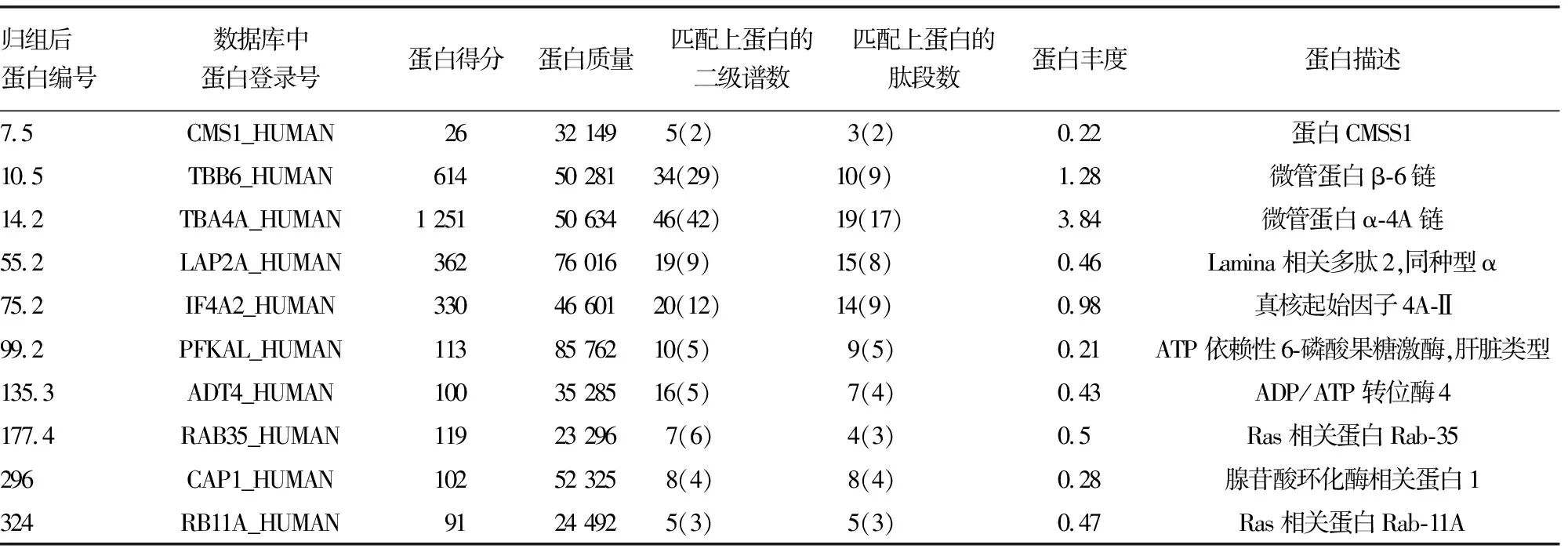
表1 质谱分析实验组与阴性对照组的差异蛋白
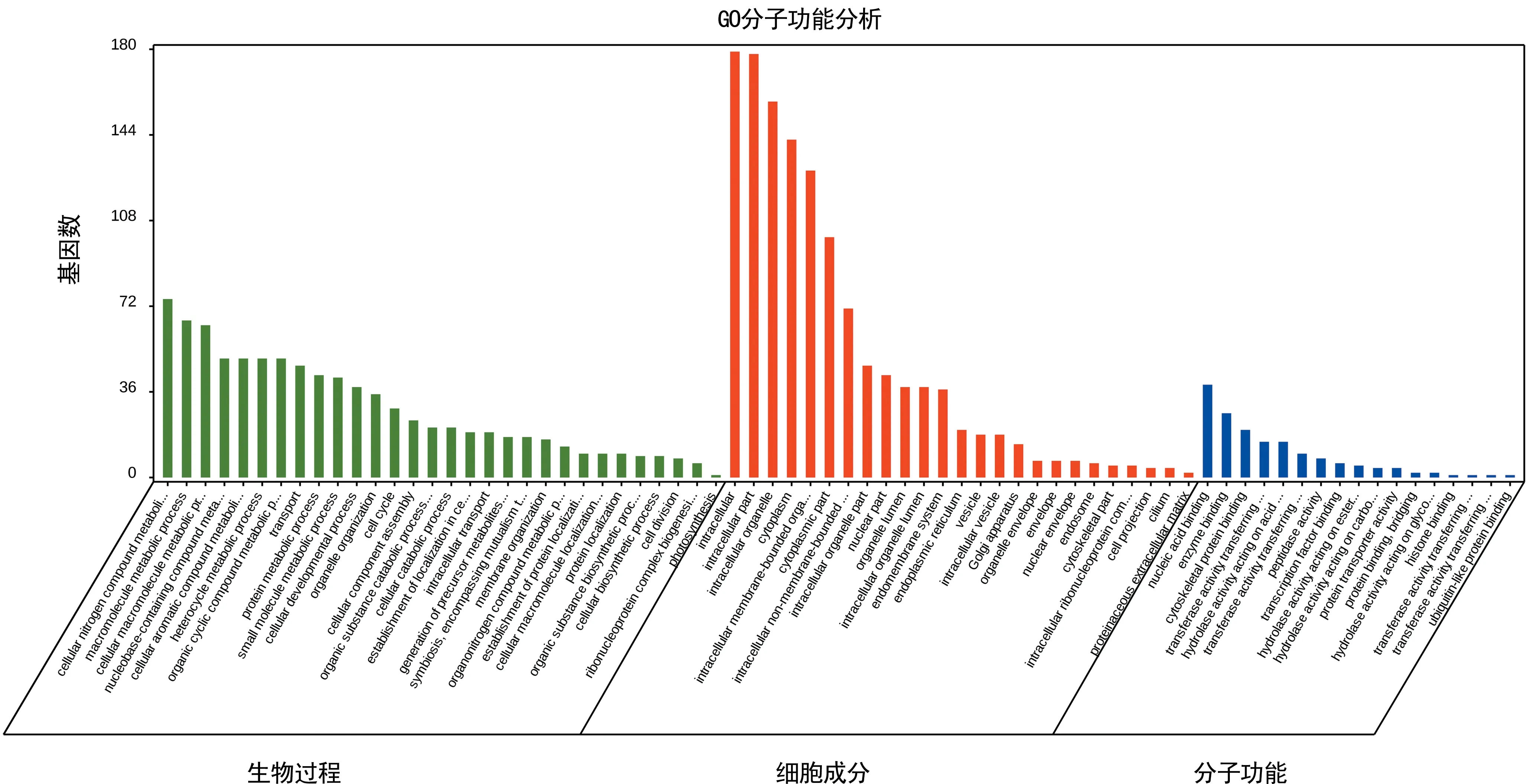
图2 差异蛋白的GO富集分析
2.2质谱鉴定及分析 将实验组及阴性对照组的电泳条带送质谱鉴定及分析。去除与阴性对照组重复及未能鉴定的蛋白,共筛出191个差异蛋白,部分蛋白见表1。差异蛋白认为是能和miRNA-32启动子区域相互作用的特异性蛋白。
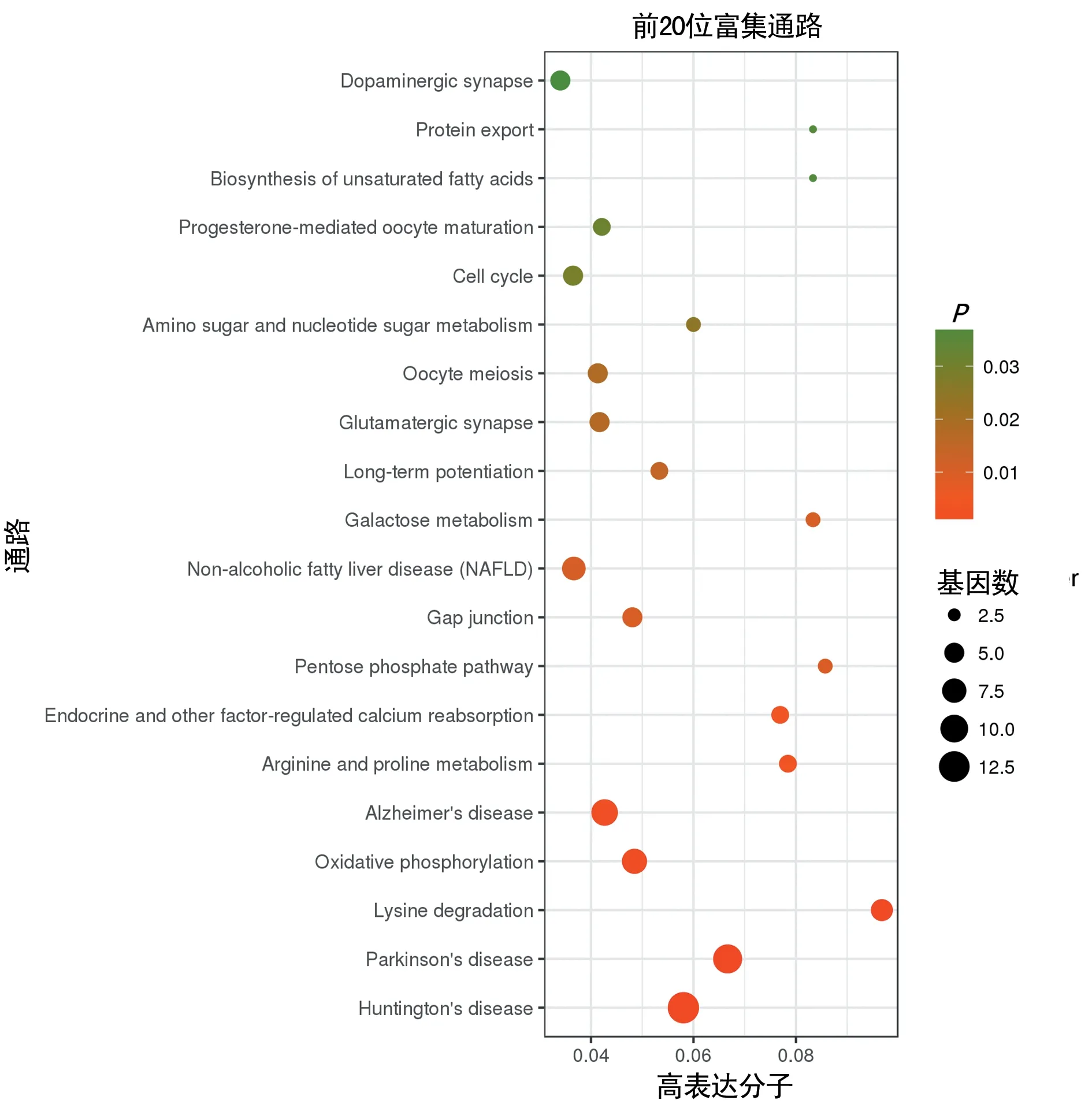
图3 差异蛋白的KEGG通路富集分析
2.3GO富集分析 通过GO富集分析注释各差异蛋白的分子功能和生物进程。从分子功能上看,大部分蛋白质为结合(binding)蛋白质和具有酶活性的蛋白质。结合蛋白质包括蛋白结合、细胞骨架蛋白结合、酶结合、离子结合、RNA 结合蛋白质。酶活性蛋白质包括具有催化活性、甲基转移酶活性、转移酶活性的蛋白质。从生物学过程来看,这些蛋白质多参与核酸代谢、基因转录,蛋白代谢、修饰,核质运输、细胞周期、细胞生长和再生等代谢过程,见图2。
2.4KEGG通路富集分析 KEGG 分析显示,各差异蛋白显著富集于氧化磷酸化、氨基酸代谢、间隙连接、细胞周期等信号通路,还参与MAPK信号通路、PI3K-Akt信号通路、Ras通路、Toll样受体信号通路等。以P<0.05为筛选条件时,这些差异蛋白共涉及24个显著富集的通路,前20位富集通路,见图3。
3 讨 论
许多研究显示,肿瘤中异常表达的miRNAs具有类似原癌基因或抑癌基因的功能,调控肿瘤细胞的增殖、分化和凋亡,在肿瘤发生、发展中发挥作用[5-6]。miRNAs在不同肿瘤中具有特定的表达模式。多个研究发现 miRNAs与大肠癌的发生、发展有关。PELLATT等[7]检测了1 894例大肠癌组织,并与人正常结肠组织进行比较,发现其中有12种miRNA表达水平有明显差异,包括 hsa-miRNA-663b、hsa-miRNA-4539、hsa-miRNA-17-5p等。与大肠腺瘤相比,大肠癌患者血清的miRNA-21明显升高,且在根治性手术后水平下降,组织和血清中miRNA-21的高表达与肿瘤大小、远处转移、预后显著相关,而且血清miRNA-21水平是大肠癌的一个独立预后因素[8]。miRNA-140通过下调Smad3,抑制大肠癌细胞的增殖、转移和侵袭能力[9]。作者前期研究发现,大肠癌中miRNA-32表达上调,且与靶基因PTEN结合,抑制其表达,参与大肠癌的发生、发展[3-4]。进一步探讨miRNA-32在大肠癌中上调的机制。miRNA的正确转录由复杂的调控系统调节,转录因子与启动子的相互作用是其重要的组成部分。外界环境的各种刺激或不同发育阶段的各种信号会促使不同的转录因子与转录调控元件结合,激活或抑制miRNAs的转录。因此,确定miRNAs上游启动子上的相互作用的蛋白并分析其功能对研究miRNAs的转录调控具有重要意义。JIANG等[10]研究发现,miRNA-378在人脂肪细胞中表达升高,通过荧光素酶报告基因检测发现miRNA-378的启动子区域在其上游-698 bp~-94 bp处,其中含有转录因子SREBP和C/EBP的结合位点,并通过EMSA实验证实,初次报道了脂肪因子和细胞因子可能通过与人脂肪细胞的miRNA-378启动子区域的SREBP和C/EBP结合位点结合,上调miRNA-378的表达。研究发现,心肌特异性表达的miRNA-1受到肌肉组织形成有关的转录因子SRF和MyoD的调节[11];YIN等[12]发现,在卵巢颗粒细胞中,类固醇因子-1(SF-1)能与miRNA-383的启动子区域结合,促进miRNA-383的表达。miRNA-32属于基因内miRNA,其宿主基因为跨膜蛋白245(transmembrane protein 245,TMEm245)。miRNA-32位于TMEm245的第14个内含子中。研究发现,内含子编码的miRNAs与它们的宿主基因共表达[13],且它们产生在内含子剪接之前,显示这些miRNAs和它的宿主基因mRNA来自于相同的转录本,所以调控这些miRNAs和它们相应的宿主基因表达应是相同的机制[14-15]。
本实验在Ensembl数据库中检索TMEm245转录起始点上游约2.0 kb长度的区域,采用DNA pulldown技术联合质谱分析的方法对启动子区域相互作用蛋白进行分析,进一步用生物信息学方法对相互作用蛋白进行GO富集分析及KEGG通路分析。结果显示,DNA pulldown和质谱分析总共鉴定到191个潜在的特异性与启动子区域相互结合的蛋白。GO功能富集分析结果显示,这些相互作用蛋白涉及多种生物学功能,包括参与核酸代谢、基因转录,蛋白代谢、修饰,核质运输、细胞周期、细胞生长和再生等代谢过程等。KEGG通路分析结果表明这些相互作用蛋白参与多条细胞内重要的信号通路,包括间隙连接、细胞周期信号通路、MAPK信号通路、PI3K-Akt信号通路、Ras通路、Toll样受体信号通路等。这些信号通路在调控细胞增殖、分化、凋亡、迁移、侵袭等重要生理和病理过程中发挥重要作用。这为进一步研究大肠癌中miRNA-32上调及大肠癌发生、发展的机制提供了重要的信息。这些信息的预测为下一步寻找有意义的调控miRNA-32表达的蛋白提供了线索,但由于生物信息学具有一定的局限性,还需进行进一步的分子生物学及功能的验证,这为下一步研究提供了可靠的研究策略。
