替勃龙联合唑来膦酸治疗绝经后骨质疏松症的临床疗效
2019-05-29王荣马江卫
王荣 马江卫
1陕西省榆林市第一医院内分泌科 719000;2陕西省榆林市第一医院骨一科 719000
绝经后骨质疏松症(postmenopausal osteoporosis, PMOP)属于原发性骨质疏松症,通常发生在女性绝经后5~10年内,主要是由于绝经后雌激素水平降低导致。其临床常表现为腰背疼痛,身高缩短、驼背,甚至发生脆性骨折。调查显示,女性一生发生骨质疏松性骨折的危险性高于乳腺癌、子宫内膜癌和卵巢癌的总和[1-2]。骨折导致患者致残率和死亡率增加。随着我国社会老龄化问题的日趋严重,PMOP将成为危害中老年女性健康和生活质量的主要疾病之一。本研究采用替勃龙联合唑来膦酸治疗PMOP,通过观察并比较治疗前、后患者临床症状改善情况、骨转换标志物(BTMs)的变化、骨密度的改善、性激素的变化以及药物不良反应,为临床PMOP的抗骨质疏松症药物联合治疗提供依据。
1 对象与方法
1.1 研究对象 选取2014年1月-2017年1月在陕西省榆林市第一医院就诊的PMOP患者120例,采用随机数字表法随机分为3组,替勃龙联合唑来膦酸治疗组(A组)、替勃龙治疗组(B组)及唑来膦酸治疗组(C组),每组40例。PMOP的诊断标准为自然绝经后女性且经双能X线吸收检测法测定中轴骨骨密度值降低≥2.5个标准差。纳入标准:(1)自然停经≥12个月,年龄45~60岁,所有患者均伴有不同程度绝经相关症状如潮热、多汗、睡眠障碍、情绪障碍等。(2)经双能X线吸收检测法检测腰椎1~4(L1~4)及右侧股骨颈骨密度值,至少一处测量T值低于-2.5。(3)治疗前6个月未使用性激素及抗骨质疏松症药物治疗。排除标准:(1)继发性骨质疏松症患者。(2)存在激素使用的禁忌证如确诊或怀疑雌激素依赖性恶性肿瘤、不明原因阴道出血及血栓性疾病等。(3)严重的器质性或精神性疾病、严重的肝肾功能不全、恶性肿瘤。(4)不能完成随访或认知功能障碍者。本研究已通过榆林市第一医院伦理委员会批准,所有研究对象均签署治疗知情同意书。
1.2 研究方法 所有PMOP患者均常规口服碳酸钙D3片600 mg qd及骨化三醇0.25 μg qd作为基础治疗。A组予以替勃龙联合唑来膦酸治疗,B组及C组分别予以替勃龙及唑来膦酸治疗。其中替勃龙2.5 mg qd,1年后减至维持量1.25 mg qd,总疗程2年,唑来膦酸5 mg静脉滴注,每次滴注时间>15 min,每年1次,总疗程2年。A组及C组均在静脉滴注唑来膦酸当日予以塞来昔布0.2 mg预防唑来膦酸药物不良反应。每6个月检测肝肾功能、行乳腺及妇科超声,每年行下肢静脉超声。
各组均于治疗第0、3、6、12、24个月进行视觉模拟评分(VAS)测定,纸面上10 cm横线,从0分无痛到10分剧痛,疼痛感逐级加深,从而评估患者治疗前、后临床症状缓解情况。于治疗第0、3、6、12、24个月采用ELISA法测定空腹状态下BTMs如Ⅰ型原胶原N-端前肽(P1NP)及血清Ⅰ型胶原羧基末端肽片段(β-CTX)。于治疗第0、12、24个月采用美国Hologic双能X线吸收检测机测定骨密度,L1~4及右侧股骨颈骨密度变异系数分别为1.25%和2.32%,所有骨密度测定均由同1名影像科医师完成。于治疗第0、6、12、24个月检测血清25羟维生素D(25OHD)、雌激素及卵泡刺激素(FSH)变化。治疗期间严密监测药物不良反应,评估药物安全性。

2 结果
2.1 3组患者基线资料比较 3组患者的年龄、体重指数、绝经时限等差异无统计学意义,见表1。
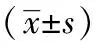
表1 3组患者基线资料比较
注:A组:替勃龙联合唑来膦酸治疗组;B组:替勃龙治疗组;C组:唑来膦酸治疗组
2.2 3组治疗前、后VAS比较 与治疗前相比,治疗后A组及C组腰背部及关节疼痛明显缓解,VAS明显降低(P均<0.05)。治疗后不同时间节点A组VAS均明显低于B组(P均<0.05),但与C组相比,差异无统计学意义,见表2。
2.3 3组治疗前、后BTMs比较 与治疗前相比,治疗第6、12、24个月3组P1NP、β-CTX及25OHD较治疗前均得到明显改善(P均<0.05);治疗第6、12、24个月A组P1NP、β-CTX降低优于其他两组(P均<0.05);且在治疗第3个月仅A组β-CTX水平降低(P均<0.05);与同组治疗后12个月相比,A组在治疗后24个月P1NP及β-CTX明显降低(P均<0.05),C组在治疗后24个月P1NP明显降低(P<0.05);与治疗前相比,治疗后6、12、24个月3组25OHD均明显升高(P均<0.05),组间比较差异无统计学意义,见表3。
2.4 3组治疗前、后骨密度变化比较 与治疗前相比,A组在治疗后12个月及24个月L1~4骨密度分别上升(5.82±1.80)%、(10.90±3.43)%;股骨颈骨密度分别上升(5.75±1.52)%、(12.03±4.64)%。B组在治疗后12个月及24个月L1~4骨密度分别上升(4.96±1.93)%、(6.32±2.28)%;股骨颈骨密度分别上升(4.11±1.61)%、(6.12±2.30)%。C组在治疗后12个月及24个月L1~4骨密度分别上升(4.66±1.62)%、(7.91±3.38)%;股骨颈骨密度分别上升(5.35±1.61)%、(9.17±3.30)%。治疗第12个月、24个月3组L1~4及右侧股骨颈骨密度值较治疗前均明显增加(P均<0.05);治疗第24个月A组L1~4及右侧股骨颈骨密度值增加优于其他两组(P均<0.05);与同组治疗12个月后相比,治疗后24个月A组L1~4及右侧股骨颈骨密度得到进一步提升(P均<0.05),见表4。
2.5 3组治疗前、后雌激素及FSH变化比较 A组及B组治疗后绝经相关症状得到明显缓解,FSH水平较治疗前明显降低(P<0.05)。C组FSH水平较治疗前无显著性变化。3组治疗后雌激素水平均有轻微降低,但与治疗前相比降幅无显著性差异,见表5。
2.6 3组药物不良反应监测 A组及C组使用唑来膦酸后短暂的类流感症状如一过性发热及肌肉关节疼痛发生率多于B组。A组应用替勃龙后胃肠道不良反应明显多于C组(P<0.05)。A组总体药物不良反应率高于B组及C组,但均为轻微且短暂的药物不良反应,见表6。
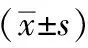
表2 3组治疗前、后VAS比较
注:与同期A组相比,aP<0.05;与同组治疗前相比,bP<0.05;VAS:视觉模拟评分;A组:替勃龙联合唑来膦酸治疗组;B组:替勃龙治疗组;C组:唑来膦酸治疗组
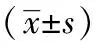
表3 3组治疗前、后骨转换标志物比较
注:与同期A组相比,aP<0.05;与同组治疗前相比,bP<0.05;与同组治疗后12个月相比,cP<0.05;A组:替勃龙联合唑来膦酸治疗组;B组:替勃龙治疗组;C组:唑来膦酸治疗组;P1NP:血清Ⅰ型原胶原N-端前肽;β-CTX:Ⅰ型胶原羧基末端肽片段;25OHD:25羟维生素D
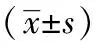
表4 3组治疗前、后骨密度变化比较
注:与同期A组相比,aP<0.05;与同组治疗前相比,bP<0.05;与同组治疗后12个月相比,cP<0.05;A组:替勃龙联合唑来膦酸治疗组;B组:替勃龙治疗组;C组:唑来膦酸治疗组;L:腰椎
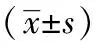
表5 3组治疗前、后雌激素及FSH变化比较
注:与同期A组相比,aP<0.05;与同组治疗前相比,bP<0.05;A组:替勃龙联合唑来膦酸治疗组;B组:替勃龙治疗组;C组:唑来膦酸治疗组;FSH:卵泡刺激素;绝经后女性激素正常参考值范围:雌激素(18.4~505.0 pmol/L);FSH(25.8~134.8 IU/L)
注:与A组相比,aP<0.05;A组:替勃龙联合唑来膦酸治疗组;B组:替勃龙治疗组;C组:唑来膦酸治疗组
3 讨论
PMOP主要是由于雌激素水平急剧降低导致。雌激素与雌激素受体结合后,直接发挥对破骨细胞及成骨细胞的代谢调节作用,同时雌激素也可通过调节免疫细胞及细胞因子等发挥间接的骨代谢调节作用[3-4]。早有研究证实,破骨细胞为雌激素作用的直接靶点[5]。雌激素与其受体结合后,阻碍细胞核因子-κB受体活化因子(RANK)配体/巨噬细胞集落刺激因子诱导蛋白-1 依赖性的活化剂的转录,抑制RANK诱导的破骨细胞分化,从而发挥促进破骨细胞凋亡、抑制破骨细胞分化等作用[6-7]。同时雌激素通过改变转录因子的活性,抑制成骨细胞凋亡,增加成骨细胞存活时间及其活性[8-9],或者抑制氧化应激反应,降低核因子-κB活性,促进骨的生成[10]。绝经后雌激素水平急剧降低,雌激素对破骨细胞的抑制作用减弱,导致骨吸收作用增强,绝经后虽然成骨细胞介导的骨形成亦有增加,但不足以代偿过度的骨吸收,从而导致高转换型骨质疏松症的发生。其次,雌激素的减少可降低骨骼对力学刺激的敏感性,导致骨骼废用性丢失的发生[11]。20世纪80年代,临床就已经证实雌激素替代治疗能改善绝经后妇女的骨质疏松症[12]。近年来也有相继研究再次证实雌激素在PMOP中的临床应用价值[13-14]。
替勃龙是一种人工合成的具有组织选择性的雌激素活性调节剂,化学名称为7-甲基异炔诺酮,可显著抑制垂体FSH的释放,具有弱雌激素、孕激素作用,因此对子宫内膜的刺激作用小。替勃龙在体内主要与雌激素受体结合,发挥雌激素的促进骨形成和抑制骨吸收的生物学效应。一项针对替勃龙用于骨折长期干预的LIFT研究结果显示,替勃龙1.25 mg qd不仅可显著增加椎体及股骨颈的骨密度,还可降低近50%的椎体骨折风险[15]。本研究观察到,使用替勃龙治疗后,患者绝经相关症状得到明显缓解,同时BTMs及骨密度均得到改善。
唑来膦酸是目前最高效的第3代双膦酸类药物,通过抑制破骨细胞的功能,降低骨转化率,从而加骨质疏松症患者腰椎和髋部骨密度,降低发生椎体、非椎体和髋部骨折的风险,并提高患者骨密度[16-17]。临床常用的双膦酸盐制剂包括口服阿仑膦酸钠及静脉滴注唑来膦酸等。其中唑来膦酸以其较少的胃肠道不良反应及每年一次静脉滴注的给药方式到临床推广应用。
本研究结果显示,与治疗前相比,A组与C组在治疗后临床疼痛症状能有效缓解,VAS明显降低,A组临床症状缓解率优于B组,但与C组相比无显著性差异。唑来膦酸静脉滴注当日曾予以塞来昔布0.2 mg治疗1次,随后3个月才进行VAS,而塞来昔布有效半衰期为11 h,故可完全排除非甾体解热镇痛药物对VAS的影响。采用P1NP及β-CTX分别代表骨形成及骨吸收指标,结果显示与治疗前相比,治疗后第6、12、24个月3组P1NP及β-CTX较治疗前均得到明显改善;治疗第6、12、24个月A组的P1NP、β-CTX水平降低优于其他两组;与同组治疗后12个月相比,替勃龙联合唑来膦酸治疗后24个月P1NP及β-CTX明显降低,C组在治疗后24个月P1NP明显降低(P<0.05);且笔者发现在治疗第3个月仅A组能显著改善PMOP患者β-CTX水平。赵光等[18]研究也显示,替勃龙2.5 mg qd治疗PMOP后3个月Ⅰ型胶原交联 C 端肽也未见明显降低,至治疗后6个月Ⅰ型胶原交联C端肽才出现明显降低。苏凡等[19]研究显示,替勃龙2.5 mg qd治疗后1年,血清β-CTX水平明显降低,但阿仑膦酸钠治疗组血清β-CTX降低幅度优于替勃龙单药治疗组。推测A组优先出现治疗后β-CTX水平降低的原因可能是由于唑来膦酸与替勃龙均属于骨吸收抑制剂,显著抑制破骨细胞活性,药物联合应用增强疗效,故在治疗早期β-CTX水平即出现明显降低。与治疗前相比,治疗后3组25OHD水平均明显升高,考虑与长期接受骨化三醇治疗相关。3组治疗后骨密度均得到不同程度提升,替勃龙联合唑来膦酸治疗后24个月L1~4及股骨颈骨密度分别上升(10.90±3.43)%及(12.03±4.64)%,骨密度增加明显优于其他两组;与治疗后12个月相比,替勃龙联合唑来膦酸治疗后24个月L1~4及右侧股骨颈骨密度得到进一步提升;但替勃龙与唑来膦酸治疗组相比,骨密度改善无显著性差异。已有研究发现,替勃龙2.5 mg qd治疗1年后L1~4及股骨颈骨密度得到明显改善[18-19]。张秀珍等[20]应用替勃龙1.25 mg qd治疗PMOP患者48周后,腰椎骨密度增幅为3.65%,但尚未有关于替勃龙联合唑来膦酸治疗PMOP患者2年的相关数据报道。POMP患者接受替勃龙治疗后显著缓解绝经相关症状,降低体内FSH水平,但使用替勃龙对患者体内雌激素水平的影响结论尚不统一。有研究显示,替勃龙能显著升高患者体内雌激素水平[20]。也有研究显示,替勃龙显著降低患者体内雌激素水平[19]。本研究观察到替勃龙治疗后PMOP患者雌激素水平轻微降低,考虑与年龄增长及FSH水平降低相关。药物不良反应监测提示,替勃龙联合唑来膦酸治疗组药物不良反应发生率高于其他2组,但3组药物不良反应均轻微,无严重的停药性不良反应事件发生。其中接受替勃龙治疗的3位患者曾发生一过性阴道出血,在排除子宫内膜病变且替勃龙减至1.25 mg qd后,未再发生阴道出血。观察及治疗期间,所有入组接受抗骨质疏松药物治疗的PMOP患者无一例脆性骨折发生。
同其他慢性疾病一样,骨质疏松症不仅需要长期、个体化的药物治疗,必要时可考虑药物联合或序贯治疗。所有抗骨质疏松药物治疗应至少1年,通常钙与维生素D制剂作为基础药物治疗,可与其他抗骨质疏松药物联用。虽然不建议联合相同作用机制的药物,但PMOP患者可考虑激素替代与双膦酸盐短期联合使用[21]。然而指南未对抗骨质疏松药物联合应用的疗程做具体要求。在绝经10年之内或60岁之前即激素治疗“窗口期”,予以激素补充治疗将会对骨骼、心血管和神经系统产生长期保护作用[22]。因此可对有绝经相关症状的45~60岁PMOP患者予以替勃龙联合唑来膦酸治疗,由于多数患者停用替勃龙治疗后绝经相关症状复发,且经临床严密观察无严重的药物不良反应事件发生,考虑患者接受替勃龙与唑来膦酸治疗后受益远大于联合用药风险,故药物联合治疗应坚持2年。研究结果显示,联合药物治疗不仅能显著提升PMOP患者骨密度,而且能有效缓解绝经期相关症状,与同组治疗后12个月及其他两组比较,替勃龙与唑来膦酸联合治疗后24个月,PMOP患者的BTMs及骨密度得到明显改善,且治疗期间无严重的药物不良反应事件发生。在随后研究中笔者将停止替勃龙治疗,继续唑来膦酸治疗1年,并持续观察PMOP患者BTMs及骨密度的变化,追踪患者有无脆性骨折的发生,为临床PMOP的抗骨质疏松药物联合治疗提供更多依据。
