海洋放线菌Streptomyces novaecaesareae次生代谢产物*
2019-05-27于鑫韦霞冯婵范倩王思玉章卫民张翠仙
于鑫,韦霞,冯婵,范倩,王思玉,章卫民,张翠仙
(1. 广州中医药大学中药学院,广东 广州 510006; 2. 华南应用微生物国家重点实验室∥广东省菌种保藏与应用重点实验室∥ 广东省微生物应用新技术公共实验室∥广东省微生物研究所,广东 广州 510070)
海洋放线菌由于其独特的生理和代谢功能成为海洋微生物活性天然产物的重要来源。海洋放线菌中链霉菌属研究最广泛,结构类型涉及生物碱、聚酮、萜类、甾体和卤代物聚醚等,生理活性涉及抗肿瘤、抗菌、抗疟及寄生虫等[1-7]。为了继续寻找新的克服肿瘤耐药活性次生代谢产物[8-10],本课题对分离自南海沉积物中的新凯撒链霉菌Streptomycesnovaecaesareae次生代谢产物进行分离,共得到10个化合物,其结构依次为环(4-羟基-L-脯-D-苯丙)二肽(1)、环(4-羟基-L-脯-L-苯丙)二肽(2)、环(4-羟基-L-脯-D-脯)二肽(3)、环(4-羟基-L-脯-L-亮)二肽(4)、环(L-脯-L苯丙)二肽(5)、环(L-亮-L-脯)二肽(6)、环(D-脯-L-亮)二肽(7)、环(8-羟基-L-脯-D-异亮)二肽(8)、N-(4-氧代戊基)-乙酰胺(9)和邻苯二甲酸二丁酯(10)(图1)。化合物1-9为叶立德类化合物,且1、3和7含有自然界中不常见的D构型氨基酸。所有化合物均首次从Streptomycesnovaecaesareae中分离得。
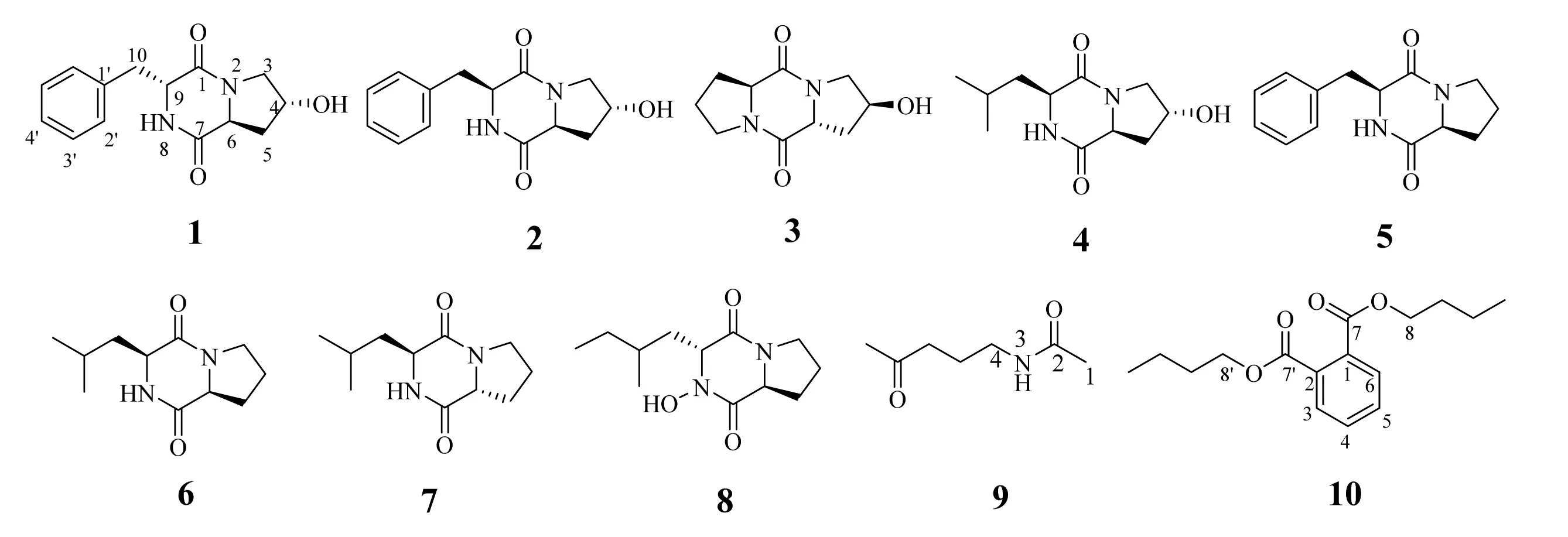
图1 来源于Streptomyces novaecaesareae化合物1-10Fig.1 Compounds1-10fromStreptomyces novaecaesareae
1 材料与方法
1.1 材料与仪器
1.1.1 菌株 放线菌Streptomycesnovaecaesareae由广东省微生物研究所馈赠,分离自中国南海北部(E 111°10.442′、N 18°52.730′)海底沉积物。菌种保存于广州中医药大学中药学院海洋天然药物实验室(编号:线-章-SS9)。
仪器:Bruker AVANCE III HD 400型核磁共振仪器(德国Bruker公司);AB SCIEX TripleTOFTM 5600+四极杆-飞行时间串联质谱(美国AB SCIEX公司);轨道阱高分辨液-质联用仪(美国Thermo Fisher公司);半制备高效液相色谱(HPLC)仪器(北京慧得易科技有限公司);MCP 200数字式旋光仪(奥地利AntonPaar公司)。LX-B75L型立式自动电热压力蒸汽灭菌锅(合肥华泰医疗设备有限公司);超净工作台(单人)(苏州净化设备厂);HYG-A全温摇瓶柜(太仓市试验设备厂);DZ-900振荡器(太仓市强乐试验设备厂);恒温水浴锅(巩义市予华仪器有限责任公司);WFH-201B紫外透射反射仪(上海精科实业有限公司);ER-120A电子分析天平(日本A&D公司)。
1.1.2 材料与试剂 色谱柱1:Luna (5 μm C18 100 Å,4.6 mm×100 mm(美国Phenomenex公司)、色谱柱2:Kromasil 100-5-C18 5 μm,10 mm×250 mm(瑞典AKZO NOBEL公司)和色谱柱3:YMC-Pack ODS-A/S 5 μm/12 nm,250 mm×10.0 mm(日本YMC公司);Sephadex LH-20 葡聚糖凝胶(GE医疗集团);ODS-A-HG填料(50 μm、日本YMC公司);Amberlite ( XAD-7树脂(20~60目,美国Sigma公司);乙醇、甲醇、乙酸乙酯、氯仿和正丁醇(AR,天津市富宇精细化工有限公司);甲醇和乙腈(色谱纯,康科德公司);酵母膏和蛋白胨(BR,广东环凯微生物科技有限公司),琼脂粉(AR,广东环凯微生物科技有限公司);可溶性淀粉(AR,天津市大茂化学试剂厂);速溶海水结晶海盐(佛山市海富生物科技有限公司);TLC预制板和硅胶(200~300目,青岛海洋化工厂)。
1.1.3 A1培养基(1 L) 可溶性淀粉w=1%,酵母浸膏w=0.4%,蛋白胨w=0.2%,海盐w=2.48%,121 ℃灭菌25 min,冷却后备用。
1.2 微生物的发酵培养
1.2.1 菌种活化 放线菌Streptomycesnovaecaesareae种子活化培养基采用A1培养基。将适量纯化菌种接种于培养瓶(30 mL A1/100 mL),置于摇床上培养24 h(28 ℃、165 r/min)。
1.2.2 规模发酵 按一定接种量(2%/L培养基)接种于培养瓶中(1 L A1培养基/3 L培养瓶),摇瓶培养7 d(28 ℃、165 r/min)。共发酵培养36 L。
1.3 微生物的提取与分离
生长7 d后的微生物加入XAD-7树脂(4 g/L),继续振摇3~4 h后纱布过滤,分别得到菌体(含XAD-7树脂)和发酵液。
1.3.1 菌体部分 将菌体部分(XAD-7树脂)加丙酮振摇1 h/次(1 L丙酮/次,3次),纱布过滤得丙酮液。丙酮液减压浓缩至无丙酮味,加水成水悬液,等体积EtOAc萃取3次,萃取液减压浓缩得菌体EtOAc相(5.0 g)。
1.3.2 发酵液部分 菌液恒温水浴锅浓缩至6 L,等体积EtOAc萃取3~5次,EtOAc相合并减压浓缩得菌液EtOAc提取物(3.0 g)。
菌体EtOAc相(5.0 g)采用Sephadex LH-20凝胶柱层析(柱长:1 m,直经:4 cm)纯甲醇洗脱,运用TLC薄层色谱进行合并,共得7个流份Fr1-7。Fr2(2.24 g)经过ODS层析柱(50 μm/12 nm),采用甲醇水(甲醇∶水=56∶44~100∶0,V/V)梯度洗脱,经过TLC追踪合并为8个子流份Fr2-1-Fr2-8。Fr2-1(580 mg)经半制备HPLC(色谱柱3, 0~40 min,乙腈∶水=20∶80~100∶0,V/V, 流速1 mL/min)梯度洗脱,分离纯化得Fr2-1-1- Fr2-1-19。Fr2-1-15(tR=28.2 min, 28 mg)为化合物6、Fr2-1-17(tR=29.8 min, 14 mg)为化合物5。Fr2-1-4(29 mg)再次经半制备HPLC纯化(色谱柱2, 0~25 min, 甲醇∶水=20∶80~70∶30,V/V, 流速1 mL/min)梯度洗脱,得到化合物9(tR=22 min, 4.5 mg)。Fr2-1-9(44 mg)经HPLC(色谱柱2, 甲醇∶水=40∶60,V/V, 流速1 mL/min)等度洗脱,纯化得到化合物4(tR=36 min, 27 mg)和1(tR=38 min, 3.2 mg)。Fr2-1-11(28 mg) 经半制备HPLC(色谱柱2, 甲醇∶水=44∶56,V/V, 流速1 mL/min)等度洗脱,纯化得到化合物2(tR=29 min, 5 mg)。Fr2-1-13(23 mg)经半制备HPLC(色谱柱2, 甲醇∶水=33∶67,V/V,流速1 mL/min)等度洗脱,得到Fr2-1-13-3(9 mg),再纯化得到(色谱柱2, 乙腈∶水=31∶69,V/V, 流速1 mL/min)得到化合物7(tR=17.9 min, 3.2 mg)和8(tR=19 min, 2.3 mg)。Fr2-1-2(145 mg)经半制备HPLC纯化(色谱柱2, 甲醇∶水=23∶77,V/V,流速1 mL/min)等度洗脱,得到化合物3(tR=17 min, 3 mg)。对Fr2-8(545 mg)经半制备HPLC(色谱柱2, 乙腈∶水=80∶20,V/V, 流速1 mL/min)等度洗脱,纯化得到化合物10(tR=48.8 min, 4 mg)。
1.4 物理常数与波谱数据
化合物1:淡黄色固体(甲醇),[α]20D+41.17° (c=0.08, MeOH), ESI-MS:m/z261[M+H]+, 分子式为C14H16N2O3;1H NMR (400 MHz, CD3OD)δH: 4.21 (2H, brs, H-4/6), 7.19 (2H, m, H-2′), 7.29 (3H, m, H-3′, H-4′), 3.18 (1H, dd,J=13.6, 5.2 Hz, H-10a), 2.99 (1H, dd,J=13.6, 4.4 Hz, H-10b), 2.22(1H, m, H-5a), 1.89(1H, m, H-5b), 3.59 (1H, m, H-3a)、3.27~3.24 (1H, m, H-3b);13C NMR (100 MHz, CD3OD)δC: 167.7 (C-1), 54.0(C-3), 68.5(C-4), 38.0(C-5), 59.6(C-6), 171.0(C-7), 57.2(C-9), 40.9(C-10), 136.8(C-1′), 129.7(C-2′), 131.2(C-3′), 128.5(C-4′)。
化合物2:淡黄色固体(甲醇),[α]20D-78.90° (c=0.1, MeOH), ESI-MS:m/z261[M+H]+, 分子式为C14H16N2O3;1H NMR(400 MHz, CD3OD)δH: 4.48(1H, brt,J=4.4 Hz, H-9), 4.36 (1H, dd,J=11.6, 5.6 Hz, H-6), 2.06 (1H, dd,J=12.8, 6.0 Hz, H-5a), 1.34 (1H, dt,J=12.8, 4.8 Hz, H-5b), 4.27(1H, t,J=5.2 Hz, H-4), 3.70 (1H, dd,J=13.2, 4.8 Hz, H-3a), 3.30(1H, m, H-3b), 3.17 (2H, m, H-10), 7.21~7.29(5H, m, H-2′, H-3′, H-4′);13C NMR(100 MHz, CD3OD)δC: 167.1 (C-1), 55.2(C-3), 68.5(C-4), 38.0(C-5), 58.3(C-6), 171.2(C-7), 57.6(C-9), 38.8(C-10), 137.4(C-1′), 129.5(C-2′), 131.0(C-3′), 128.1(C-4′)。
化合物3:白色无定形固体(甲醇),[α]20D-24.22° (c=0.06, H2O), ESI-MS:m/z249[M+ K]+,分子式为C10H14N2O3;1H NMR(400 MHz, CD3OD)δH: 4.49(1H, t,J=4.0 Hz, H-9), 4.61(1H, dd,J=11.2, 5.6 Hz, H-6), 4.39(1H, brt,J=6.8 Hz, H-4), 3.63(1H, dd,J=12.8, 3.2 Hz, H-3a), 3.45(1H, d,J=12.8, Hz, H-3b), 3.51(2H, m, H-12), 2.29(1H, m, H-5a), 2.02(1H, m, H-5b), 2.26(1H, m, H-10a), 2.14(1H, m, H-10b), 2.06(1H, m, H-11a), 1.96(1H, m, H-11b);13C NMR(100 MHz, CD3OD)δC: 168.7 (C-1), 54.8C-3), 69.6(C-4), 37.7(C-5), 60.2(C-6), 168.8(C-7), 46.2(C-9), 24.2(C-10), 28.7(C-11), 61.7(C-12)。
化合物4:白色粉末(甲醇),[α]20D-117.6° (c= 0.48, MeOH), ESI-MS:m/z227[M+H]+, 分子式为C11H18N2O3。1H NMR(400 MHz, CD3OD)δH: 0.96(3H, d,J=6.4 Hz, H-12), 0.97(3H, d,J=6.4 Hz, H-13), 1.52(1H, m, H-10b), 1.92(2H, m, H-10a和H-11), 2.09(1H, ddd,J=13.6, 11.6, 4.0 Hz, H-5b), 2.28(1H, dd,J=13.2, 6.0 Hz, H-5a), 3.44(1H, d,J=12.8 Hz, H-3a), 3.66(1H, dd,J=12.4, 2.0 Hz, H-3b), 4.18(1H, m, H-9), 4.47(1H, t,J=4.0 Hz, H-4), 4.53(1H, dd,J=8.8, 7.2 Hz, H-6);13C NMR(100 MHz, CD3OD)δC: 169.0 (C-1), 54.6(C-3), 69.1(C-4), 38.1(C-5), 58.7(C-6), 173.0(C-7), 55.1(C-9), 39.3(C-10), 25.7(C-11), 23.3(C-12), 22.2(C-13)。
化合物5:白色粉末(甲醇),[α]20D-49.9° (c= 0.24, MeOH), ESI-MS:m/z283 [M+K]+, 分子式为C14H16N2O2。1H NMR(400 MHz, CD3OD)δH: 7.26(5H, m, H-2′, H-3′, H-4′), 4.44(1H, t,J=4.0 Hz, H-9), 4.06(1H, dd,J=10, 6.8 Hz, H-6), 3.52(1H, m, H-3a), 3.37(1H, m, H-3b), 3.16(2H, d,J=4.4 Hz, H-10), 2.27(1H, m, H-5a), 1.21(1H, m, H-5b), 2.09(1H, m, H-4a), 1.82(1H, m, H-4b);13C NMR(100 MHz, CD3OD)δC: 166.9 (C-1), 46.0(C-3), 22.8(C-4), 29.4(C-5), 60.1(C-6), 170.9(C-7), 57.7(C-9), 38.2(C-10), 137.3(C-1′), 131.0(C-2′), 129.4(C-3′), 128.1(C-4′)。
化合物6:白色粉末(甲醇),[α]20D-102.97° (c=0.10, EtOH), ESI-MS:m/z211[M+ H]+, 分子式为C11H18N2O2。1H NMR(400 MHz, CD3OD)δH: 4.26(1H, t,J=7.2 Hz, H-6), 4.12(1H, t,J=5.6 Hz, H-9), 3.50(2H, t,J=6.4 Hz, H-3), 2.29(1H, m, H-5a), 2.01(2H, m, H-5b, H-10a), 1.91(2H, m, H-4), 1.51(1H, m, H-10b), 1.35(1H, m, H-11), 0.96(3H, s,H-12), 0.94(3H, s, H-13);13C NMR(100 MHz, MeOD)δC: 172.8 (C-1), 46.4(C-3), 23.6(C-4), 29.1(C-5), 60.3(C-6), 168.9(C-7), 54.6(C-9), 39.4(C-10), 25.7(C-11), 23.3(C-12), 22.2(C-13)。
化合物7:白色粉末(甲醇),[α]20D+27.1° (c=0.05, EtOH), ESI-MS:m/z211 [M+ H]+, 分子式为C11H18N2O2。1H NMR(400 MHz, CD3OD)δH: 3.58(1H, m, H-3a), 3.50(1H, m, H-3b), 2.03(1H, m, H-4a), 2.35(1H, m, H-4b), 1.95(2H, m, H-5), 3.85(1H, m, H-9), 4.28(1H, t,J=13.6 Hz, H-6), 1.78(1H, m, H-10a), 1.69(1H, m, H-10b), 1.60(1H, m, H-11), 1.01(3H, d,J=6.8 Hz, H-12), 0.98(3H, d,J=6.0 Hz, H-13);13C NMR(100 MHz, MeOD)δC: 171.6 (C-1), 43.6(C-3), 23.1(C-4), 29.9(C-5), 59.3(C-6), 169.1(C-7), 57.1(C-9), 46.7(C-10), 25.5(C-11), 22.9(C-12), 23.3C-13)。
化合物8:无色晶体(甲醇),[α]20D-43.08° (c=0.04, MeOH), ESI-MS:m/z227 [M+ H]+, 分子式为C11H18N2O3。1H NMR(400 MHz, CD3OD)δH: 4.22(1H, t,J=6.8 Hz, H-9), 4.08(1H, s, H-6), 3.56(1H, m, H-3a), 3.52(1H, m, H-3b), 2.36~2.31(1H, m, H-5a), 2.19-2.16(1H, m, H-10), 2.07-2.02(1H, m, H-4a), 1.98~1.90(1H, m, H-4b), 2.00-1.93(1H, m, H-5b), 1.45(1H, m, H-11a), 1.38(1H, m, H-11b), 1.08(3H, d,J=6.8 Hz, H-13), 0.95(3H, d,J=7.2 Hz, H-12);13C NMR(100 MHz, CD3OD)δC: 172.4 (C-1), 46.2C-3), 23.2(C-4), 29.5(C-5), 61.3(C-6), 167.6(C-7), 60.0(C-9), 37.1(C-10), 25.4(C-11), 12.6(C-12), 15.5(C-13)。
化合物9:无色固体(甲醇),ESI-MS:m/z144 [M+ H]+, 分子式为C7H13NO2。1H NMR(400 MHz, CD3OD)δH: 3.14(2H, t,J=6.8 Hz, H-4), 2.52(2H, t,J=7.2 Hz, H-6), 2.13(3H, s, H-8), 1.92(3H, s, H-1), 1.72(2H, m, H-5);13C NMR(100 MHz, CD3OD)δC: 22.3 (C-1), 173.3(C-2), 39.7(C-4), 24.5(C-5), 41.3(C-6), 211.0(C-7), 29.8(C-8)。
化合物10:白色固体(甲醇),ESI-MS:m/z279 [M+ H]+, 分子式为C16H22O4。1H NMR(400 MHz, CD3OD)δH: 7.73(2H, dd,J=3.2, 5.2 Hz, H-3,6), 7.63(2H, dd,J=3.2, 5.2 Hz, H-4,5), 4.30(4H, t,J=6.4 Hz, H-8,8′), 1.73(4H, m, H-9,9′), 1.47(4H, m, H-10,10′), 0.99(6H, t,J=7.2 Hz, H-11,11′);13C NMR(100 MHz, CD3OD)δC: 133.6(C-1,2), 129.9(C-3,6), 132.4(C-4,5), 169.3(C-7,7′), 66.7(C-8,8′), 31.7(C-9,9′), 25.3(C-10,10′), 14.1(C-11,11′)。
2 结果与讨论
化合物1淡黄色固体(甲醇),ESI-MS提示其相对分子质量为260(m/z261[M+H]+),结合NMR谱数据,推断其分子式为C14H16N2O3,不饱和度为8。1H NMR中δH7.19 (2H, m)、7.29 (3H, m)推测其苯环位置为单取代,结合δH3.18 (1H, m, H-10a)、2.99 (1H, m, H-10b)显示有苯丙氨酸片段;δH4.21 (2H, brs, H-4/6)、3.59 (1H, m, H-3a)、3.27~3.24 (1H, m, H-3b)显示有羟脯氨酸片段,同时13C NMR中δC167.7 (C-1)和171.0(C-7)为两个酰胺碳信号,提示1为可能为叶立德类化合物,结合其旋光值[α]20D+41.17° (c=0.08, MeOH),以上数据与文献环(4-羟基-L-脯-D-苯丙)二肽[11]对照基本一致,故确定1为环(4-羟基-L-脯-D-苯丙)二肽。
化合物2淡黄色固体(甲醇),ESI-MS提示其相对分子质量为260(m/z261[M+H]+),结合NMR谱数据,推断其分子式为C14H16N2O3,不饱和度为8。与化合物1的NMR其数据对比,发现与1十分相似,仅在δC55.2(C-3), 38.8(C-10)有差异。且2的比旋光度值[α]20D-78.90° (c=0.1, MeOH)与1完全不同,以上数据与文献(4-羟基-L-脯-L-苯丙)二肽[11-12]对照基本一致,故确定其为环(4-羟基-L-脯-L-苯丙)二肽。
化合物3白色无定形固体(甲醇),ESI-MS提示其相对分子质量为210(m/z249[M+K]+)。结合NMR谱数据,推断其分子式为C10H14N2O3,不饱和度为5。与化合物1的NMR对比,其中不同之处δH4.49(1H, t,J=4.0 Hz, H-9), 3.51(2H, m, H-12), 2.26(1H, m, H-10a), 2.14(1H, m, H-10b), 2.06(1H, m, H-11a), 1.96(1H, m, H-11b)为脯氨酸片段,结合其比旋光度值为[α]20D-24.22° (c=0.06, H2O),以上数据与文献环(4-羟基-L-脯-D-脯)二肽[11,13]对照基本一致,故确定其为环(4-羟基-L-脯-D-脯)二肽。
化合物4白色粉末(甲醇),ESI-MS提示其相对分子质量为226(m/z227[M+H]+)。结合NMR谱数据,推断其分子式为C11H18N2O3,不饱和度为4。与化合物1的NMR对比,主要差异在1H NMR中δH0.96(3H, d,J=6.4 Hz, H-12)、0.97(3H, d,J=6.4 Hz, H-13)、1.52(1H, m, H-10b)、1.92(2H, m, H-10a和H-11)、4.18(1H, m, H-9)为亮氨酸片段,其他信号基本相同,结合比旋光度值[α]20D-117.6° (c= 0.48, MeOH)与文献报道环(4-羟基-L-脯-L-亮)二肽[12,14]对照基本一致,故确定其为环(4-羟基-L-脯-L-亮)二肽。
化合物5白色粉末(甲醇),ESI-MS提示其相对分子质量为244(m/z283[M+K]+),结合NMR谱数据,推断其分子式为C14H16N2O2,不饱和度为8。其NMR数据与化合物2和3对比,其中化合物2中δH: 4.27(1H, t,J=5.2 Hz, H-4)为4位连羟基碳上氢信号,而在化合物5中δH: 2.27(1H, m, H-5a), 1.21(1H, m, H-5b)为脯氨酸4位亚甲基信号,对比其他信号发现其有苯丙氨酸片段与脯氨酸片段,以上数据与文献环(L-脯-L-苯丙)二肽[15-16]对照基本一致,故确定其为环(L-脯-L-苯丙)二肽。
化合物6白色粉末(甲醇),ESI-MS提示其相对分子质量为210(m/z211[M+H]+),结合NMR谱数据,推断其分子式为C11H18N2O2,不饱和度为4,其相对分子质量与化合物4差16,可能为少一个氧原子,且不饱和度不变,其NMR数据与化合物4比较,其中δH1.91(2H, m, H-4)为脯氨酸4位没有连羟基的亚甲基,所以为脯氨酸片段,结合其比旋光度值[α]20D-102.97° (c=0.10, EtOH),与文献环(L-亮-L-脯)二肽[17]对照基本一致,故确定6为环(L-亮-L-脯)二肽。
化合物7白色粉末(甲醇),ESI-MS提示其相对分子质量为210(m/z211[M+H]+),结合NMR谱数据,推断其分子式为C11H18N2O2,不饱和度为4。1H NMR中δH1.95(2H, m, H-5)比化合物6中5位信号稍小,δH4.28(1H, t,J=13.6 Hz, H-6)偶合常数比化合物6中δH4.26(1H, t,J=7.2 Hz, H-6)中偶合常数小,其余信号与化合物6基本一致,推测7与化合物6为一对手性化合物,且比旋光度值[α]20D+27.1° (c=0.05, EtOH)与化合物6相反,以上数据与文献环(D-脯-L-亮)二肽[18]对照基本一致,故确定7为环(D-脯-L-亮)二肽。
化合物8无色晶体(甲醇),ESI-MS提示其相对分子质量为226(m/z227[M+H]+),结合NMR谱数据,推断其分子式为C11H18N2O3,不饱和度为4。其相对分子质量与化合物4一致,且不饱和度也一致,推测其与化合物4是羟基连接位置不同,其MNR中δH4.22(1H, t,J=6.8 Hz, H-9), 2.19~2.16(1H, m, H-10)、1.45(1H, m, H-11a), 1.38(1H, m, H-11b), 1.08(3H, d,J=6.8 Hz, H-13), 0.95(3H, d,J=7.2 Hz, H-12)为异亮氨酸片段,与化合物4对比其脯氨酸上未连有羟基,推测羟基可能连接在7位氮上,以上数据与文献环(8-羟基-L-脯-D-异亮)二肽[19]对照基本一致。故确定8为环(8-羟基-L-脯-D-异亮)二肽。
化合物9无色固体(甲醇),ESI-MS提示其相对分子质量为143(m/z144[M+H]+),结合1H及13C NMR谱数据,推断其分子式为C7H13NO2,不饱和度为2。1H NMR中δH3.14(2H, H-4), 2.52(2H, H-6), 1.72(2H, H-5)为三个相邻的亚甲基,δH2.13(3H, H-8), 1.92(3H, H-1)为两个甲基信号;13C NMR中δC173.3(C-2)为酰胺信号,δC211.0(C-7)为酮羰基信号。以上数据与文献N-(4-氧代戊基)-乙酰胺[20]对照基本一致,故确定其为N-(4-氧代戊基)-乙酰胺。
化合物10白色固体(甲醇),ESI-MS提示其相对分子质量为278(m/z279[M+H]+),结合NMR谱数据,推断其分子式为C16H22O4,不饱和度为6。1H NMR中低场处δH7.73(2H, H-3,6), 7.63(2H, H-4,5)两个芳香质子信号,高场处一个甲基信号δH0.99(6H, H-11,11′)、两个亚甲基信号δH1.73(4H, H-9,9′), 1.47(4H, H-10,10′)和一个连氧的亚甲基信号δH4.30(4H, H-8,8′),结合13C NMR中给出8个碳信号以及质谱给出相对分子质量推测该化合物可能为对称分子,因为有两组芳香质子信号所以为苯环临位取代对称分子结构,结合NMR数据与文献邻苯二甲酸丁酯[21]对照基本一致,故确定其为邻苯二甲酸丁酯。
化合物1-10均首次从放线菌Streptomycesnovaecaesareae该种中分离得到,且1、3首次从海洋放线菌中分离得到。1、3和7含有自然界中不常见的D构型氨基酸。文献检索表明目前所报道的D构型氨基酸组成的叶立德类化合物真菌来源的较多,且有文献报道含有D构型氨基酸的叶立德类化合物比含有L构型的同类物质生物活性好[11,22],化合物1和2具有诱导烟草细胞产生H2O2的作用,且因为D-Phe构型关系1的作用明显强于2[11]。化合物4对RAW264.7细胞显示出较好的生长抑制活性(IC50= 9.1 μmol/L)[23],且对慢性粒细胞白血病细胞系K562也具有较强的细胞毒活性[24]。5能够诱导J774A.1细胞增加分泌抗炎细胞因子IL-10,且还可以促进IFN-γ分泌,IFN-γ具有抗病毒、免疫调节和抗肿瘤的特性[25]。化合物5和6具有良好的抗鳗弧菌Vibrioanguillarum活性(MIC为0.03~0.07 μg/mL)[26]。5和7对枯草芽胞杆菌、金黄色葡萄球菌和大肠杆菌均具有抑制作用,且对大肠杆菌的抑制作用7与环丙沙星相当[18]。8具有抑制人胰腺癌细胞(PANC-1)的增殖作用[27]。
有文献报道研究表明,微生物产生的环二肽类多作为胞间传递的信号分子,例如,环二肽分子cyclo(Phe-Pro)能够刺激高丝氨酸内酯信号传递途径[28],微生物可感知其浓度的变化,以调节微生物的群体行为。文献 [29]研究发现,乳酸菌产生的cyclo(L-phe-L-pro)和cyclo(L- tyr-L-pro)可作为信号分子,调节乳酸菌和葡萄球菌之间细胞间信息交流,使内源性或益生菌菌株可减弱病原菌产生的毒素因子。可见微生物产生的环二肽作为信号分子在微生物群体行为具有很重要的作用。
