基于灰度密度分布特征的肺结节良恶性分类
2019-05-24NGUYENXUANHIEN
NGUYEN XUAN HIEN


摘 要:CT 图像中肺结节良恶性鉴别是肺癌计算机辅助诊断研究中的关键。为了提高计算机辅助诊断系统中肺结节良恶性诊断准确性,提出一种基于密度分布特征的肺结节良/恶性判断方法。首先,从肺部肿瘤图像中随机提取图像小单元集并计算其自相关矩阵,然后通过K-means算法对该矩阵实现无监督聚类。特征提取时遍历计算肺结节图像每一像素的灰度密度分布等级,并统计、归一化得到10维特征向量,最后通过卷积方法对特征进行优化。同时,利用随机森林分类器进行模型训练,进而判断肺结节良/恶性水平,提出算法的验证数据为LIDC-IDRI。实验结果表明,最大AUC可达0.955 8。对比分析,该特征表达方法具有更优分类效果和更高鲁棒性。
关键词:图像单元集;LIDC-IDRI;良恶性分类;密度分布特征;K均值
DOI:10. 11907/rjdk. 182442
中图分类号:TP317.4 文献标识码:A 文章编号:1672-7800(2019)005-0181-06
Abstract: The discrimination of benign and malignant pulmonary nodules in CT image is the key of computer-aided diagnosis (CAD) for lung cancer. In order to improve the accuracy of benign/malignant diagnosis of pulmonary nodules in the CADs, this paper proposed a gray density distribution feature extraction algorithm based on image small cell set. First we collected the cells from lung nodule images and calculated the correlation matrix of cell set used Euclid distance. Then, we used the K-means clustering methods to classify the current image blocks and generated the labels of cell set. After that, we scan the nodule image, calculated the distribution density level for each pixel, and then generated the feature vector by statistic and normalization. Finally, we used the Gaussian kernel to optimization this vector and extracted the gray scale density distribution feature of the lung nodule image. The vector set is combined with the well-known classifier of Random Forest for training and testing. We evaluated the classification framework in LIDC-IDRI dataset, the best AUC of ROC reached 0.9558. The proposed method outperforms the most recent techniques, and the experimental results show great robustness of the proposed method for different lung CT image datasets.
Key Words: image cells; LIDC-IDRI; benign and malignant classification; density distribution feature; K-means
0 引言
目前肺癌已經成为致命率最高的癌症,早期发现和及时治疗有助于提高病患者生存率。断层扫描技术(Computed Tomography,CT)迅速发展,成为有效的肺癌检验方法。肺部CT图像可以理解为单通道高位图像,其单位为HU值(Hounsfield Unit,HU)。通过观察胸腔扫描的CT图像,结合临床症状可以发现疑似癌症区域及其危险程度(良/恶性)。胸腔CT扫描越来越普遍,带给医生巨大的阅片压力,阅片过程中主要凭借相关知识与个人工作经验,难免存在漏诊或误判病灶区域危险程度等情况,不利于诊断和治疗。使用计算机技术处理肺部CT图像模型有助于提高阅片效率与精准度,并迅速成为热门研究方向。肺部CT图像计算机辅助诊断系统中主要包含肺结节检测、分割、分类等研究项目[1-3]。其中,系统性能主要体现在检测早期肺结节以及危险程度正确分类的能力。
肺部CT图像处理模型主要使用开源数据库证明模型的性能及其鲁棒性。常见的肺部CT图像数据库为LIDC-IDRI、NLST、NELSON等[4-6]。其中,LIDC-IDRI为最大的开源肺部CT数据库,包含大量肺结节样本及其标签。因此,LIDC-IDRI数据库经常被用来验证研究者的肺结节良/恶性分类模型,包括图像特征提取、分类器优化模型。
肺结节良/恶性分类旨在给医生提供科学、可靠的辅助分类结果,使诊断过程更加精准,并且有效减少医生的阅片工作量。分类过程中需先计算图像特征,然后结合分类器对样本集进行训练和测试。常见的分类器主要包含KNN、ANN、SVM、Random Forest、Adaboost、模糊C均值等[7-12]。常用于肺结节良/恶性分类的图像特征为几何特征、纹理特征、灰度密度分布特征等[10,13-14]。郭薇等[15]使用FCM方法针对130 组结节数据进行实验得到肺结节良恶性鉴别的敏感性、假阳率分别达到87.58% 和9.52%; Dhara[13]根据肺结节的2D/3D几何和Harralick纹理特征将LIDC-IDRI数据样本集分为良性与恶性两类,其最优AUC(Area Under Curve)值达到了0.9505;Jiang[16]利用深度学习卷积神经网络对LIDC-IDRI实现肺结节良恶性分类,最佳AUC of ROC为0.913;Maldonado[17]提出一种肺结节图像密度分布计算方法用于肺结节分类,该特征描述肺结节的灰度值分布情况,非常有借鉴意义。同样使用基于图像单元集的灰度密度分布特征提取方法,Le等[10]对LIDC-IDRI具有临床标签的样本与合作意愿数据库(ZSDB)实现肺结节良/恶性分类,并取得良好的分类效果。然而,搜集图像单元时由于其本身灰度分布存在较大不确定性,导致特征的表征精度欠佳,因而影响其分类性能。
为提高肺结节良/恶性分类性能,本文提出一种基于图像单元集的灰度密度分布特征计算方法。计算过程中,从样本集获取若干尺寸一致的小单元,并计算其自相关矩阵,通过K-means算法对该矩阵实现无监督聚类生成对应的标签集。遍历肺结节图像计算每一像素的灰度密度分布等级,并进行统计与归一化,得到密度分布特征。最后,使用高斯卷积对特征进行优化,生成灰度密度分布特征,并结合随机森林分类器对数据集实现良恶性分类。
1 数据与方法
1.1 数据库验证
LIDC-IDRI(The Lung Image Database Consortium and Image Database Resource Initiative,LIDC-IDRI)为目前最大的肺CT开源数据库之一,同时也是肺CT图像处理算法验证数据最佳选择之一。该数据库包含3 000多个肺结节,然而样本存在过大与钙化的肺结节。经过数据分析和筛选,本文使用LIDC-IDRI的885个肺结节作为算法验证数据。研究对象数据中,像素间距及片间距分布分别为0.5~0.8mm与0.6~5.0mm,长径范围为[3.0mm,15.0mm]。LIDC-IDRI肺CT图像和肺结节样本如图1所示,其中左边是肺CT图像,右边是肺结节图像,第1-5行分别为rank1-5的样本图像。
LIDC-IDRI肺结节由多名医生进行标注和分类,其中包括肺结节在CT图像中的边缘坐标及其相关先验信息。LIDC-IDRI肺结节的标注信息包含9种与良恶性判断相关因素,如显著性、钙化、球度、毛刺度、纹理、恶性程度等。其中最重要的参数是恶性程度,该因素共包含5个档次,分别为rank 1-5。本文算法验证数据的样本数量从rank 1-5分别为130/250/150/245/110。其中rank 1、rank 2的样本为良性肺结节,rank 4、rank 5的样本为恶性类样本,而rank 3为不确定类别樣本。本文验证提出特征对肺结节分类性能的同时,分析LIDC-IDRI rank3样本的分类倾向。实验设计类似于Han[…]的样本规划方案,对验证数据分别做3个实验。
实验一:(rank1+rank2)为良性结节,(rank4+rank5)为恶性结节,忽略rank3的样本。
实验二:(rank1+rank2+rank3)为良性结节,(rank4+rank5)为恶性结节。
实验三:(rank1+rank2)为良性结节,(rank3+rank4+rank5)为恶性结节。
实验具体样本分配如表1所示。
1.2 基于图像单元集的灰度密度分布特征提取
肺部CT影像中,可疑区域的灰度级分布影响到肺结节定位和分类。因此,灰度密度分布是肺结节图像危险程度重要判断指标之一。图像灰度密度分布指的是图像中像素值与周围邻近点之间的关系,表征图像任意局部区域灰度值出现的强度及其幅度。图像中密集出现高灰度值的区域为高密度区域,而高灰度值像素较稀疏的则为低密度区域。
1.2.1 图像单元集聚类
灰度密度分布特征提取过程中首先需建立一个足够大的训练数据库,即图像单元集[Λ{h(x,y)}]。该单元集为提取特征时的参照对象,并决定肺结节灰度密度分布特征的表征精度。这些图像单元是从肺结节数据集中获得的,而且尺寸需根据目标提取特征图像大小而变化,如5×5、7×7、9×9等。如果单元尺寸太小,处理之后更接近于点处理的结果从而会引入噪声,太大则对较小的肺结节带来较大误差。构建图像单元集时需满足以下条件:①遍历肺结节图像,随机挑选出若干一致尺寸的单元,单元中所有像素均为非背景;②为提高提取过程的运行效率,单元之间不能存在绝对重复;③各单元的灰度均值需覆盖整个可能出现肺结节的灰度段而且其数量要平衡。
2 实验结果与分析
本文展示了验证数据库分类性能的实验效果及其分析结果。分类模型实验配置具体如下:分类器使用机森林模型(Random Forest,RF);训练和测试样本比例为70%:30%;模型性能评价时,对LIDC-IDRI计算训练性能的平均识别率、敏感度、特异性以及ROC;每一个子集分别做100次实验并计算平均性能评价参数值。
实验平台配置:编程语言为Python 3.0-Windows 10;硬件信息为Processor Intel(R) Core(TM) i7-7700HQ 2.80Ghz (8CPUs);GPU Geforce 1050;RAM 8Gb。
2.1 图像特征分析
LIDC-IDRI数据库中的样本及其特征向量如图4所示,第1-5行分别为rank 1-5肺结节样本及其特征向量。
LIDC-IDRI特征向量中,低等级密度排序从rank 1至rank 5稳定递减,而高等级密度比例则递增。实验结果表明,LIDC-IDRI肺结节的灰度密度分布特征具有可靠的统计意义,各类特征向量之间差异很明显且稳定,可以作为肺结节良恶性分类依据。
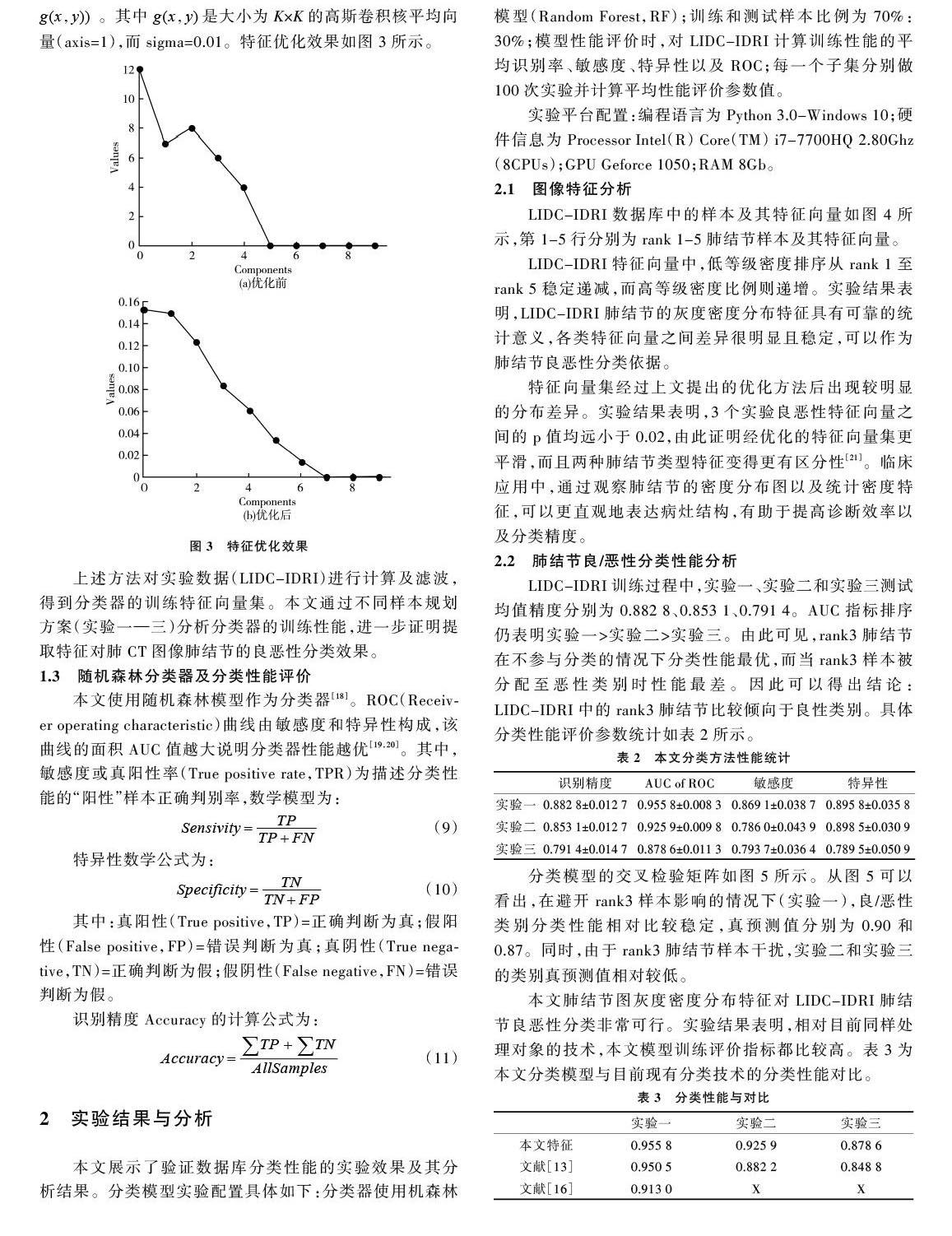
特征向量集经过上文提出的优化方法后出现较明显的分布差异。实验结果表明,3个实验良恶性特征向量之间的p值均远小于0.02,由此证明经优化的特征向量集更平滑,而且两种肺结节类型特征变得更有区分性[21]。临床应用中,通过观察肺结节的密度分布图以及统计密度特征,可以更直观地表达病灶结构,有助于提高诊断效率以及分类精度。
2.2 肺结节良/恶性分类性能分析
LIDC-IDRI训练过程中,实验一、实验二和实验三测试均值精度分别为0.882 8、0.853 1、0.791 4。AUC指标排序仍表明实验一>实验二>实验三。由此可见,rank3肺结节在不参与分类的情况下分类性能最优,而当rank3样本被分配至恶性类别时性能最差。因此可以得出结论:LIDC-IDRI中的rank3肺结节比较倾向于良性类别。具体分类性能评价参数统计如表2所示。
分類模型的交叉检验矩阵如图5所示。从图5可以看出,在避开rank3样本影响的情况下(实验一),良/恶性类别分类性能相对比较稳定,真预测值分别为0.90和0.87。同时,由于rank3肺结节样本干扰,实验二和实验三的类别真预测值相对较低。
本文肺结节图灰度密度分布特征对LIDC-IDRI肺结节良恶性分类非常可行。实验结果表明,相对目前同样处理对象的技术,本文模型训练评价指标都比较高。表3为本文分类模型与目前现有分类技术的分类性能对比。
3 结语
本文阐述了肺CT图像中肺结节基于图像特征结合与分类器的良恶性分类问题,提出一种基于图像单元集的肺结节图像灰度密度分布特征提取方法以及随机森林分类器样本训练模型。该方法主要依赖图像单元集搜集及其无监督聚类过程。为了提高特征的表征精度,使用高斯卷积方法对10维密度特征进行优化,使其更具有样本之间的区分能力。该密度分布特征描述肺结节图像中像素与周围邻近点的灰度级分布统计量。实验结果与对比分析表明,基于密度分布的特征评估算法能有效对肺结节良恶性等级进行分类。由于使用LIDC-IDRI公开数据集作为验证数据,所以还未能对中国肺癌病患者样本进行分析及分类模型性能评价。未来将以中国肺癌CT图像样本为主要研究对象,进一步提高分类模型的鲁棒性、实用性与通用性。
参考文献:
[1] SUI X, MEINEL F G, SONG W, et al. Detection and size measurements of pulmonary nodules in ultra-low-dose CT with iterative reconstruction compared to low dose CT[J]. European Journal of Radiology, 2016, 85(3): 564-570.
[2] TUNALI I, GUVENIS A. A fusion method for pulmonary nodule segmentation in chest CT image sets[C]. International Conference on Biomedical and Health Informatics (BHI), 2016:180-183.
[3] KURUVILLA, JINSA, GUNAVATHI K. Lung cancer classification using neural networks for CT images[J]. Computer Methods and Programs in Biomedicine,2014,113(1): 202-209.
[4] ARMATO, SAMUEL G. The lung image database consortium (LIDC) and image database resource initiative (IDRI): a completed reference database of lung nodules on CT scans[J]. Medical Physics, 2011, 38(2): 915-931.
[5] KRAMER, BARNETT S. Lung cancer screening with low-dose helical CT: results from the National Lung Screening Trial (NLST)[J]. Journal of Medical Screening, 2011, 18: 109-111.
[6] ZHAO Y R,XIE X Q. NELSON lung cancer screening study[J]. Cancer Imaging, 2011, 11(1A): 79.
[7] FARAG,AMAL A. Feature descriptors for nodule type classification[C]. Proceedings of 2011 Computer Assisted Radiology and Surgery (CARS), 2011:1-6.
[8] ZHU Y J. Feature selection and performance evaluation of support vector machine (SVM)-based classifier for differentiating benign and malignant pulmonary nodules by computed tomography[J]. Journal of Digital Imaging, 2010, 23(1): 51-65.
[9] ABDUH Z, WAHED M A, KADAH Y M. Robust computer-aided detection of pulmonary nodules from chest computed tomography[J]. Journal of Medical Imaging and Health Informatics, 2016, 6(3): 693-699.
[10] LE, VANBANG. Automated classification of pulmonary nodules for lung adenocarcinomas risk evaluation: an effective CT analysis by clustering density distribution algorithm[J]. Journal of Medical Imaging and Health Informatics, 2017, 7(8): 1753-1758.
[11] OCHS R A,GOLDIN J G,ABTIN F,et al. Automated classification of lung bronchovascular anatomy in CT using AdaBoost[J]. Medical Image Analysis, 2007, 11(3): 315-324.
[12] 姜婷,襲肖明,岳厚光. 基于分布先验的半监督 FCM 的肺结节分类[J]. 智能系统学报,2017,12(5): 729-734.
[13] DHARA,ASHIS K. A combination of shape and texture features for classification of pulmonary nodules in lung CT images[J]. Journal of Digital Imaging, 2016: 1-10.
[14] OROZCO H M,VILLEGAS O O V, SáNCHEZ V G C, et al. Automated system for lung nodules classification based on wavelet feature descriptor and support vector machine[J]. Biomedical Engineering Online, 2015, 14(1):9.
[15] 郭薇. 基于多维图像信息的肺结节良恶性鉴别方法[J].沈阳航空航天大学学报,2016,33(3): 67-72.
[16] JIANG H Y. A novel pixel value space statistics map of the pulmonary nodule for classification in computerized tomography images[C]. 2017 39th Annual International Conference of the IEEE, 2017:556-559.
[17] MALDONADO F,BOLAND J M,RAGHUNATH S,et al. Noninvasive characterization of the histopathologic features of pulmonary nodules of the lung adenocarcinoma spectrum using computer-aided nodule assessment and risk yield (CANARY)—a pilot study[J]. Journal of Thoracic Oncology, 2013, 8(4): 452-460.
[18] LIAW,ANDY,MATTHEW W. Classification and regression by Random Forest[J]. R News,2002,2(3):18-22.
[19] REVEL,MARIE P. Subsolid lung nodule classification: a CT criterion for improving interobserver agreement[J]. Radiology, 2017, 286(1): 316-325.
[20] CHAUBEY,YOGENDRA P. Resampling-based multiple testing: examples and methods for P-value adjustment[J]. Taylor & Francis, 1993, 450-451.
(责任编辑:何 丽)
