灰树花β多糖通过激活氧化应激诱导肺癌细胞凋亡
2019-05-24陶佳牛静静郝世莉刘家有
陶佳,牛静静,郝世莉,刘家有
(1.川北医学院基础医学院病理学教研室·川北医学院附属医院病理科,四川 南充 637000;2.西安市胸科医院病理科,陕西 西安 710100;3.重庆市第七人民医院儿科,重庆 400054;4.川北医学院基础医学院人体解剖学教研室,四川 南充 637000)
肺癌是目前严重威胁人类健康的最常见的恶性肿瘤之一,其死亡率位居所有恶性肿瘤首位。尽管联合使用吉西他滨,紫杉类等新的化疗药物与顺铂是目前治疗肺癌的一线治疗方案,但是临床大数据显示肺癌患者5年生存率仍较低[1]。灰树花是一种食用菌,兼有重要的药用价值,主要分布于我国浙江,河北,四川,云南,福建等省。近30年来,研究人员从灰树花子实体和菌丝中提取出近几十种活性物质,大部分是具有生物活性的多糖物质,包括MD-型、X-型和D-型等。研究[2]发现,灰树花提取物多糖成分是一种较好的免疫佐剂。Kodama等[3]研究发现,D-Fraction能够激活巨噬细胞,导致IL-12生成增多。Inoue等[4]研究发现,D-Fraction在调控T淋巴结Th1/Th2的比率方面发挥着重要的作用。近年来,有研究表明灰树花提取物在抗肿瘤方面发挥着重要的作用。例如,D-Fraction能够显著抑制犬癌细胞的生长[5]。在荷瘤小鼠中,灰树花D-Fraction能够增强抗肿瘤效应,减弱丝裂霉素诱导的免疫抑制作用[2]。荷瘤小鼠口服灰树花提取物β-葡聚糖能够增强系统性抗肿瘤免疫反应,减弱免疫抑制作用[6]。基于此,课题组提出疑问,灰树花提取物对肺癌细胞的生存与凋亡有无影响?迄今为止,尚未见相关报道。本实验通过研究灰树花β-多糖对肺癌细胞的生存与凋亡的影响,明确灰树花β-多糖具有抑制肺癌细胞生存的特性;并初步探讨灰树花β-多糖诱导肺癌细胞凋亡的分子机制,发现灰树花β-多糖通过诱发肺癌细胞发生氧化应激,促使胞内活性氧生成增多,最终导致细胞凋亡。
1 材料与方法
1.1 材料
肺癌细胞A549和LA795为本实验室保存的细胞株。F-12K细胞培养液(Invitrogen,美国),胎牛血清(Hyclone,美国),D-Fraction(Mushroom wisdom,美国),CCK-8,细胞线粒体分离试剂盒(碧云天,中国),MitoSOX和TMRM染料(Invitrogen,美国),Annexin-V FITC/PI双染细胞凋亡检测试剂盒(贝博,中国),细胞色素c,Bcl-2,Bax,Bak,β-actin,COXⅣ抗体(Abcam,美国)
1.2 细胞培养
用含10%胎牛血清的F12K培养液于37 ℃,5% CO2细胞培养箱中培养肺癌细胞A549和LA795。
1.3 CCK-8法检测细胞活力
取处于对数生长期的肺癌细胞接种于96孔板。24 h后,更换培养基,使其含有不同浓度的D-Fraction。后续根据实验需要,在不同时间节点加入10 μL CCK-8试剂。避光孵育1 h后,在450 nm处检测光吸收值。每组设8个复孔,实验重复3次。
1.4 Annexin V-FITC/PI双染法检测细胞凋亡
取处于对数生长期的肺癌细胞接种于6孔板。24 h后,更换培养基,使其含有不同浓度的D-Fraction。48 h后,常规收集细胞。用预冷的PBS缓冲液冲洗两次,加入400 μL结合缓冲液,重悬细胞。于避光条件下,加入10 μL Annexin V-FITC染料,混匀,4 ℃孵育10 min。加入5 μL PI染料,混匀,4 ℃避光孵育10 min,上机检测。每组设3个复孔,实验重复3次。
1.5 MitoSOX检测线粒体ROS
取处于对数生长期的肺癌细胞接种于共聚焦显微镜专用Dish中。24 h后,更换培养基,使其含有不同浓度的D-Fraction。48 h后,用无血清培养基冲洗三次。加入Mito SOX染料,37 ℃避光孵育10 min。弃染液,加入500 μL 无血清培养基覆盖细胞,于共聚焦显微镜下观察,拍照。用Image J软件计算荧光强度。每组3个复孔,每孔随机拍摄5个视野,实验重复3次。
1.6 TMRM检测线粒体膜电位
取处于对数生长期的肺癌细胞接种于共聚焦显微镜专用Dish中。24 h后,更换培养基,使其含有不同浓度的D-Fraction。48 h后,加入TMRM染料,使其终浓度为100 nM,37 ℃避光孵育30 min。弃染液,加入500 μL 无血清培养基覆盖细胞,于共聚焦显微镜下观察,拍照。用Image J软件计算荧光强度。每组3个复孔,每孔随机拍摄5个视野,实验重复3次。
1.7 分离线粒体蛋白
常规收集细胞,用预冷的PBS缓冲液冲洗3次。加入1 mL线粒体分离试剂,悬浮细胞,冰浴15 min。将细胞悬液转移至玻璃匀浆器中,匀浆约20下。600 g,4 ℃离心10 min。取上清,转移至新的离心管,11 000 g,4 ℃离心10 min。收集上清即为不含线粒体的胞浆蛋白;收集沉淀即为线粒体。随后采用细胞裂解液裂解线粒体,即可获得线粒体蛋白。
1.8 Western Blot
常规收集细胞。用细胞裂解液于冰上裂解细胞,获得细胞蛋白,用BCA法进行蛋白定量。加入适量5×SDS-PAGE缓冲液,煮沸,变性。后续经SDS-PAGE电泳分离蛋白,转膜,封闭,一抗孵育(4 ℃,过夜),二抗孵育等步骤。最后将PVDF膜置于采集器内,发光,拍照。β-actin为胞浆蛋白内参照,COXⅣ为线粒体蛋白内参照。用Quantity One软件对条带进行灰度值分析。实验重复3次。
1.9 统计学分析
采用SPSS 16.0软件分析。多组数据分析采用方法检验,两组间比较采用非配对t检验。P<0.05为差异有统计学意义。
2 结果
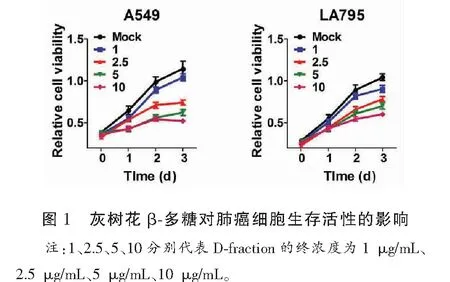
2.1 灰树花β多糖抑制肺癌细胞生长
如图1所示,灰树花β多糖处理能够显著抑制肺癌细胞的生长。并且,灰树花β多糖抑制肺癌细胞生长呈剂量依赖性。2.5 μg/mL灰树花β多糖对肺癌细胞A549的生长抑制率为(35.13±2.89)%,对LA795细胞的生长抑制率为(25.09±3.64)%;与对照组相比,其差异具有统计学意义(P<0.05)。5 μg/mL灰树花β多糖对肺癌细胞A549的生长抑制率为(45.68±3.81)%,对LA795细胞的生长抑制率为(32.82±3.67)%;与对照组相比,差异具有统计学意义(P<0.05)。10 μg/mL灰树花β多糖对肺癌细胞A549的生长抑制率为(54.54±2.14)%,对LA795细胞的生长抑制率为(42.52±2.69)%;与对照组相比,其差异具有统计学意义(P<0.05)。后续实验中,灰树花β多糖剂量取5 μg/mL进行研究。
2.2 灰树花β多糖促进肺癌细胞凋亡
如图2所示,灰树花β多糖处理能够显著促进肺癌细胞凋亡。5 μg/mL灰树花β多糖处理48 h后,肺癌细胞A549的细胞凋亡率为(37.80±3.76)%,与对照组(4.30±0.80)%相比,其差异具有统计学意义(P<0.05)。5 μg/mL灰树花β多糖处理48 h后,肺癌细胞LA795的细胞凋亡率为(40.80±5.81)%,与对照组(4.43±0.78)%相比,差异具有统计学意义(P<0.05)。

2.3 灰树花β处理诱发肺癌细胞氧化应激
如图3所示,灰树花β多糖处理后,细胞内ROS产生显著增多。5 μg/mL灰树花β多糖处理48 h后,肺癌细胞A549的ROS相对水平为(1 299.67±37.21),与对照组(580.33±17.75)相比,差异具有统计学意义(P<0.05)。5 μg/mL灰树花β多糖处理48 h后,肺癌细胞LA795的ROS相对水平为(1133.00±115.02),与对照组(513.67±31.33)相比,差异具有统计学意义(P<0.05)。
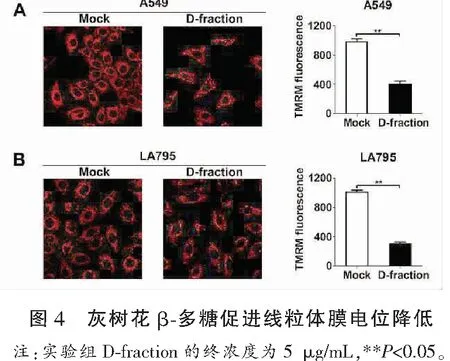
2.4 灰树花β处理降低肺癌细胞线粒体膜电位
如图4所示,灰树花β多糖处理后,线粒体膜电位显著降低。5 μg/mL灰树花β多糖处理48 h后,肺癌细胞A549的线粒体膜电位的相对水平为(399.67±59.87),与对照组(980.33±64.15)相比,差异具有统计学意义(P<0.05)。5 μg/mL灰树花β多糖处理48 h后,肺癌细胞LA795的线粒体膜电位的相对水平为(299.87±37.21),与对照组(1007.01±35.39)相比,差异具有统计学意义(P<0.05)。

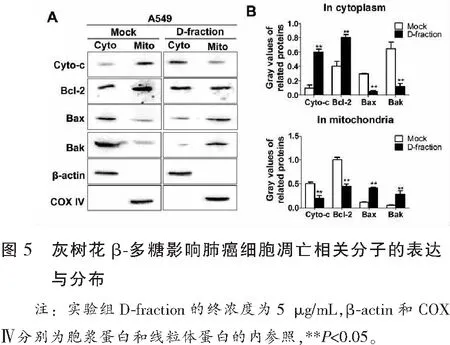
2.5 灰树花β处理促进肺癌细胞Cyto-c从线粒体释放
如图5所示,灰树花β多糖处理促进Cyto-c从线粒体释放至胞浆。5 μg/mL灰树花β多糖处理48 h后,Cyto-c在胞浆中的相对表达水平为(0.61±0.04)。与对照组(0.12±0.06)相比,其在胞浆中的相对表达水平显著升高(P<0.05)。5 μg/mL灰树花β多糖处理48 h后,Cyto-c在线粒体中的相对表达水平为(0.22±0.05)。与对照组(0.51±0.04)相比,其在线粒体中的相对表达水平显著降低(P<0.05)。
2.6 灰树花β处理促进肺癌细胞Bcl-2家族分子发生转位
如图5所示,灰树花β多糖处理促进Bcl-2从线粒体转位至胞浆;促进Bax和Bak从胞浆转位至线粒体。5 μg/mL灰树花β多糖处理48 h后,Bcl-2在线粒体中的相对表达水平为(0.45±0.05)。与对照组(1.01±0.06)相比,其在线粒体中的相对表达水平显著降低(P<0.05)。5 μg/mL灰树花β多糖处理48 h后,Bax在线粒体中的相对表达水平为(0.41±0.02)。与对照组(0.12±0.005)相比,其在线粒体中的相对表达水平显著升高(P<0.05)。5 μg/mL灰树花β多糖处理48 h后,Bak在线粒体中的相对表达水平为(0.29±0.07),与对照组(0.05±0.01)相比,其在线粒体中的相对表达水平显著升高(P<0.05)。
3 讨论
灰树花是一种生长在亚热带的大型食用菌,具有重要的药用价值。别名栗蘑,多叶奇果菌[7]。在日本称为“舞茸”。自上世纪八十年代以来,研究人员陆续从灰树花子实体和菌丝中提取出几十种活性多糖成分,包括MD-型,X-型,和D-型等。D-Fraction主要由两种葡聚糖组成,包括:以β-(1-6)结合为主链,β-(1-3)结合为侧链的葡聚糖和以β-(1-3)结合为主链,β-(1-6)结合为侧链的葡聚糖。研究发现,灰树花提取物多糖成分具有较强的生物调节活性。它在免疫调节,抑制肿瘤发生发展,拮抗HIV病毒,血糖血压调节,调控脂肪代谢等方面发挥着重要的作用。在胰岛素抵抗的KK小鼠中,X-fraction能够调控葡萄糖/胰岛素代谢,其机制可能是通过增强外周胰岛素敏感性[8]。在2型糖尿病小鼠KK-Ay中,MT-α-葡聚糖通过与胰岛素受体相互作用抵抗糖尿病[9]。此外,灰树花多糖活性成分在血压调节方面发挥着重要的作用。研究发现,2型糖尿病小鼠口服灰树花多糖成分SX-fraction能够显著降低收缩压和空腹血糖[10]。载体蛋白E敲除小鼠口服灰树花提取物后,血清总胆固醇水平显著降低,表明灰树花提取物能够抑制动脉粥样硬化的发展[11]。Lin等[12]研究发现MD-Fraction以剂量依赖的方式作用于造血骨髓干细胞,促进骨髓干细胞的生长和分化。此外,灰树花活性成分在免疫调节方面也发挥着重要的作用。Kubala等[13]研究发现,D-葡聚糖能够激活血液吞噬细胞和淋巴细胞,具体表现为:血液中ROS水平升高,促炎因子IL-6,IL-8,TNFα水平升高。Kodama等[3]研究发现,D-Fraction通过激活巨噬细胞,促进IL-12生成增多,最终导致NK细胞杀伤活性增强。
本研究发现,D-Fraction处理能够显著抑制肺癌细胞生长,促进肺癌细胞凋亡。Kodama等还发现,D-Fraction通过激活巨噬细胞,树突细胞,和T细胞,抑制肿瘤细胞生长。Konno[5]的研究结果表明D-Fraction能够有效的抑制犬癌细胞生长或直接杀死癌细胞。在荷瘤小鼠模型中发现,口服D-Fraction或腹腔注射D-Fraction均能够抑制肿瘤生长[6]。Shomori等[14]研究发现灰树花提取物能够显著抑制胃癌细胞生长,促进胃癌细胞凋亡。D-Fraction联合化疗药物丝裂霉素能够抑制肿瘤细胞生长[2]。近年来,灰树花提取物抑制肿瘤生长是否依赖于免疫系统的激活仍存在分歧。Sanzen等[15]研究结果发现,D-Fraction以依赖激活巨噬细胞的方式抑制肝癌细胞Huh-1生长。与Sanzen等研究结果一致,Masuda等[16]研究结果表明,MD-Fraction通过激活NK细胞和抗原呈递细胞,抑制胞内粘附分子(intracellular adhesion molecule,ICAM-1),最终抑制肿瘤细胞的迁移和侵袭。然而,Aloso等[17]研究发现,D-Fraction以不依赖于免疫系统的方式,直接作用于肿瘤细胞,并能够显著降低肿瘤细胞活力,降低乳腺癌细胞的迁移和侵袭活性,最终导致细胞侵袭性行为减弱。并且,D-Fraction能够显著降低荷乳腺癌小鼠的肿瘤负荷和肺转移的转移灶数目。本次研究结果与Aloson等的研究结果一致,显示D-Fraction能够直接作用于肺癌细胞,抑制肺癌细胞生长,促进肺癌细胞凋亡。
研究结果表明,D-Fraction能够诱发肺癌细胞发生氧化应激,主要表现为细胞内活性氧产生显著增多,线粒体膜电位降低,细胞色素c从线粒体释放至胞浆,Bcl-2从线粒体外膜转位至胞浆,Bax和Bak从胞浆转位至线粒体外膜,最终导致肺癌细胞凋亡。Shomori等发现,灰树花提取物处理胃癌细胞后,胞浆细胞色素c水平显著升高,caspase 3和ADPR活化形式水平显著升高,而p21和Bax的水平不变,细胞发生凋亡。Soares等[18]研究发现,D-Fraction通过上调Bax基因表达,诱导乳腺癌细胞凋亡。近年来,有研究报道D-Fraction也能够通过调控血管生成发挥抗肿瘤作用[19]。Sanzen等研究表明,D-Fraction处理能够激活巨噬细胞,导致一氧化氮合酶介导的一氧化氮合成增多,抑制肝癌细胞生长。以上研究表明,灰树花提取物D-Fraction在多种恶性肿瘤细胞中均能诱导细胞凋亡,但诱导细胞凋亡的作用机制不尽相同,这可能与细胞类型及细胞所处的环境有关。
总之,本研究首次报道了灰树花提取物D-Fraction能够抑制肺癌细胞生长,促进肺癌细胞凋亡。其机制可能是通过诱发肺癌细胞发生氧化应激,促使细胞内活性氧生成增多,线粒体功能受损,最终导致细胞凋亡。
