苦豆子条带对棉田捕食性天敌发生的影响
2019-05-23罗延亮李雪玲刘永建王佩玲陆宴辉
罗延亮,李雪玲,李 辉,谢 欣,刘永建,王佩玲,陆宴辉
(1.石河子大学农学院/新疆绿洲农业病虫害治理与植保资源利用重点实验室,新疆石河子 832003;2.新疆生产建设兵团第八师121团农业发展服务中心,新疆石河子832066;3.中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室,北京 100193)
0 引 言
【研究意义】棉蚜Aphisgossypii(Glover)是世界范围内一种重要的农业害虫,主要为害棉花等经济作物[1],是新疆棉田的一种主要害虫。多年来,单纯依赖化学农药防治害虫会带来抗药性和残留等问题日益凸显,挖掘利用自然天敌的生物控害功能,成为了现阶段国内外农业害虫防控研究与实践的一个重点[2]。【前人研究进展】通过改变大田周围非作物生境的植被组成及其他特征,可以调控农业生态系统中害虫与天敌的相互关系,提高天敌对害虫的控制效能,最终达到持续控害的目标[3, 4, 5]。刘雨芳等[6]、毛润乾[7]、俞晓平等[8]研究发现,稻田周围的杂草地和田埂生境中的捕食性天敌亚群落的相似性较高,对保护稻田捕食性天敌亚群落起了重要作用。田俊策等[9]、朱平阳等[10]、Zhu.p[11]研究表明,在水稻田田埂上种植芝麻花可以显著提高稻田寄生蜂的数量,并降低害虫为害。Lesar[12],在田边种植一些杂草或豆科植物,有利于蜘蛛迁居大豆田。张润志[13]利用棉田边缘苜蓿带,可有效控制棉田棉蚜发生。天敌能在棉田及其边缘杂草上分布与转移,杂草带能有效保护天敌资源,增强天敌对棉花害虫的自然控制能力[14]。【本研究切入点】前期研究发现,棉田边缘苦豆子可以涵养保护天敌[15],但其对棉田内天敌和害虫发生的影响未有系统研究。研究田埂边苦豆子条带对棉田内捕食性天敌发生及其控防作用的影响。【拟解决的关键问题】研究棉田周边苦豆子条带保留对棉田内天敌发生的影响,评价对棉田棉蚜的防治效果,为新疆棉蚜生态治理提供科学依据。
1 材料与方法
1.1 材 料
试验在新疆石河子市石河子大学试验总场三分场二连(E 85°52′26″,N 44°18′37″)、143团13连(E 85°45′14″,N 44°16′56″)、沙湾县乌兰乌苏镇头浮村(E 85°50′23″,N 44°20′34″)共3个站点进行。每个站点选取邻近苦豆子条带棉田、以及没有苦豆子条带棉田各一块,每块棉田面积为(10~50亩),棉花品种为早熟陆地棉新陆早系列。棉花种植模式为一膜六行(行距(66+10)cm,平均行距38 cm),株距10 cm,膜宽为200 cm。
评价3种不同生境:苦豆子条带:棉田田埂边的天然苦豆子杂草带,宽度不小于1 m,长度在10 m以上。处理棉田:紧邻有苦豆子条带的棉田。对照棉田:周边无苦豆子及其他杂草的棉田。整个调查时期,试验棉田不施用任何杀虫剂,其他按照常规管理。
1.2 方 法
1.2.1 捕食性天敌群落组成及种群发生调查
2018年5月29日至9月2日,在棉花苗期至吐絮期进行田间系统调查,每块样地(处理棉田、对照棉田)设置3个重复,每7 d调查一次。对处理棉田、对照棉田,采用随机五点取样。6月22日前,每点选取10株,全株调查;6月22日后,每点选取3株,每株调查上中下3片叶;记录棉蚜及主要捕食性天敌的种类与数量。
2018年5月22日至9月15日调查苦豆子条带,采用扫网(每块地10复网)方法,每7 d调查一次,记录节肢动物群落种类与数量。
1.2.2 捕食性天敌控制作用评价
于2018年7月下旬,在处理棉田及对照棉田,选取长势整齐一致的棉花进行罩笼试验。罩笼的制作和设置参考Fox等(2004)[16]。笼罩规格为40 cm×40 cm×60 cm (长×宽×高)。处理为封闭罩笼,用80目白色纱网全部罩住,完全隔离捕食性天敌。为减少微气候对棉蚜发生的影响,对照设成开放罩笼,即在封闭罩笼的两侧分别划开20 cm×20 cm(长×宽)的孔洞,捕食性天敌可自由通过。
在距两类棉田田边10~20 m处设置罩笼,每块田设置9组,每组为封闭罩笼和开放罩笼各1个,两笼相距1 m,每个笼罩1株棉花。罩笼前清除笼内除棉蚜外的所有节肢动物,棉株上只保留20头无翅成蚜,多余剔除,数量不足则从邻近棉株上补充活蚜,确保每个罩笼内棉蚜数量相同,开放罩笼内也做相同处理。罩笼试验周期为14 d,每7 d调查一次,共调查2次。分别记录封闭和开放罩笼内的棉蚜种群数量。
1.3 数据处理
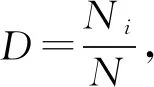
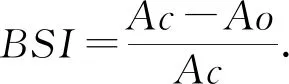
.其中,Ac表示调查时间点罩笼处理内的棉蚜数量;Ao表示同一时间点对照处理(开放罩笼)棉株上棉蚜数量。
瓢虫及草蛉种群数量均为其复合种群中各类成虫与幼虫数量总和,各类天敌及蚜虫种群密度均换算为百株虫量。
对不同生境(苦豆子条带、处理棉田、对照棉田)中的捕食性天敌种群密度差异进行单因素方差分析(One way ANOVA),多重比较采用LSD(Least significant difference)法进行。由于田间昆虫种群密度的季节性变化受前一次数量的影响,属于随时间点重复测量性质的数据,数据不满足独立性,需要采用混合效应线性模型(Linear mixed effects model)进行分析。另外,采用独立样本T检验(Ttest)比较封闭罩笼与对照(开放罩笼)处理中棉蚜种群数量差异。
所有数据在分析前均进行对数转换Log10(N+1),以使其满足正态性与方差齐性。重复测量数据分析(Proc mixed)通过SAS 9.4软件进行[18],单因素方差分析与T检验均通过SPSS 20软件[19]进行,采用Origin 9.0软件绘图。
2 结果与分析
2.1 不同生境中捕食性天敌群落季节性分布
研究表明,棉田中捕食性天敌主要种类有瓢虫、草蛉、蜘蛛及食虫蝽。瓢虫类主要有多异瓢虫HippodamiavariegataGoeze、方斑瓢虫PropylaeaquatuordecimpunctataL.、深点食螨瓢虫StethoruspunctillumWeise;草蛉类主要有普通草蛉ChrysopacarneaStephens、大草蛉ChrysopapallensRamber、丽草蛉ChrysopaformosaBrauer;蜘蛛类主要有草间小黑蛛ErigonidiumgraminicolumSundevall、黄褐新园蛛NeosconedoenitziBoes.etStr.、三突花蛛MisumenopstricuspidatusFahricius;食虫蝽主要有小花蝽Oriusspp.、华姬蝽NabissinoferusHsiao。四类主要捕食性天敌中多异瓢虫、普通草蛉、草间小黑蛛、小花蝽为棉田主要优势种群,苦豆子条带上优势捕食性天敌种类与棉田相同,群落结构相似。
不同生境中的优势捕食性天敌种群密度随生长季节而变化。6月,苦豆子条带上各类捕食性天敌均显著高于棉田。三种生境中瓢虫种群密度8月无差异(F=1.74,df= 2, 14,P= 0.439),6和7月以及整个生育期均有显著差异(6月:F= 5.70,df= 2, 20,P= 0.011;7月:F= 4.14,df= 2, 14,P= 0.043;整个生育期:F= 5.38,df= 2, 50,P= 0.031)。其中6、8月和整个生育期的苦豆子条带上瓢虫种群密度最高;7月处理棉田上瓢虫种群密度均为最高(图1A)。不同生长季节,苦豆子条带中的草蛉种群密度均为最高,7和8月苦豆子条带和处理棉田显著高于对照棉田(7月:F= 4.99,df= 2, 14,P= 0.024;8月:F= 4.57,df= 2, 14,P= 0.027),6月和整个生育期中苦豆子条带上草蛉种群密度显著高于处理与对照棉田(6月:F= 9.22,df= 2, 20,P= 0.002;整个生育期:F= 6.72,df= 2, 50,P= 0.003)(图1B)。在不同生长季节及整个生育期,苦豆子条带中的蜘蛛种群密度均显著高于处理棉田与对照棉田(6月:F= 16.51,df= 2, 20,P< 0.001;7月:F= 4.87,df= 2, 14,P= 0.018;8月:F= 4.57,df= 2, 14,P= 0.029;
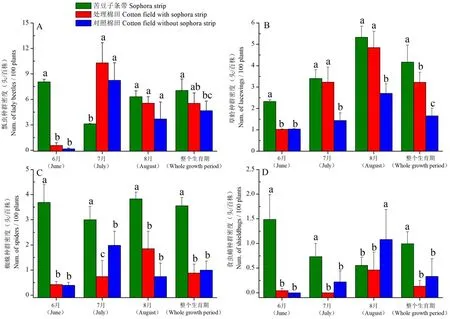
注:A.瓢虫;B.草蛉;C.蜘蛛;D.食虫蝽。数值为均值±标准误,单个季节不同小写字母表示差异显著(P< 0.05)
Note: A.lady beetles; B.lacewings ; C.spiders;D.shieldbugs.The value is Mean±SE, different lowercase letters in the same period mean significant difference (P< 0.05)
图1 不同生境间捕食性天敌种群密度
Fig.1 Population density of predatory natural enemies in different habitats
整个生育期:F= 19.80,df= 2, 50,P< 0.001)(图1C)。除8月外,在6、7月及整个生育期,苦豆子条带中的食虫蝽种群密度均显著高于处理棉田与对照棉田(6月:F= 6.73,df= 2, 20,P= 0.007;7月:F= 4.52,df= 2, 14,P= 0.019;整个生育期:F= 4.88,df= 2, 50,P= 0.044),8月对照棉田内的食虫蝽种群密度显著高于苦豆子条带及处理棉田(F= 4.69,df= 2, 14,P= 0.012)(图1D)。图1
2.2 不同生境中主要捕食性天敌优势度
研究表明,苦豆子条带上各类捕食性天敌优势度均最高,瓢虫、草蛉、蜘蛛、食虫蝽这几类天敌优势度均显著高于处理棉田和对照棉田(瓢虫:F= 5.21,df= 2, 50,P= 0.009;草蛉:F= 45.52,df= 2, 50,P< 0.001;蜘蛛:F= 48.19,df= 2, 50,P< 0.001;食虫蝽:F= 21.58,df= 2, 50,P< 0.001),在处理棉田与对照棉田间除草蛉优势度有差异外(处理棉田高于对照棉田),其他捕食性天敌均无显著差异。图2

注:图中数据为平均值±标准误,不同小写字母表示同一类天敌在不同生境间差异显著(P< 0.05)
Note: The data in the figure were Mean±SE, different lowercase letters above the bars indicated significant difference among different habitats (P< 0.05)
图2 三种生境中捕食性天敌优势度
Fig.2 Dominance of predatory natural enemies in three habitats
2.3 两类棉田中棉蚜和主要捕食性天敌种群消长及益害比
两类棉田中棉蚜的发生动态变化一致,大体呈现为先上升后下降的趋势,两种棉田(处理棉田、对照棉田)棉蚜在整个生育期中仅出现一次高峰期,分别为7月10日、7月17日,棉蚜种群密度在两类棉田呈现显著的季节性波动(F= 9.47,df= 16, 44,P< 0.001),但两类棉田之间棉蚜种群密度无显著差异(F= 0.00,df= 1, 9,P= 0.974)(图3A)。捕食性天敌瓢虫、草蛉、蜘蛛具有明显的“滞后效应”。
不同棉田中瓢虫种群发生高峰期不同,处理棉田上高峰期时间为7月上旬,而对照棉田上到达高峰期的时间为7月下旬,高峰期时瓢虫种群密度最高可达22头/百株。瓢虫种群密度在两类棉田呈现显著的季节性波动(F= 10.02,df= 16, 43,P< 0.001),但整个生长季节不同棉田之间并无显著差异(F= 2.64,df= 1, 9,P= 0.139)(图3B)。草蛉种群密度在不同棉田中也呈现显著的季节性波动(F= 2.16,df= 16, 43,P= 0.023),且两种不同类型棉田中显著差异(F= 8.74,df= 1, 9,P= 0.016)。7月上中旬,处理棉田上草蛉种群密度明显高于对照棉田(图3C)。在8月下旬,处理棉田上草蛉种群密度最高为10头/百株。蜘蛛种群密度在不同类型棉田中均呈现显著的的季节性波动(F= 2.34,df= 16, 43,P= 0.014),但不同棉田之间并无显著差异(F= 0.66,df= 1, 9,P= 0.438)。蜘蛛类天敌与棉蚜的追随效应较瓢虫及草蛉发生滞后(图3D),种群密度相对较低,最高为5头/百株,对棉蚜的控害作用可能远不及瓢虫和草蛉明显。图3
注:A.棉蚜;B.瓢虫;C.草蛉;D.蜘蛛;E.益害比。棉蚜和各捕食性天敌(图3A-D)为平均值经log10(N+1)转换后的数据,单位均为(头/百株)
Note: A.A.gossypii;B.lady beetles;C.lacewings;D.spider;E.Enemy / pest index.A.gossypiiand predators (Fig 3 A-D) are the average number after the transformation of log10(N+1)
图3 棉蚜和主要捕食性天敌种群消长动态及益害比
Fig.3 Population dynamics ofAphisgossypiiand the main predators, as well as their enemy / pest index analysis
在两类棉花中,6月上旬益害比值较高,之后随着棉田中棉蚜急剧爆发(6月中下旬)益害比迅速下降,一直处于较低水平,因此,益害比在不同类型棉田的季节性波动不明显(F= 1.51,df= 15, 30,P= 0.163),不同棉田之间益害比无显著差异(F= 0.12,df= 1, 9,P= 0.739)。6月,处理棉田上益害比高于对照棉田;7月,棉蚜高峰期时处理棉田和对照棉田上益害比均维持在较低水平,为1∶400~500;8月随着天敌大量转入棉田,棉蚜种群数量开始下降,益害比升高至1∶200以上,且处理棉田上益害比高于对照棉田(图3E)。进入8月中旬,天敌对于棉蚜的控制作用增强,与棉田棉蚜发生量逐渐降低的变化趋势相吻合。图3
2.4 主要捕食性天敌控害作用评价
研究表明,封闭笼罩由于排除天敌昆虫,棉蚜种群密度迅速增加,罩笼后14 d棉蚜种群密度要明显高于第7 d。而开放罩笼中棉蚜由于外界天敌的捕食作用,种群增长受到抑制。处理棉田中,封闭罩笼7 与14 d后的单株棉蚜种群数量均显著高于开放罩笼(7 d:t = 2.87,df= 1, 136,P= 0.005;14 d:t = 12.66,df= 1, 173,P< 0.001)(图4A)。对照棉田中,封闭罩笼7与14 d后的棉蚜种群密度也显著高于开放罩笼(7 d:t = 2.67,df= 1, 90,P= 0.009;14 d:t = 5.42,df= 1, 36,P< 0.001)(图4B)。
处理棉田与对照棉田相比,罩笼7 d后的生物控害指数(BSI)并无显著性差异(t = 0.72,df= 1, 66,P= 0.473),而罩笼14 d的控害指数差异极显著(t = 3.37,df= 1, 20,P< 0.001)。处理棉田罩笼14 d的BSI指数显著高于对照棉田,其控害指数(BSI)分别为0.87、0.64。苦豆子条带的存在显著提高了捕食性天敌对相邻棉田棉蚜的控制作用。图4

注:A.有苦豆子条带的处理棉田;B.没有苦豆子条带的对照棉田;C.生物控害指数(BSI)。数值为均值±标准误,**表示差异极显著(P< 0.01), ns为无显著差异(P> 0.05)。(图4 A-B)蚜虫密度为平均值经log10(N+1)转换后的数据,单位均为(头/株)
Note: A.Cotton field with sophora strip; B.Cotton field without sophora strip; C.Biocontrol Services Index (BSI).The value is Mean±SE, ** indicates significant differences at 0.01 level, “ns”indicates no significant difference at 0.05 level.(Fig 4 A-B) Aphids data are the average number after the transformation of log10(N+1)
图4 捕食性天敌生物控害作用效果Fig .4 Biological control effect of predators on aphids.
3 讨 论
以生物防治为核心的害虫综合治理越来越受到重视[20, 21]。目前,通过构建作物-害虫-天敌的储蓄植物系统,加强此地重要天敌应用、自然天敌资源的科学保育与利用是进行生物防治的重要手段之一。非作物生境中植被和物种多样性对天敌的保护和利用及害虫种群数量的生态调控已有很多研究[22-24]。虽然利用植物为天敌生存和繁衍提供有利条件,可以增强不同种类天敌的丰富度[25],但天敌的多样性和适合度的提高并不必然意味着害虫种群降低[26],关键在于作物与非作物生境间天敌种类是否具有相似性及相同的控害功能。
苦豆子条带作为庇护所对天敌具有一定的保护和增殖功能,天敌储量显著高于棉田。棉田及其周边生境的优势天敌种类为瓢虫、草蛉、蜘蛛、食虫蝽,与冯宏祖等[27-29]研究结果相似。研究发现,苦豆子条带上6~8月各类捕食性天敌优势度均明显高于棉田;各类天敌与棉田棉蚜的发生规律符合“时滞效应”,其中瓢虫和草蛉类天敌对棉蚜种群控制起主导作用[30, 31]。6月处理棉田中的益害比明显增高;7月,由于田间棉蚜爆发,种群数量急剧增加,不同类型棉田中益害比均维持在较低水平;8月,棉田中各类捕食性天敌丰富度高,棉蚜数量降低,益害比增加,且处理棉田益害比高于对照棉田。这表明留种苦豆子条带是保育自然天敌、促进棉田生物控害功能提升的一种有效措施。但同时发现,处理棉田中棉蚜种群密度仍高于防治指标,这说明需要结合使用对天敌安全的选择性杀虫剂等其他措施,从而有效控制棉田棉蚜的整体发生为害。
研究表明,捕食性瓢虫具有取食花粉等植物组织的行为习性[32],苦豆子作为显花植物,花期为5~6月,可以为天敌提供花粉、花蜜。在苦豆子杂草覆盖度高的单一群落生境中,温、湿度变化波动小,可能是天敌昆虫理想的天然栖息地。由于瓢虫与草蛉等天敌活动范围大,在棉田与功能性杂草生境间存在迁移行为[33]。田间调查发现,草蛉在静伏时段明显趋向苦豆子生境,其杂草带分布面积越大,条带越宽草蛉密度越高。苦豆子条带对天敌发生分布及其向棉田转移扩散的调控作用机制,有待进一步研究。
4 结 论
棉田周边苦豆子条带上主要优势天敌种类与棉田相似,且天敌数量丰富,对自然天敌具有涵养、保护和增殖作用,增加了棉田天敌数量。同时,棉田边缘苦豆子条带的存在使棉田中天敌发生提前,发生高峰期提前1周左右。棉田周边留种苦豆子条带能明显促进棉田生态系统中天敌的发生及其对蚜虫的自然控制作用,可以作为棉田蚜虫综合防治中的一项有效措施。
