氮添加对油松细根分解过程中酶活性的影响
2019-05-21王国梁刘国彬
孟 敏, 景 航, 姚 旭, 王国梁,2†, 刘国彬,2
(1.西北农林科技大学水土保持研究所,712100,陕西杨凌; 2.中国科学院 水利部 水土保持研究所,712100,陕西杨凌)
植物每年投入净初级生产力的22%~67%到根系当中,细根分解将会使大量的物质能量从植物体转入到土壤当中[1]。相关研究表明,细根分解产生的物质能量可能大于地上凋落叶[2- 3]。近年来,细根分解研究已成为全球C、N等养分循环,尤其全球C平衡的核心环节[4]。关于细根分解目前的研究主要有以下几方面:首先随着时间增加,细根分解速率不断发生变化,总体表现为前期快而后期慢的趋势[5- 7];其次,不同粗细的根系分解速率有所差异,以前的研究发现较细的根系分解快于较粗的根系[8-10],但是越来越多的研究指出较粗的根系分解速率也可能快于较细的根系[5,11],结果主要取决于具体的植被和生态系统类型;最后,环境变化对细根分解产生不同的影响,Song Xinzhang等[12]的研究发现3 g/(m2·a)水平N添加加速了竹林细根分解,而≥6 g/(m2·a)水平N添加会降低竹林细根分解速率,结果取决于N添加量和本地区的N含量背景值。在影响细根分解的环境因素中,土壤有效N的影响日益引起生态学家的关注[13]。这是因为在全球范围内大气N沉降持续增加的情况下,土壤有效N可通过影响细根分解过程改变生态系统碳在土壤、植物和大气等主要碳库的分配格局,进而影响全球生态系统的碳平衡和养分循环过程[12,14]。
从根本上来说,细根是在水分淋溶、土壤动物破碎以及微生物酶的作用下分解的,其中微生物的酶解作用最为直接也最为重要[15]。纤维二糖酶也称β-葡萄糖苷酶,它能将大分子纤维素降解为小分子糖以便于微生物利用。碱性磷酸酶普遍存在于土壤当中,它与土壤及植株体内有机磷的分解和再利用有着密切的关系。纤维二糖酶和碱性磷酸酶是参与土壤植物残体碳、磷等转化的重要水解酶类[16]。另外,半乳糖苷酶在土壤中的含量也较高,它能降解植物体含半乳糖苷的胞壁多糖,释放游离的半乳糖,从而被微生物吸收利用[17];可见,酶在细根分解过程中扮演着不可替代的角色。一般情况下,影响分解酶活性的主要因素有温度、细根水分以及细根质量等[18]。目前研究的热点中,径级、时间以及环境变化等对细根分解的影响都有可能通过酶来产生作用,因此研究酶活性的变化特征可以揭示分解速率随细根径级、分解时间以及环境变化的潜在机制,为预测细根分解如何影响全球C、N等养分循环研究提供依据;但是,目前关于细根分解酶活性的研究还比较薄弱,相关研究集中在地上凋落物与农地管理变化方面[17,19- 20]。关于不同径级细根分解过程酶活性的特征以及对环境N添加的响应情况还鲜有报道。通过阐明不同径级细根分解酶活性对N添加的动态响应过程,可以完善细根分解机制中的微生物作用部分,并为今后生态系统与全球气候变化研究提供参考。
油松(Pinustabulaeformis)林下土壤养分相对贫瘠,土壤有效N质量分数偏低,是研究土壤有效N升高如何影响植物细根分解酶活性最理想的森林生态系统之一;因此,本研究以黄土高原油松为研究对象,通过动态监测不同径级油松细根分解酶活性变化,以及可能影响酶活性的主要因素,期望为细根分解机制研究提供参考,为N沉降变化影响碳循环研究提供依据。
1 研究区概况
实验在延安市宜川县铁龙湾林场松峪沟流域(E 110°06′, N 35°39′)进行。该地区具有典型大陆季风型气候,年平均降水量584.4 mm,年平均气温9.7 ℃,无霜期180 d。研究区海拔为1 000~1 200 m,坡度为20°~25°。油松是黄土高原森林区最大的人工林种之一,可用于研究N添加对细根分解的影响。实验区油松林于1963年种植,目前保存1 400~1 800 株/hm2,林龄为50年。该林分平均郁闭度0.7,林分蓄积量75.5 m3/hm2,叶面积指数6.34。2015年11月对样地进行了植被调查,测定表层0~10 cm土壤有机碳、全氮和全磷质量分数,测定结果见表1。乔木层、灌木层和草本层生物量分别为112.96、3.56和8.28 t/hm2。植物群落种群有20多种,多样性指数为0.51(用Simpson法计算)。林下灌木主要有胡颓子(ElaeagnuspungensThunb)、黄刺玫(RosaxanthinaLindl)、绣线菊(Spiraeasalicifolia)、忍冬(LonicerajaponicaThunb)、荚迷(ViburnumdilatatumThunb)等,覆盖度30%;草本植物主要为大披针苔草(CarexlanceolataBoott),覆盖度30%~50%。

表1 人工油松林样地基本概况Tab.1 Basic characteristics ofPinus tabulaeformisplantation
注:不同小写字母表示氮添加处理之间达到显著差异水平(P<0.05);N0、N3、N6和N9表示氮添加水平分别为: 0、3、 6和9 g/(m2·a)。 Notes: Different lowercase letters indicate the significant difference at 0.05 level. N0, N3, N6, and N9 are 0, 3, 6, and 9 g/(m2·a) respectively. DBH: Diameter at breast height.
2 材料与方法
2.1 细根样品收集
2014年3月,在1年生油松苗圃建立16块细根收集实验田(3 m×3 m)。同时,在油松林中建立16块细根分解实验林(10 m×10 m)。细根收集实验田与分解实验林具有相同的气候条件。细根收集实验田和细根分解实验林均采用多水平的N添加处理:0、3、6和9 g/(m2·a)(分别称为N0、N3、N6和N9处理)。细根收集实验田和细根分解实验林每个N添加处理有4个重复。自2014年以来,硝酸铵(NH4NO3)溶解于蒸馏水中(每个细根分解实验林10 L,每个细根收集实验田1 L),并在每年4、6、8和10月中降雨前1天均匀喷洒于每个地块(每次喷洒每年1/4的N添加量)。N添加2年后(2015年10月),从16块细根收集实验田表层80 cm土壤中收集3种直径油松细根(0~0.5 mm,>0.5~1.0 mm和>1.0~2.0 mm)。将所有细根在自来水中快速洗涤,然后在去离子水中快速洗涤以除去黏附的土壤颗粒,之后将它们在55 ℃下烘干数天至恒质量。将细根切成约3 cm长,保存用于分解实验。
2.2 细根分解实验
本实验采用分解袋法研究细根分解酶活性和养分含量变化。分解袋(10 cm×10 cm)由0.1 mm网孔尼龙网制成。将收集的细根样品(10.00 g)放入分解袋后缝合。2015年11月,在每个细根分解实验林布设相应N添加处理的细根,每个细根径级布设5个重复分解袋用于5次取样。根据细根在土壤中的分布范围和相关研究实验设计的基础,布设时在土壤中45°角开1个10 cm深的槽,将分解袋埋入。总共每个N添加处理(3个细根径级 × 5次取样 × 4个重复样地)布设60个分解袋,实验中总共240个分解袋。
分解袋布设完成2、4、6、8和10个月后,从每个样地中随机收集3个径级细根分解袋样品。将收集的分解袋迅速运送到实验室,用刷子清洁粘附土壤。随后将样品分2部分保存,其中一部分记录质量后-20 ℃保存用于酶活性测定,另一部分样品在55 ℃下烘箱干燥数天至恒质量,之后记录其含水率和干质量,然后研磨用于有机碳、全氮、全磷元素质量分数分析。每次取样时还需要用温度计记录分解袋周围温度。
2.3 测定项目与方法
细根分解酶活性(μmol/(g·h))测定参考土壤酶活性测定方法,主要有3种酶:纤维二糖酶、碱性磷酸酶和半乳糖苷酶。酶活性测定采用四甲基伞形酮与七甲基香豆素相关水合物分解荧光法测定[18]。将细根样品彻底剪碎混匀,准确称取1 g加入相当于土壤pH的0.05 nmol/L醋酸- 醋酸铵缓冲液125 mL,震荡30 min,吸取悬浊液150 μL入黑色96孔板,同时加入50 μL底物(不同种类酶活性测定对应的底物种类不同),每次实验做无基质对照(150 μL悬浊液+50 μL缓冲液)、空白对照(200 μL缓冲液)。保持恒温37 ℃培养并计时等待,经过2 h后选择仪器为多功能酶标仪,将其设定波长为450 nm和365 nm,放入板后运行并读取其吸光值。标准曲线选择四甲基伞形酮制作,之后作为依据获得酶的活性数据。
有机碳质量分数(mg/g)测定采用重铬酸钾氧化法[21];氮质量分数(mg/g)测定采用凯氏定氮法[22];磷质量分数(mg/g)测定采用钼锑抗比色法[23]。
2.4 数据处理与分析
使用SPSS 20.0统计软件包进行统计学分析。不同N添加处理之间酶活性差异采用单因素方差分析(one-way ANOVA)。采用3因素方差分析(three-way ANOVA)对N添加、细根径级以及分解时间对酶活性的影响进行比较。酶活性与细根物理化学质量指标间的关系采用Pearson相关分析。
3 结果与分析
3.1 细根分解过程中酶活性变化
纤维二糖酶活性在0.055~0.433 μmol/(g·h)范围内,碱性磷酸酶活性在0.071~0.463 μmol/(g·h)范围内,半乳糖苷酶活性在0.046~0.463 μmol/(g·h)范围内(图1)。细根分解前期120 d内纤维二糖酶活性微弱增加,120~240 d逐渐减小,而240 d以后又有微弱增加。碱性磷酸酶和半乳糖苷酶活性随细根分解时间增加先增加后减小,在分解180 d时酶活性最高。N添加对不同种类酶活性的影响有所差异。分解第60、120、240天N3显著促进了0~0.5 mm细根纤维二糖酶活性,分解第180和300天N3显著促进了>0.5~1.0 mm细根纤维二糖酶活性,分解第120和300天N9显著促进了>1.0~2.0 mm细根纤维二糖酶活性。整个分解周期内N添加对0~0.5 mm细根碱性磷酸酶活性的影响不显著,对>0.5~1.0 mm以及>1.0~2.0 mm细根碱性磷酸酶活性的影响在不同分解时间变化较大。分解第60和100天N添加抑制0~0.5 mm细根半乳糖苷酶活性,分解第60和300天N9抑制了>0.5~1.0 mm细根半乳糖苷酶活性,分解第60和180天N9抑制了>1.0~2.0 mm细根半乳糖苷酶活性。
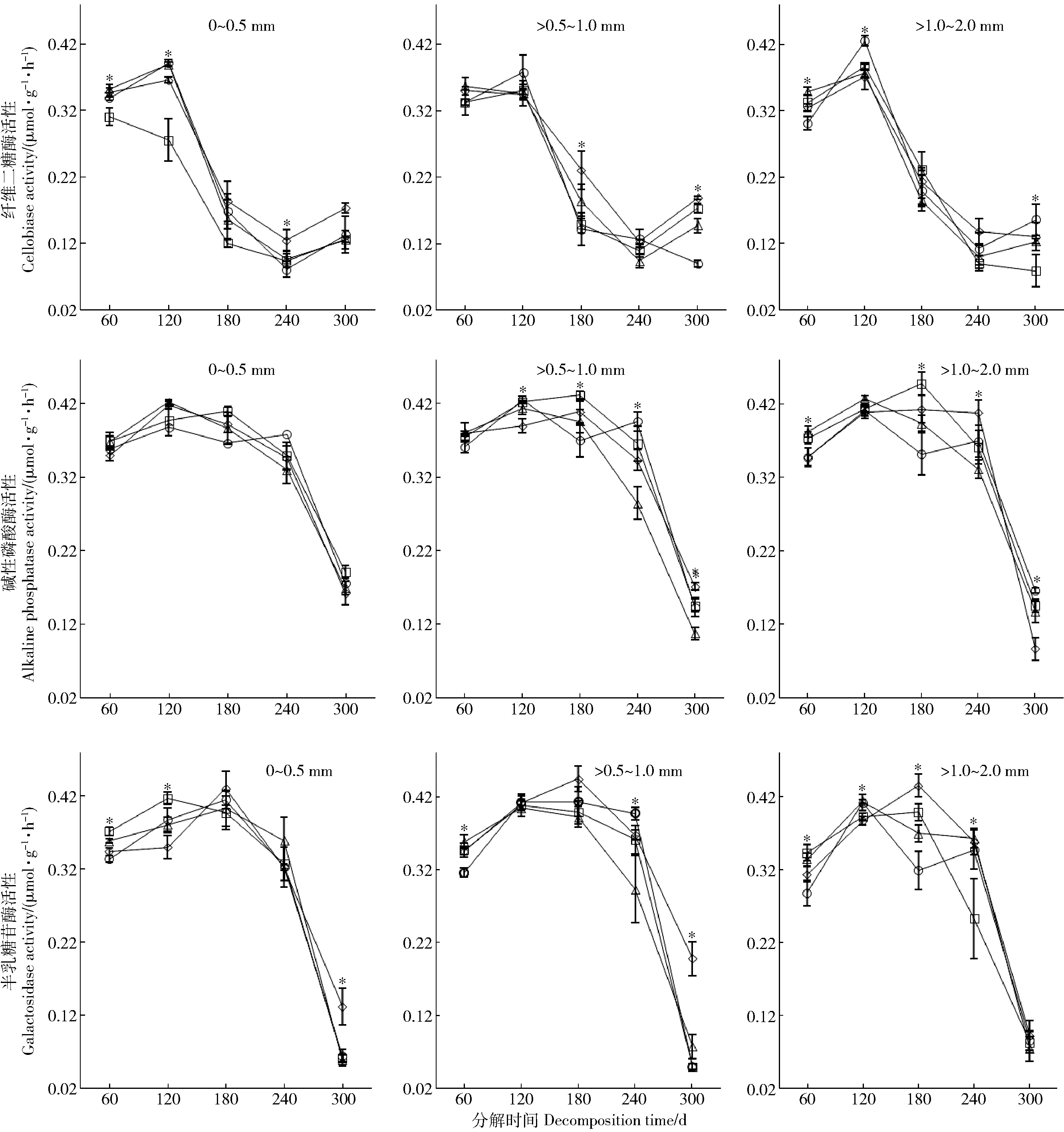
数据点上方“*”表示不同N处理之间有显著差异,N0(□)、N3(◇)、N6(△)和N9(○)分别表示N处理水平0、3、6和9 g/(m2·a)。Notes: The *above each sample dot indicates a significant difference between the N treatments. N0, N3, N6, N9 represent N addition level 0, 3, 6, and 9 g/(m2·a). The same below.图1 不同施氮处理下油松不同径级细根酶活性动态Fig.1 Dynamics of enzyme activity of different-diameter fine roots ofPinus tabulaeformisin different treatments
3.2 不同变异因素对细根分解酶活性的影响
表2总体反映N添加、分解时间和细根径级对酶活性的影响。可以看出,N添加显著改变了纤维二糖酶和半乳糖苷酶活性(P<0.05),但对碱性磷酸酶活性没有显著影响。随着细根分解时间增加,3种酶活性都有极显著变化(P<0.01)。不同径级细根分解过程中半乳糖苷酶活性有显著差异,但碱性磷酸酶和纤维二糖酶活性差异不明显。N添加和分解时间交互作用对3种酶活性影响显著,时间与细根径级交互作用对纤维二糖酶和半乳糖苷酶活性影响显著,而N添加、分解时间以及细根径级3个变异因素交互作用对半乳糖苷酶活性有极显著影响。
3.3 细根物理化学性质对酶活性的影响
细根分解过程中3种酶活性与C、N、P元素质量分数以及N与P质量比均有显著相关关系(P<0.05),其中与N与P质量比极显著负相关(P<0.01),其余为显著正相关(表3)。碱性磷酸酶和半乳糖苷酶活性与细根水分含量极显著正相关,纤维二糖酶活性与温度极显著负相关。不同种类酶活性之间均有显著正相关关系,其中碱性磷酸酶活性和半乳糖苷酶活性之间的相关性最强。

表2 不同径级细根酶活性方差分析Tab.2 Variance analysis of enzyme activities at different fine root diameters
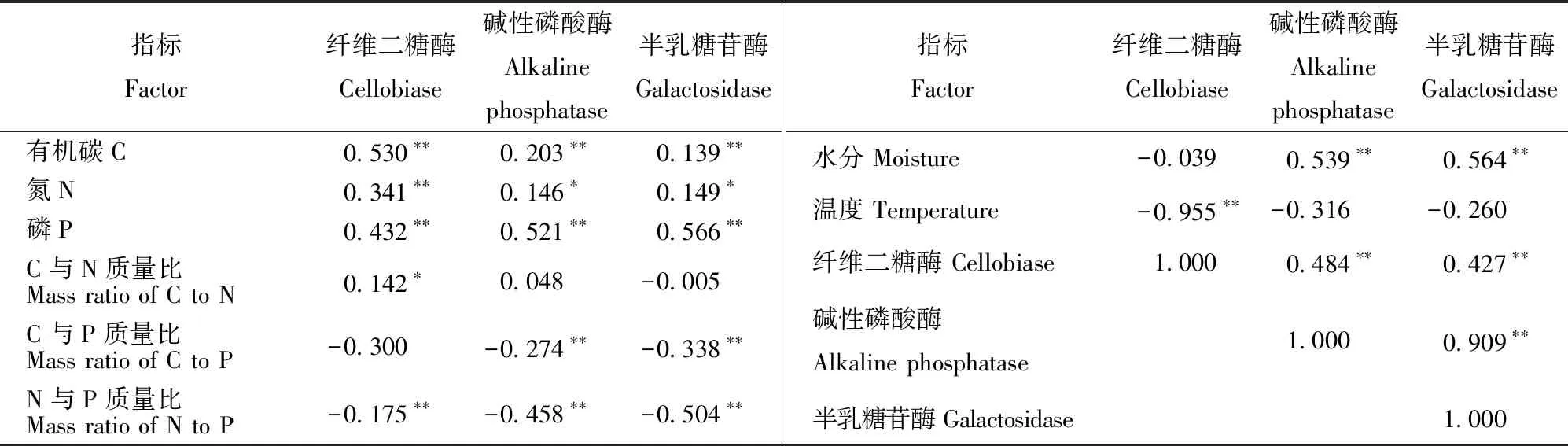
表3 细根物理化学性质与酶活性相关分析Tab.3 Correlations between enzyme activity and fine root physiochemical property
注:数据上方“*”表示两者之间有显著相关关系(P<0.05),“**”表示两者之间有极显著相关关系(P<0.01)。Notes: The “*” above the data indicates a significant correlation between the variables, and “**” indicates a very significant correlation between two variables.
4 讨论
4.1 N添加对细根分解酶活性的影响
我们的研究中纤维二糖酶活性在0.055~0.433 μmol/(g·h)范围内,碱性磷酸酶活性在0.071~0.463 μmol/(g·h)范围内,半乳糖苷酶活性在0.046~0.463 μmol/(g·h)范围内,这些结果与前人的研究结果[24- 26]一致。随着细根分解时间增加,不同种类酶活性变化趋势有所差异。纤维二糖酶分解前期活性增加,中期逐渐减小,后期又微弱增加。碱性磷酸酶和半乳糖苷酶活性在整个分解周期内先增加后减小,在中期时活性最高。相比而言,洪慧滨等[25]的研究从4月开始,米槠和杉木细根分解纤维二糖酶活性前期迅速升高,而后迅速降低,最后趋于缓和,宁南山区草本植物茎叶分解过程中其周围土壤碱性磷酸酶活性呈现出先增加后减小的趋势[27]。另外,从3月开始对农田土壤加入有机质进行分解,土壤半乳糖苷酶活性前期增加迅速,后期则趋于缓慢降低[28]。研究表明对于不同种类的酶,其活性在分解过程中变化趋势差异较大。这主要是由于酶活性十分敏感容易受到环境因素变化的影响,如温度、水分、凋落物质量、土壤结构以及酸碱度等,并且不同种类酶活性对环境变化的耐受能力也有所不同,导致在不同的研究中,酶活性随分解过程的变化趋势差异很大。我们的实验开始于11月,此时植物凋落物大量产生,秋季环境温度、水分条件等明显发生变化。细根分解实验从这一时期开始能够较完整的模拟自然环境减少人为误差,其分解酶活性动态过程更加接近真实情况;因此证实细根分解过程中不同种类酶活性变化趋势差异较大,并且不同研究中分解酶活性变化趋势会因为温度、水分、凋落物质量等环境因子而有所不同。
N添加对不同种类酶活性的影响有所差异。低N(N3)促进0~0.5 mm和>0.5~1.0 mm细根纤维二糖酶活性,高N(N9)促进>1.0~2.0 mm细根纤维二糖酶活性;N添加对0~0.5 mm细根碱性磷酸酶活性的影响不显著,对>0.5~1.0 mm以及>1.0~2.0 mm细根碱性磷酸酶活性的影响在不同分解时间变化较大。N添加抑制0~0.5 mm细根半乳糖苷酶活性,高N添加(N9)抑制>0.5~1.0 mm和>1.0~2.0 mm细根半乳糖苷酶活性。总体表现为低N促进较细细根纤维二糖酶活性,高N促进较粗细根纤维二糖酶活性;N添加抑制较细细根半乳糖苷酶活性,高N抑制较粗细根半乳糖苷酶活性。多重比较分析的结果表明:N 添加显著改变了纤维二糖酶和半乳糖苷酶活性(P<0.05),但对碱性磷酸酶活性没有显著影响。并且存在N添加与分解时间之间的交互作用对酶活性的影响有所差异。同样,对沼泽湿地小叶章凋落物的研究也发现N添加对分解酶活性的影响会因为酶种类以及时间而有所差异[29]。王晖等[30]通过总结近年来国内外模拟N沉降影响凋落物分解酶活性的研究发现,由于酶种类、凋落物质量等差异,N沉降增加对纤维素酶类、木质素酶类以及蛋白水解酶类的影响差异较大,这与本研究的结果保持一致。不同的是,王晖等人的研究指出随着N沉降增加,磷酸酶类活性总体会随之增加,而本研究中N添加对碱性磷酸酶的活性影响不显著。出现这种差异可能与N添加处理时间有关,模拟N沉降是一个长期过程,我们的N添加实验持续2 年(时间较短),短期N添加对一些生态过程的影响还不够明显,比如土壤呼吸、微生物群落组成[31- 32];但是随着N添加时间的增加,土壤有效N质量分数升高的效应可能会逐渐明显,我们的研究将持续关注。
4.2 细根物理化学性质对酶活性的影响
不同种类酶活性之间均有显著正相关关系,并且碱性磷酸酶活性和半乳糖苷酶活性之间相关性最强。此结果符合碱性磷酸酶活性和半乳糖苷酶活性随分解时间有相似变化的规律,并证实参与细根分解的各种酶并不是单独作用的,它们之间不仅显示出专有性特点,同时也存在共性关系[29]。影响分解酶活性最常见的因素包括温度、水分以及细根质量等[30]。相关性分析表明:1)在N添加条件下,3种酶活性与细根分解过程中C、N、P质量分数以及N与P质量比显著相关(P<0.05),其中与N与P质量比极显著负相关(P<0.01),其余为显著正相关。这与前人的研究[17,33]一致,研究表明外界环境变化能够通过影响细根质量进而改变其分解速率与酶活性[17,30]。2)本研究显示N添加能够通过提高主要养分含量(C、N、P等)促进细根酶解过程。N与P质量比与分解酶活性之间显著负相关,可能是微生物在N添加环境里更需要P导致的。3)另外,酶活性与温度、水分条件的相关性分析发现,碱性磷酸酶和半乳糖苷酶活性与细根水分含量极显著正相关,纤维二糖酶活性与温度极显著负相关。这与相关研究一致[17,34],温度对细根分解酶活性具有不同程度的影响,这主要取决于酶本身的性质。通过比较酶活性与温度、水分以及细根质量之间的相关性发现,不同种类酶活性与细根质量之间的相关性较为统一,而与温度和水分之间的相关性变异较大。也就是说在N添加条件下,细根质量是影响各种分解酶活性的普遍因素,而温度和水分的作用效果因酶种类不同而有所差异。
5 结论
1)细根分解过程中不同种类酶活性的变化趋势有所差异。也就是说在细根分解不同阶段中,参与分解的酶种类和活性可能不同。
2)N添加对酶活性的影响总体表现为:低N促进较细细根纤维二糖酶活性,高N促进较粗细根纤维二糖酶活性;N添加抑制较细细根半乳糖苷酶活性,高N抑制较粗细根半乳糖苷酶活性,但是N添加对碱性磷酸酶活性影响不显著。N添加对酶活性的影响会由于酶种类、分解时期以及细根径级而有所差异。
3)在N添加影响各种酶活性的过程中,细根质量的作用较为一致,而温度和水分的作用差异明显。
