沙尘和灰霾对西北太平洋浮游植物群落结构变化的影响❋
2019-05-21贺敬怡牟英春石金辉高会旺
贺敬怡, 张 潮, 牟英春, 褚 强, 石金辉,, 高会旺,,3❋❋
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100; 2.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;3.青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,山东 青岛 266071)
大气沉降可以为上层海洋提供营养盐和微量元素,因此对海洋中浮游植物的生长及群落结构产生重要影响[1-3],进而改变海洋碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程[3-4]。大气沉降对海洋生态系统的影响具有复杂性,一方面,大气沉降物中包含的N、P等主要营养盐以及铁(Fe)、锌(Zn)等微量元素对海洋浮游植物生长具有促进作用[5-6];另一方面,人为源主导的大气沉降物中铜(Cu)、镍(Ni)、铅(Pb)等重金属及有毒有机物(如菲、芘等)含量较高,可能会对浮游植物生长产生毒性作用[7-8]。近年来,日益增加的人为排放对大气中的气体或颗粒物的组成产生重要影响,大气沉降对海洋生态系统的影响逐渐得到人们的关注,但具体机制尚不明确。
来自中国沙源地的沙尘气溶胶在大气环流的作用下,可以被长距离输送到中国近海及北太平洋[9]。研究表明,亚洲沙尘每年向北太平洋的输入量约为480 Tg[10],占到亚洲沙尘总沉降量的50%左右。随着亚洲经济的快速发展,人为活动对大气沉降组成及通量的影响日益明显。据统计,人为排放的N所导致的大气沉降增加了北太平洋海水中的N存量,并可能使浮游植物的营养盐限制状态发生改变[11]。而日益增加的Cu的沉降量可能对北太平洋海域浮游植物的生长产生毒性效应[8]。
在黄海寡营养区进行的现场培养实验发现,添加沙尘能够首先促进小型浮游植物(>20 μm)生物量的增加,至实验8天后,微型(2~20 μm)和超微型浮游植物(0.2~2 μm)才出现显著增长[12]。在南黄海北部的培养实验发现,灰霾对小型浮游植物生长有明显抑制作用,灰霾添加组小型浮游植物叶绿素a浓度最大值仅为对照组的50%,至实验后期,降至对照组的5%左右[13]。东海海域的气溶胶添加实验发现,浮游植物对不同来源的气溶胶的响应具有差异,浮游植物叶绿素a浓度与气溶胶中Fe/Cu比呈显著正相关(R2=0.9)[14]。南海进行的培养实验中,在4 L表层海水中加入5 mL气溶胶,实验第3天或第4天后,浮游植物群落结构发生变化,粒径大于20 μm叶绿素a浓度快速升高,硅藻成为优势群落[15]。在西北太平洋副热带环流区的培养实验发现,添加2 mg·L-1沙尘至20 L海水的培养系统中,可以使以硅藻为主的小型浮游植物(>5 μm)在5天之内达到最大值,其细胞丰度是对照组的1.8~3.9倍[16]。
随着亚洲经济的持续快速发展,西北太平洋海域受人为大气污染的影响日益严重。本文通过4次船基围隔培养实验,研究了西太平洋黑潮亲潮混合区和副热带寡营养区浮游植物对大气沉降的响应,重点分析了沙尘和灰霾添加对上述两个海域浮游植物群落结构的影响。
1 材料与方法
1.1 沙尘及灰霾的采集及化学成分分析
研究中添加的沙尘为人工处理沙尘(简称沙尘)。沙尘样品为2011年5月在阿拉善盟左旗腾格里沙漠(38.79°N,105.51°E)采集的表层土壤,带回实验室经20 μm筛网筛选后,经过干燥、酸化、风干等处理,以模拟沙尘气溶胶在大气中长距离传输的老化过程[16-17]。实验中添加的灰霾为2015年12月重度灰霾天气时采集的总悬浮颗粒样品(Total suspended particulate,TSP),采样地点位于中国海洋大学崂山校区(36.16°N,120.50°E)。采样设备为总悬浮颗粒物大流量采样器(KC-1000),采样流量为1.05 m3·min-1,采样时间为23 h。

表1 沙尘和灰霾中营养盐和溶解性金属的浓度Table 1 Concentration of inorganic nutrients and soluble metals in dust and haze /μg·g-1
1.2 船基围隔培养实验设计
于2016年3月28日—4年23日,随“东方红2号”科学调查船在西北太平洋海域开展了现场船基围隔培养实验。4个实验站位分别为西北太平洋黑潮亲潮混合区E02站位(38.02°N,148.05°E)和E10M站位(38.40°N,148.28°E),副热带寡营养区M1站位(32.42°N,146.28°E)和M1B站位(32.80°N,144.25°E)(见图1),每组实验设置3个平行组。利用Sea Bird 911 Plus-CTD采水系统采集表层海水(2~5 m),经200 μm筛绢过滤,去除大型和中型浮游动物后,装入20 L(沙尘和灰霾添加实验)/2 L(营养盐添加实验)的聚碳酸酯培养桶(Nalgene)中,然后分别按照实验方案(见表2)添加营养盐、沙尘(Dust)或灰霾(Haze)(随沙尘或灰霾进入培养体系的N、P营养盐浓度见表3)。将培养桶置于循环水槽内,进行现场表层海水控温培养。在培养过程中,将水温和光合有效辐射监测仪放置于围隔系统中,实时记录培养体系内水温及光照辐射强度的变化。
1.3 样品的采集与测定
培养期间,每日早晨采集水样测定叶绿素a浓度。在营养盐添加实验的2 L培养桶中取200 mL水样经0.7 μm玻璃纤维滤膜过滤(Whatman GF/F),用于测定总叶绿素a浓度。在沙尘和灰霾添加实验的20 L培养桶中取300 mL水样分别依次通过20、2和0.2 μm聚碳酸酯滤膜过滤(Whatman),用于测定各粒级浮游植物叶绿素a的浓度。将采集的滤膜样品装入15 mL离心管,分别加入10 mL的90%丙酮萃取,并于-20 ℃条件下遮光保存,18 h后取出,使用Trilogy叶绿素荧光分析仪测定叶绿素a浓度[13]。

图1 2016年春季西北太平洋船基围隔培养实验站位图Fig.1 Stations for the ship-based incubation experiments in Northwest Pacific in spring of 2016

表2 各站位营养盐、沙尘和灰霾及营养盐添加方案Table 2 Dust, haze and inorganic nutrients treatments at all stations

表3 沙尘或灰霾添加组中N、P营养盐的浓度Table 3 Concentration of N or Pinorganic nutrients in dust treatments or haze treatments /μmol·L-1
文中利用总叶绿素a浓度表示总浮游植物生物量;大于20 μm叶绿素a浓度表示小型浮游植物生物量;2~20 μm叶绿素a浓度表示微型浮游植物生物量;0.2~2 μm叶绿素a浓度表示超微型浮游植物生物量;在沙尘和灰霾添加实验中,认为三个粒级叶绿素a浓度之和即为总叶绿素a浓度,表示总浮游植物生物量。
利用分级叶绿素a浓度与各粒级叶绿素a浓度之和的比值可分别得出小型、微型和超微型浮游植物叶绿素a对总叶绿素a的贡献率(分别表示为CMicro、CNano和CPico)。同时,定义浮游植物叶绿素a贡献率最后一天的数值与初始值之差,为浮游植物叶绿素a贡献率的变化量,即:
ΔC=CL-CF。
其中:ΔC为浮游植物叶绿素a贡献率的变化量;CL为浮游植物叶绿素a贡献率最后一天的数值;CF为浮游植物叶绿素a贡献率的初始值。研究中以ΔCMicro表示小型浮游植物叶绿素a贡献率的变化量;ΔCNano表示微型浮游植物叶绿素a贡献率的变化量;ΔCPico表示超微型浮游植物叶绿素a贡献率的变化量。
培养期间,于第0天和最后一天取150 mL水样,通过0.45 μm醋酸纤维膜过滤,所得滤液装入高密度聚乙烯样品瓶(Nalgene)中,于-20 ℃条件下保存,带回陆地实验室,利用AA3(Auto Analyzer 3)连续流动分析仪测定营养盐浓度。
培养期间,每组培养实验于第0天和最后一天采集超微型浮游植物样品。用移液枪取1.8 mL水样置于冻存管,立即加入0.2 mL的10%多聚甲醛,混合均匀后将冻存管置于避光处固定15 min,然后使用液氮快速冷冻,用铝箔将样品包裹,于-20 ℃条件下冷冻保存,海上实验结束后带回陆地实验室,利用BD FACS Calibur流式细胞分析仪分别测定聚球藻(Synechococcus,Syn)、原绿球藻(Prochlorococcus,Pro)和超微型真核浮游植物(picoeukaryotes,Peuk)的细胞丰度[15]。
2 结果
2.1 各站位初始营养盐与叶绿素a特征及实验期间温度和辐射通量密度变化


由图2可知,实验期间4个站位日间辐射通量密度均在300~900 W·m-2范围内波动,仅有少数实验天数辐射通量密度较低,为200 W·m-2左右。黑潮亲潮混合区站位(E02和E10M),表层海水温度在15 ℃上下浮动(见图3),且昼夜温差较大,低温达到5~10 ℃。西北太平洋副热带寡营养区站位(M1和M1B),海表温度始终在20℃左右,期间仅有小幅波动。

表4 各站位地理位置及表层海水的基本特征Table 4 Locations and characteristics of surface seawaters at all stations
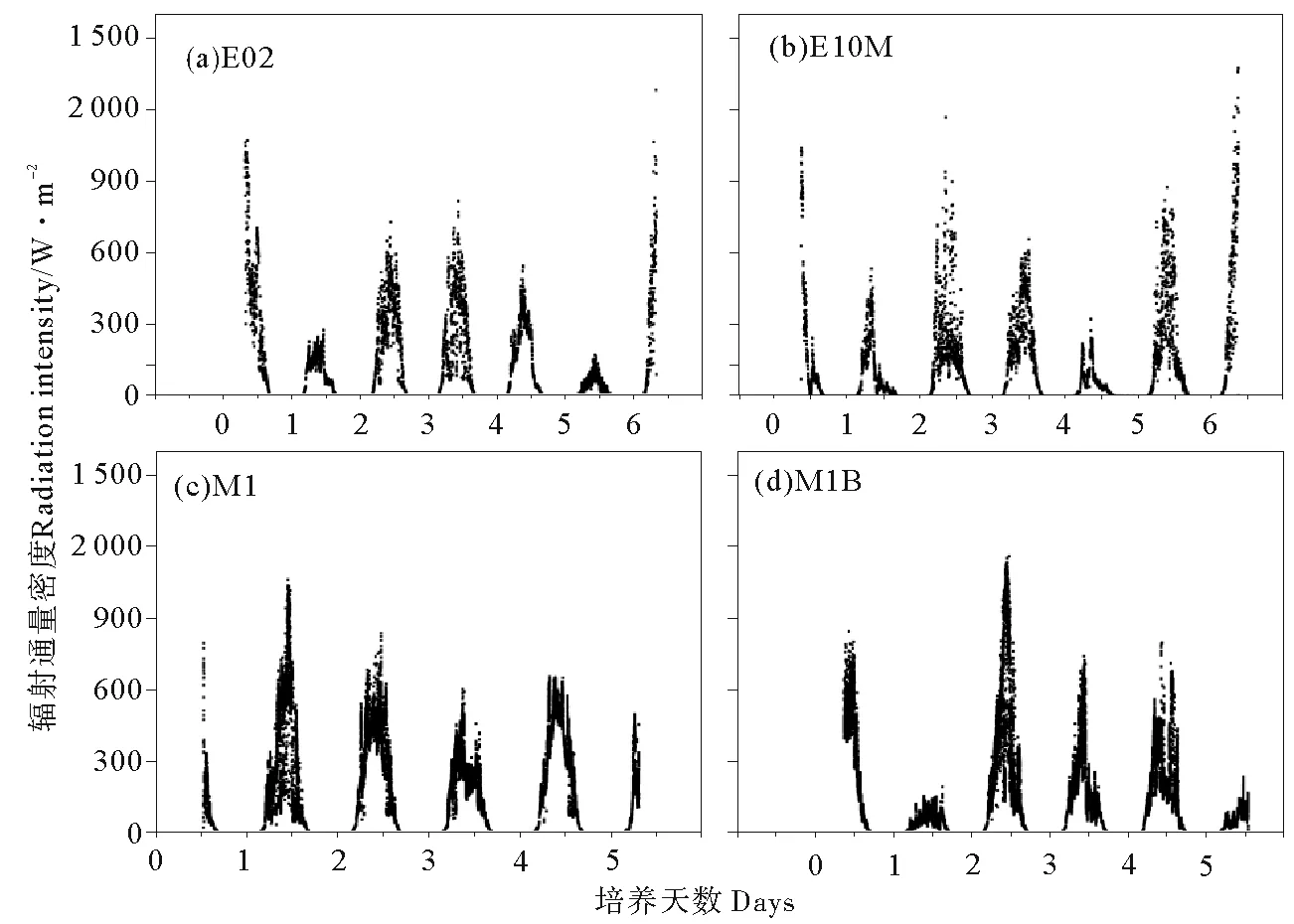
图2 各站位培养实验期间辐射通量密度变化Fig.2 Variation of radiation intensity at E02(a), E10M(b), M1(c) and M1B(d)

图3 各站位培养实验期间海水温度变化Fig.3 Variation of water temperature at E02(a), E10M(b), M1(c) and M1B(d)
2.2 浮游植物粒径分布的变化
2.2.1 叶绿素a对沙尘和灰霾添加的响应 图4(a)为黑潮亲潮混合区E02站位叶绿素a浓度对N、P营养盐及沙尘添加的响应。叶绿素a对N和P添加的响应与对照组基本一致,均无显著性差异(ANOVA,p>0.05)。沙尘添加对叶绿素a有促进作用,Dust-L和Dust-H添加组中叶绿素a浓度最大值分别为2.50和3.65 μg·L-1,是对照组(1.04 μg·L-1)的2.5和3.6倍。图4(b)为E10M站位绿素a浓度的变化情况,Dust-L和Dust-H添加组中叶绿素a浓度最大值分别为4.06和4.87 μg·L-1,是对照组(1.60 μg·L-1)的2.5和3.0倍。
图4(c)和4(d)为西北太平洋副热带寡营养区M1和M1B站位叶绿素a浓度的变化情况。M1站位实验第0天~第2天,N、P添加组叶绿素a浓度与对照组相比,无显著性差异(ANOVA,p>0.05),但第3天后N添加组叶绿素a浓度没有随P添加和对照组一同下降,这说明该站位浮游植物对N添加有一定响应,但响应速度较慢。Haze-H添加组叶绿素a浓度快速升高,于第3天达到最大值1.93 μg·L-1,是对照组(1.33 μg·L-1)的1.5倍。Haze-L添加组叶绿素a浓度相较于对照组无显著响应(ANOVA,p>0.05)。M1B站位N添加组叶绿素a浓度于第2天达到最大值0.78 μg·L-1,是对照组(0.54 μg·L-1)的1.4倍。P添加相较于对照组无显著性响应(ANOVA,p>0.05)。Dust-L和Dust-H添加组叶绿素a均于第2天达到最大值,分别为0.95和1.15 μg·L-1,是对照组的1.8和2.2倍。

图4 各站位营养盐及沙尘和灰霾添加组中叶绿素a浓度的变化趋势Fig.4 Response of Chlaconcentrations to addition of inorganic nutrients, dust and haze during the incubation experiments at E02 (a), E10M (b), M1 (c) and M1B (d)
2.2.2 分级叶绿素a对沙尘和灰霾添加的响应 西北太平洋黑潮亲潮混合区培养实验期间三种粒级叶绿素a浓度变化如图5所示。E02和E10M站位各粒级叶绿素a浓度变化趋势类似,E02站位Dust-L和Dust-H添加组中大于20 μm叶绿素a浓度明显增加,至第5天达到最大值,分别为1.05和1.90 μg·L-1,是对照组(0.17 μg·L-1)的5.9和11倍。E10M站位Dust-L和Dust-H添加组中大于20 μm叶绿素a浓度于第4天达到最大值,分别为2.00和2.50 μg·L-1,是对照组(0.80 μg·L-1)的2.5倍和3.1倍。沙尘添加组中2~20 μm和0.2~2 μm叶绿素a浓度相比于对照组仅有小幅度增加。

图5 各粒级叶绿素a浓度的变化趋势(a~c:E02;d~f:E10M;g~i:M1;j~l:M1B)Fig.5 Response of size-fractionated Chlaconcentrations at E02 (a~c), E10M (d~f), M1 (g~i) and M1B (j~l)
副热带寡营养区培养实验期间沙尘或灰霾添加对三种粒级叶绿素a均有促进作用,且添加量越大,促进效果越明显。M1站位Haze-H添加组中大于20、2~20和0.2~2 μm叶绿素a浓度最大值分别为0.72、0.48和0.90 μg·L-1,是对照组(0.32、0.32和0.64 μg·L-1)的2.2、1.5和1.4倍。M1B站位Dust-H添加组中大于20、2~20和0.2~2 μm叶绿素a浓度最大值分别为0.25、0.32和0.67 μg·L-1,是对照组(0.03、0.14和0.37 μg·L-1)的8.3、2.3和1.8倍。
2.2.3 分级叶绿素a贡献率的变化 E02和E10M站位各沙尘添加组中浮游植物优势群落的细胞粒径均由超微型浮游植物逐渐过渡到小型浮游植物(见图6)。E02站位Dust-H添加组CMicro由2%上升至58%,CPico由71%下降至19%,ΔCMicro和ΔCPico分别是对照组(由2%上升至45%,由71%下降至26%)的1.3和1.2倍。E10M站位Dust-H添加组中,CMicro由12%上升至51%,CPico由67%下降至17%,ΔCMicro和ΔCPico分别是对照组(由12%上升至38%,由67%下降至49%)的1.5和2.8倍。各实验组中CNano变化不明显。
由M1站位灰霾添加组分级叶绿素a的贡献率变化可知,灰霾添加量越大,浮游植物群落结构变化越明显,Haze-H添加组CMicro由14%上升至34%,CPico由64%下降至32%,ΔCMicro和ΔCPico分别是对照组(分别由14%上升至23%,由64%下降至44%)的2.2和1.6倍。M1B站位Dust-H添加组CMicro由7%上升至30%,CPico由71%下降至47%,ΔCMicro和ΔCPico分别是对照组的(分别由7%上升至10%,由71%下降至65%)7.7和4.0倍。CNano变化不明显。

图6 各粒级叶绿素a对总叶绿素a的贡献率(a~c:E02;d~f:E10M;g~i:M1;j~l:M1B)Fig.6 Contributions of size-fractionated Chlato total ChlaatE02 (a~c), E10M (d~f), M1 (g~i) and M1B(j-l)
2.2.4 叶绿素a贡献率的相对变化量 为了分析实验中各站位浮游植物的粒径分布的变化程度,分别计算了CMicro和CPico的相对变化率,即为叶绿素a贡献率实验最后一天的数值与初始值之差(ΔC)与初始值的比值(CF)(实验期间CNano变化较小,因此未对其进行分析)。黑潮亲潮混合区E02站位对照组及Dust-L和Dust-H添加组中CMicro的相对变化率分别为1 328%、2 217%和2 276%(见表5),明显高于其他站位。此外,各站位沙尘或灰霾添加组中CMicro的相对变化率均大于各站位的对照组。在CPico方面,黑潮亲潮混合区E02站位和E10M站位沙尘添加组中CPico的相对变化率均大于西北太平洋副热带寡营养区M1站位和M1B站位(见表6)。同样地,各站位也存在沙尘或灰霾添加组中CMicro的相对变化率大于各站位对照组的现象。

表5 大于20 μm叶绿素a贡献率相对变化量Table 5 Relative change amount of CMicro /%

表6 0.2~2μm叶绿素a贡献率相对变化量Table 6 Relative change amount of CPico /%
2.2.5 浮游植物粒径分布的变化与沙尘或灰霾添加的关系 为了探究浮游植物粒径分布的变化与沙尘或灰霾添加的关系,利用ΔCMicro(见图7)和ΔCPico(见图8)与沙尘和灰霾添加量进行了相关性分析(微型浮游植物实验期间贡献率变化不显著,因此未针对ΔCNano进行分析)。可以发现,西北太平洋副热带寡营养区的ΔCMicro和ΔCPico均与沙尘或灰霾的添加量呈线性相关,而在黑潮亲潮混合区,它们之间的相关性较小。

图7 ΔCMicro与沙尘或灰霾添加量之间的关系Fig.7 The relationship between ΔCMicroandaddition of dust and haze at E02(a), E10M(b), M1(c) and M1B(d)
2.3 实验期间消耗量
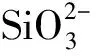

图8 ΔCPico与沙尘或灰霾添加量之间的关系Fig.8 The relationship between ΔCPicoand addition of dust and haze at E02(a), E10M(b), M1(c) and M1B(d)

表7 各站位实验期间营养盐消耗量Table 7 Consumption ofat all stations during the incubation experiments /μmol·L-1
2.4 超微型浮游植物细胞丰度的变化
E02站位表层海水中超微型浮游植物以聚球藻(3.0×103cells·mL-1)为主,原绿球藻(9.2×102cells·mL-1)和超微型真核浮游植物(1.2×103cells·mL-1)丰度约为前者的~30%和~40%。培养实验第0天和最后一天对照组及各实验组超微型浮游植物细胞丰度变化如图9。最后一天对照组中聚球藻和超微型真核浮游植物细胞丰度分别增加至1.7×104和3.5×103cells·mL-1,是第0天对照组的5.7和2.9倍。添加组中原绿球藻的细胞丰度增加,Dust-L和Dust-H分别为1.5×103和4.0×103cells·mL-1,是对照组(9.9×102cells·mL-1)的1.5和4.0倍。Dust-L添加组中聚球藻和超微型真核浮游植物的细胞丰度均低于对照组,分别为8.5×103和2.4×103cells·mL-1。
E10M站位超微型浮游植物也以聚球藻(1.2×103cells·mL-1)为主,原绿球藻(6.8×102cells·mL-1)和超微型真核浮游植物(5.4×102cells·mL-1)丰度均约为前者的~50%。与第0天相比,最后一天对照组中聚球藻、原绿球藻及超微型真核浮游植物细胞丰度分别增加至1.2×104、3.2×103和2.8×103cells·mL-1,是第0天对照组的10、4.7和5.2倍。沙尘添加实验中,各藻种细胞丰度没有明显变化。由此可知,该站位超微型浮游植物对沙尘的响应并不显著。
M1站位表层海水中超微型浮游植物以聚球藻为主(3.6×103cells·mL-1),原绿球藻(1.5×103cells·mL-1)和超微型真核浮游植物(6.2×102cells·mL-1)细胞丰度约为前者的40%和17%。最后一天对照组中原绿球藻细胞丰度下降46%,聚球藻与超微型真核浮游植物细胞丰度增加至7.5×103和7.5×102cells·mL-1,为第0天的2.1和1.2倍。灰霾添加组中聚球藻细胞丰度随灰霾添加量增加而减少,Haze-H添加组为3.9×103cells·mL-1,仅为对照组的52%。相反,原绿球藻细胞丰度随灰霾添加量增加而增加,Haze-H添加组为3.2×103cells·mL-1,是对照组的4.0倍。
M1B站位表层海水中超微型浮游植物同样以聚球藻为主(2.9×103cells·mL-1),原绿球藻(7.0×102cells·mL-1)和超微型真核浮游植物(3.9×102cells·mL-1)细胞丰度约为前者的24%和13%。最后一天对照组中仅聚球藻细胞丰度增加至7.1×103cells·mL-1,是第0天的2.4倍。原绿球藻和超微型真核浮游植均无显著变化。沙尘添加组Dust-L和Dust-H中聚球藻分别增加至1.8×104和1.6×104cells·mL-1,是对照组的2.5和2.3倍。

(其中Control-0表示第0天对照组超微型浮游植物细胞丰度;*表示与对照组具有显著性差异。p<0.05;(a)~(c):E02;(d)~(f):E10M;(g)~(i):M1;(j)~(l):M1B。Control-0 is control at day 0.Asterisks indicate statistically significant mean value(p<0.05)compared with the controls.对照组:Control;低浓度沙尘:Dust-L;高浓度沙尘:Dust-H.)
图9 各站位聚球藻(Syn)、原绿球藻(Pro)和超微型真核浮游植物(Peuk)细胞丰度变化
Fig.9 Variation ofSynechococcus(Syn),Prochlorococcus(Pro), andPicoeukaryotes(Peuk)cell abundance at E02 (a~c), E10M (d~f), M1 (g~i) and M1B (j~l)
3 讨论
3.1 各实验站位初始状态及温度和光照条件
E02和E10M站位位于黑潮亲潮混合区海域,北侧临近北太平洋亚极地海域,海水受亲潮影响,具有一定高营养盐低叶绿素(HNLC)特征。M1和M1B站位比E02和E10M站位偏南,位于西北太平洋中部副热带寡营养区。受黑潮和亲潮的共同影响,冷涡、暖涡出现频率较高,海水常常伴随着剧烈的垂直和水平混合[18],营养盐浓度水平较低。
除营养盐及浮游植物物种组成外,适宜的温度和光照条件也是浮游植物生长的重要条件因素[19]。表层海水中浮游植物光合作用效率和营养盐同化能力对光照有一定的敏感性,且不同藻类的敏感程度不同,因此,光照辐射强度的变化可以影响某些藻种的生长过程,造成不同的群落组成[20]。同时,在适宜范围内,较高的温度也有利于浮游植物的生长与繁殖[21]。在地中海的培养实验发现,将水体温度升高10 ℃,超微型浮游植物的初级生产力可以增加近2倍左右,但同时也发现温度对浮游植物的控制作用极易被水体中营养盐浓度的变化所掩盖[22]。
黑潮亲潮混合区实验期间温度出现波动现象,但在此期间各实验组中叶绿素a浓度并未发生特异性变化。同时,本研究中采用实验组与对照组对比的分析方法,由于各组受到的光照和温度条件完全一致,因此温度和光照不视为实验中的影响因素。
3.2 营养盐限制分析
黑潮亲潮混合区E02和E10M站位的沙尘添加实验表明,沙尘添加组中叶绿素a浓度均迅速升高,且Dust-L和Dust-H添加组中沙尘携带的N、P营养盐均低于营养盐添加组中N、P的含量(见表3),这说明沙尘中可能有其他物质可以促进浮游植物的生长。Tsuda等[23]在亚北极太平洋海域(48°N,165°E)进行的SEEDS实验表明,加Fe可以引起浮游植物显著增长,说明具有HNLC特征的水体对溶解性Fe具有较高的敏感性。黑潮亲潮混合区受亚北极太平洋水体的影响较大,因此,E02和E10M站位浮游植物生长有可能受到Fe限制。

3.3 浮游植物群落结构变化
西北太平洋副热带寡营养海域浮游植物生长受到明显的N限制,添加沙尘或灰霾的量越大,浮游植物生物量的增加越明显,但由于沙尘和灰霾添加后,溶出的N均可以促进各粒级浮游植物的生长,因此,M1和M1B站位粒径分布虽然发生了变化,但其相对变化量较小(见表5和6)。
有研究显示,当大气沉降导致海水中营养盐浓度发生改变时,大部分藻种需要一定时间适应新的营养盐环境,相比之下,硅藻对于环境改变的适应能力更强[26],能够在短时间内快速吸收营养物质,并进行增长繁殖[27]。Zhang等[16]在黑潮延伸体附近海域的培养实验发现,表层海水中硅藻在小型浮游植物中的相对细胞丰度约为95%,向表层海水添加沙尘后,硅藻的细胞丰度由~400 cells·mL-1增加至~700 cells·mL-1。因此,M1和M1B站位沙尘或灰霾添加组粒径分布的变化可能是由于与超微型浮游植物相比,硅藻为主的小型浮游植物增殖相对较快,从而在一定程度上使CMicro上升,CPico下降。但由于各粒级浮游植物对N添加均具有敏感性,所以粒径分布的变化与沙尘或灰霾的添加量呈显著相关性。
此外,实验中同时发现,M1站位Haze-L添加组各粒级叶绿素a浓度与对照组相比未出现明显增长,且超微型浮游植物中聚球藻的细胞丰度随灰霾添加量的增加而减少(见图9),说明聚球藻的生长受到了灰霾的影响。Mann等[28]通过实验发现,当水体环境中游离的Cu2+浓度大于10-6μmol·L-1时,将抑制聚球藻的生长及细胞分裂过程。Jordi等[29]在西地中海的实验中发现,水体中的Cu浓度达到~8×10-8μmol·L-1时,浮游植物生长会受到抑制作用。M1站位随灰霾添加至培养系统中的Cu含量为8.9×10-5~4.5×10-4μmol·L-1,高于以往实验中得出的Cu毒性作用值,因此聚球藻细胞丰度的减少极有可能是灰霾中溶出的Cu造成的。由于聚球藻是该站位超微型浮游植物中的优势藻种,所以聚球藻的减少导致了CPico下降。
然而,实验中同时发现,黑潮亲潮混合区ΔCMicro和ΔCPico与沙尘添加量的相关性较小。由于黑潮亲潮混合区浮游植物生长可能受到Fe限制,Takeda等[30]在SEEDS实验中发现HNLC海域表层海水中的溶解性Fe浓度仅为0.04 nM。而E02和E10M站位Dust-L和Dust-H添加组中,随沙尘携带的溶解性Fe分别为0.62和1.24 nM。若两站位存在Fe限制,则沙尘的添加足以快速缓解水体中的Fe限制,所以这可能成为E02和E10M站位浮游植物粒径分布的变化与沙尘添加量之间没有呈现出较好相关性的原因之一,但由于本研究并未进行严格的Fe控制实验,这一推论有待于在后续的研究中进一步验证。
4 结论
本研究通过N、P营养盐、沙尘和灰霾添加的船基围隔培养实验,探究了大气沉降对西北太平洋不同海域表层海水中浮游植物生长及群落结构变化的影响。实验发现沙尘和灰霾添加均可以促进西北太平洋黑潮亲潮混合区和副热带寡营养区各站位浮游植物的生长,但两个海域浮游植物粒径分布及群落结构的变化存在一定差异,且沙尘和灰霾对其影响机制也不尽相同。
(1)在黑潮亲潮混合区的E02和E10M站位,实验期间沙尘添加组中CMicro和CPico的相对变化量较大,但ΔCMicro和ΔCPico与沙尘添加量之间并没有呈现明显的相关性,这可能是由于不同量的沙尘均为浮游植物的生长提供了较充足的Fe,缓解该站位可能存在的Fe限制导致的。同时,相比之下,小型浮游植物增殖速度更快,使得该海域粒径分布变化更加明显。
在西北太平洋副热带寡营养海区的M1和M1B站位,沙尘或灰霾添加组浮游植物粒径分布的变化趋势相对较平缓,CMicro和CPico的相对变化量较小,但ΔCMicro和ΔCPico与沙尘或灰霾的添加量呈显著线性相关。这是由于该站位浮游植物生长存在明显N限制,沙尘或灰霾添加后,携带的N促进了浮游植物生长,但不同量的沙尘或灰霾中溶出的N营养盐含量不同,导致了各实验组之间粒径分布变化出现差异,这也表明浮游植物对N的添加具有较强敏感性。
(2)在西北太平洋副热带寡营养区,添加沙尘和灰霾对浮游植物群落结构变化的影响存在差异。沙尘添加携带的N促进了各粒级浮游植物的生长,但灰霾添加后,对超微型浮游植物的促进作用相对较弱,特别对聚球藻的生长产生了一定程度的抑制作用。与沙尘相比,灰霾一方面能够溶出N营养盐促进浮游植物的生长,另一方面也有可能同时导致海水中Cu等毒性物质浓度升高,使聚球藻等超微型浮游植物增长缓慢,从而导致了与沙尘添加后不同的浮游植物群落结构的变化。
