腹腔镜辅助消化道重建对胃癌患者的应用及患者CyclinD1蛋白表达的影响
2019-05-20张树朋潘建柱陈宗南邵建平珊巴嘎
张树朋, 徐 杰, 潘建柱, 陈宗南, 邵建平, 珊巴嘎
张树朋, 徐杰, 潘建柱, 陈宗南, 邵建平, 珊巴嘎, 天津市第五中心医院普外科 天津市 300450
核心提要: 全胃癌切除术后进行腹腔镜下消化道重建, 能明显缩短手术时间, 并且术后肠功能恢复较好, 与传统消化道重建手术相比, CyclinD1蛋白表达水平无明显差别.因此认为, 腹腔镜下消化道重建在临床上的应用疗效较好, 可以推广.
0 引言
近年来胃癌(gastric cancer, GC)发病率逐年上升, 且有年轻化趋势.GC发病率与致死率皆高, 现已引起人们广泛关注[1].目前, 腹腔镜下全胃切除术是根治GC的常用方案.而临床实践证明, 胃是人体重要的消化器官, 行全胃切除术后, 多数患者随着胃容积丧失而出现食欲减退的症状[2].与此同时, 由于胃全切常导致食物过快排空, 因而食物中的营养难以消化、吸收, 从而易导致免疫抑制或者营养不良发生[3].随着研究的进一步深入, 有学者提出, 在胃全切术后选择一种科学的胃肠道重建方式有利于解决营养不良等问题的发生, 从而减少感染风险,同时亦可以缩短住院时间[4].为了探究腹腔镜辅助消化道重建对GC患者的应用及患者CyclinD1蛋白表达的影响, 选取2015-05/2018-05天津市第五中心医院收治的行择期腹腔镜下全胃切除术的GC患者120例为研究对象,现报道如下.
1 材料和方法
1.1 材料 选取2015-05/2018-05天津市第五中心医院收治的行择期腹腔镜下全胃切除术的GC患者120例, 随机分为两组, 各组60例.对照组男32例、女28例;年龄为24-72岁, 平均年龄60.4岁±5.4岁; 病理分型为: Ⅱ期20例、Ⅲa24例、Ⅲb16例.研究组男31例、女29例;年龄为22-75岁, 平均年龄61.0岁±3.9岁; 病理分型为: Ⅱ期22例、Ⅲa23例、Ⅲb15例.纳入指标[5]: (1)所有患者皆行胃镜或活检病理检查, 并确诊为GC; (2)所有患者皆无腹腔镜下胃全切手术禁忌症; (3)所有患者皆为首次确诊, 且未曾有过外院放化疗治疗史; (4)患者年龄>18岁, 且<75岁.排除指标: (1)GC再次复发者; (2)患有严重的基础性疾病者, 例如: 高血压、糖尿病、高脂血症、全身免疫性疾病; (3)除GC外伴发其余系统恶性肿瘤者;(4)患有严重心、肝、肾功能障碍, 不耐受手术者; (5)严重的交流障碍以及明显的精神障碍者; (6)哺乳或者妊娠期妇女.
患者均知情同意本研究, 一般资料具有可比性(P>0.05), 同时经过医院伦理委员会批准.
1.2 方法 所有患者皆行择期腹腔镜下全胃切除术, 术前进行常规心电图、肝肾功能、凝血功能检测, 并与患者进行沟通、交流, 以减少患者紧张、恐惧、抑郁等不良情绪的滋生.而后皆采用气管插管, 并在全身麻醉下进行权威切除术.术中注意分离迷走神经, 且保留食管括约肌、幽门环.
研究组应用“P”形空肠袢空肠食管Roux-en-Y吻合术进行消化道重建, 对照组应用空肠食管Roux-en-Y吻合术治疗[6].
观察指标: (1)手术指标: 主要包括手术时间、术中出血量、胃肠功能恢复时间; (2)术后患者营养状态: 对术后患者体内白蛋白、总蛋白以及血红蛋白水平进行检测; (3)术后并发症: 对患者术后并发症进行统计, 主要包括倾倒综合征、腹泻、反流性食管炎、上腹饱胀、吻合口狭窄、吻合口出血以及肺部感染[7];(4)CyclinD1蛋白表达: 于术后第7 d采用免疫组织化学法检测患者体内CyclinD1蛋白表达, 所有操作严格按照说明书进行.其判断标准为: 免疫组化染色后, 呈黄棕色为阳性信号.若阳性细胞<5%腺上皮细胞(或肿瘤细胞), 则记为阴性; 若阳性细胞>5%腺上皮细胞(或肿瘤细胞), 则记作阳性[8].
统计学处理数据应用SPSS 18.0进行分析, 其中计数进行χ2(%)检验, 计量进行t检测mean±SD检验,P<0.05提示有显著差异.
2 结果
2.1 两组患者手术指标对比 两组患者术中出血量无明显差异(P>0.05), 研究组手术时间、肠功能恢复时间明显低于对照组(P<0.05), 具体见表1.
2.2 两组患者术后营养状态对比 研究组患者白蛋白、总蛋白、血红蛋白水平皆高于对照组(P<0.05), 具体见表2.
2.3 两组患者术后不良反应发生情况 就倾倒综合征、上腹饱胀的发生率来讲, 研究组明显低于对照组(P<0.05), 而腹泻、反流性食管炎、吻合口狭窄、吻合口出血以及肺部感染发生率两组间无明显差异(P>0.05), 具体见表3.
2.4 两组患者CyclinD1蛋白表达水平 两组患者术后7 d,检测CyclinD1蛋白表达, 所有患者皆为阴性, 两组间无明显差异(P>0.05), 具体见表4.
3 讨论
GC是临床上常见的癌症之一, 主要是由胃黏膜上皮与腺上皮发生的恶性肿瘤, 在我国恶性癌症中, 占前两位.GC的发病年龄常在40-60岁之间, 男性发病率多于女性, 常见发病位置为胃小弯.目前为止, 关于GC的发病原因尚不十分明确, 目前认为其与饮食、环境等因素相关, 且地区差异较为明显.国外相关研究表明,日本、智利、哥伦比亚、匈牙利以及中国部分地区的GC发病率远远高于美国以及西欧.且男性的发病率与死亡率皆高于女性, 国内相关研究认为其余男性吸烟相关.亦有统计学资料显示, 我国平均年死亡率约有16/10万.目前而言, 治疗GC的主要方法为手术联合放疗或化疗的中和治疗模式.随着医疗技术水平的提高以及医疗设备的的发展, 目前国内各大医院主要采取全胃切除术, 其手术指征为肿瘤浸润性至1/2及以上胃部, 或者患者肿瘤呈多灶性或者胃残GC[9].由于早期GC患者常无明显的临床表现, 待就诊时常发展为中晚期, 因而全GC切除术在临床中应用广泛[10].然而随着临床治疗量的不断增加,有学者发现, 进行全胃切除术的患者会出现剧烈的应激反应, 影响患者肺功能.针对此, 国内外均进行了相关研究, 发现胃全切会引起机体血管紧张素及去甲肾上腺素水平升高, 另外还会引起患者修复功能和免疫功能水平的下降, 不利于患者术后的恢复, 同时出现不同程度的营养吸收障碍, 严重降低了患者术后生存质量[11].为了进一步改善全胃切除术在临床中的治疗预后, 有学者提出, 可在术后进行消化道重建[12].而消化道重建方案较多, 采用何种方案治疗可以提高效果一直是临床医生讨论的问题之一[13].随着临床实践进行, 临床医生发现若重建消化道具有食物储蓄功能, 则能够减缓所摄取食物进入小肠的速度, 从而可降低十二指肠反流的风险, 治疗效果较佳.除此之外, 治疗过程中, 应尽量减少对患者机体的再次损伤[14].因而, 本研究选取2017-05/2018-05天津市第五中心医院收治的行择期腹腔镜下全胃切除术的GC患者120例为研究对象, 研究组应用“P”形空肠袢空肠食管Roux-en-Y吻合术进行消化道重建, 对照组应用空肠食管Roux-en-Y吻合术治疗.结果显示: 两组患者术中出血量无差异, 而其手术时间、肠功能恢复时间明显短于对照组; 这表明腹腔镜下胃肠道重建不会增加患者出血量, 同时能够减少手术时间, 并促进患者胃肠功能的恢复.
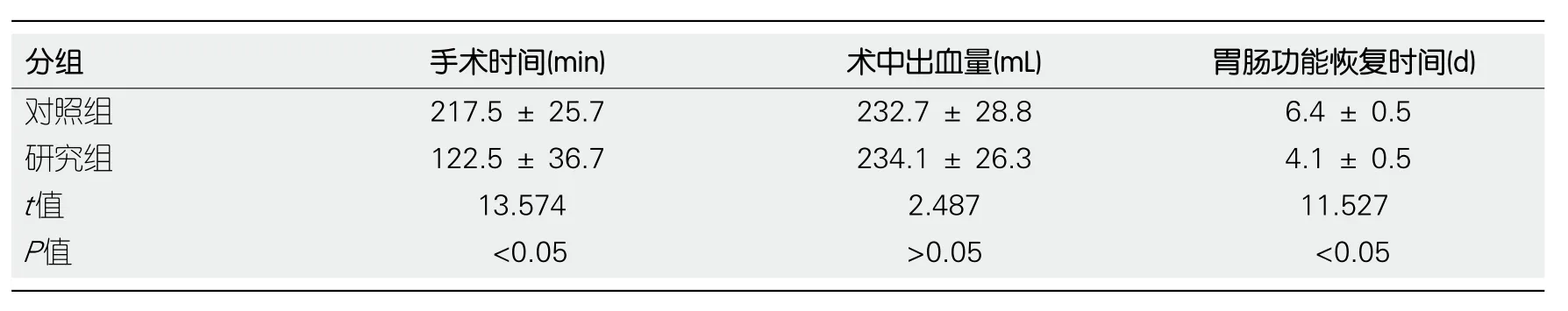
表1 两组患者的手术情况对比(n = 60, mean ± SD)

表2 白蛋白、总蛋白、血红蛋白水平[n = 60, mean ± SD, ng/L)
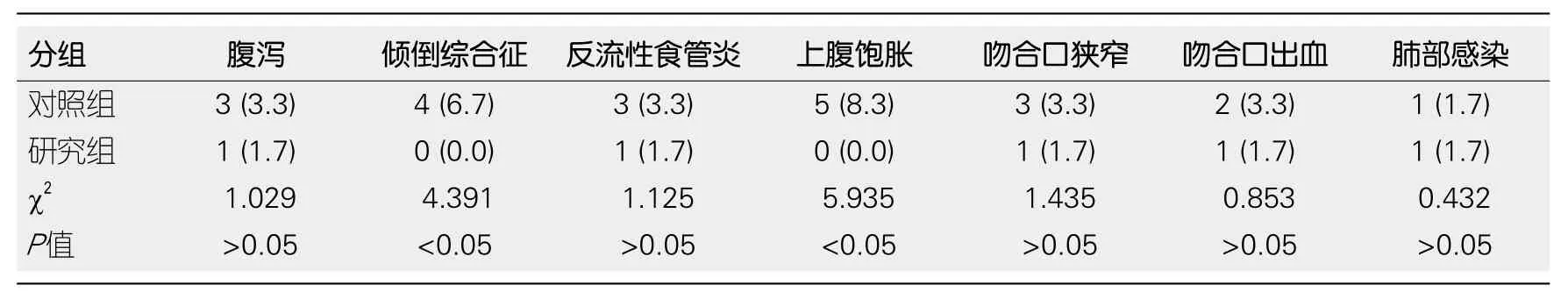
表3 不良反应发生情况对比 [n = 60, n (%)]
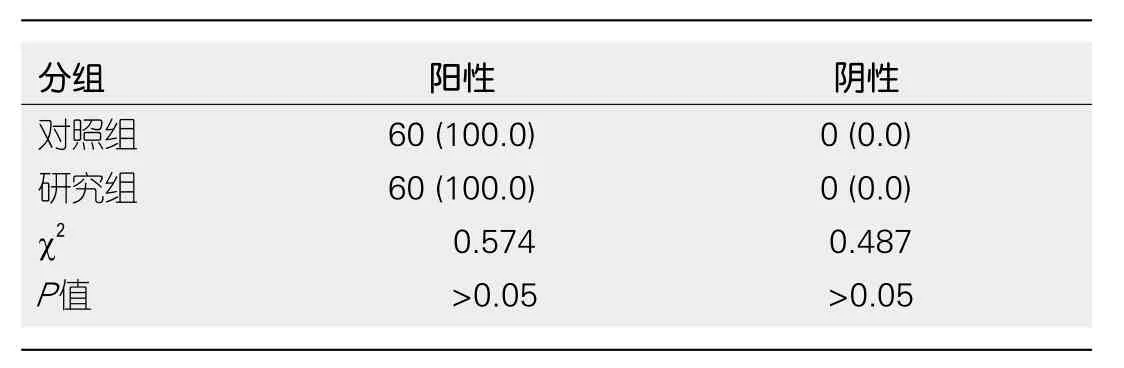
表4 两组患者CyclinD1蛋白表达水平对比 [n = 60, n (%)]
胃作为机体重要的消化器官之一, 一旦发生病变,则会严重影响消化系统功能, 因而大多数GC患者术前皆有不同程度的营养不良表现.然而手术是一种创伤性治疗方案, 将会导致患者机体处于应激状态, 从而加快患者机体代谢.而术后患者短期内难以进食, 只能靠肠内营养进行维持, 这就使患者术后营养不良进一步加重, 常导致负氮平衡的发生, 从而表现为体重的严重降低.国内相关研究表明, GC患者术后营养水平则会直接影响患者预后[15].本研究结果显示: 研究组患者白蛋白、总蛋白、血红蛋白水平皆高于对照组, 这表明行胃肠道重建, 有利于患者消化功能提高, 与同类研究结果保持一致.除此之外, 就倾倒综合征、上腹饱胀的发生率来讲, 研究组明显高于对照组, 而腹泻、反流性食管炎、吻合口狭窄、吻合口出血以及肺部感染发生率两组间无明显差异.由此可推断, 进行腹腔镜下消化道重建, 能够降低不良反应的发生率, 提高患者术后生存质量, 在此基础上能够逐步改善患者术后营养不良,并在一定程度上减缓GC根治术后患者体重下降, 甚至逐步使患者体重有所增加.随着体重的增加, 患者免疫力亦会有所增加, 必然会减少患者术后不良反应的发生, 从而提高患者生活质量, 并延长患者术后生存率.
CyclinD1由295个氨基酸组成, 分子量为34kD, 其在细胞中的功能是促进G l-S期的转变进而促进细胞周期, 与细胞增殖有关.目前在人类多种肿瘤中发现其基因扩增、转位、重排和蛋白过表达.在国外的研究中指出, GC患者CyclinD1蛋白明显高于非GC患者, 且术后CyclinD1蛋白表达水平明显降低.CyclinD1蛋白的检测可以作为预测患者术后预后指标之一.两组患者术后7 d, 检测CyclinD1蛋白表达, 所有患者皆为阴性.这表明进行消化道重建不但不影响肿瘤切除效果,还能够减少术后并发症的发生.此外, 术后应对患者进行营养治疗, 医护人员应向患者与家属降解术后相关营养并发症以及营养治疗等基础知识.并根据患者的具体情况, 依据膳食指南、营养配餐、膳食宝塔等专业营养管理制定适宜的饮食食谱.患者术后应以流至或者半流质的食物为主, 密切关注患者饮食与体重变化, 若患者进食后有腹胀、腹痛等不适感, 应根据患者具体情况, 进行针对性治疗.嘱患者禁止突然大量增加进食量, 以防止吻合口瘘的发生.
总之, 全GC切除术后进行腹腔镜下消化道重建,有利于患者消化功能的恢复, 提高患者术后营养水平,且不增加CyclinD1蛋白表达水平, 临床上应当进一步推广应用.
文章亮点
实验背景
目前采用腹腔镜辅助消化道重建已经比较常见, 但是对于其疗效与传统相比不太清晰, 对其治疗效果进行探究, 可以更指导临床治疗.
实验动机
胃癌(gastric cancer, GC)属于恶性肿瘤, 发生转移的几率较高, 腹腔镜技术是否能够有效清除癌病灶, 达到有消化道重建, 需要进行相关研究进行探讨.
实验目标
主要与传统消化道重建技术相比较, 探讨腹腔镜辅助消化道重建治疗效果, 术后CyclinD1蛋白表达水平情况,为下一步临床治疗提供依据.
实验方法
研究组应用“P”形空肠袢空肠食管Roux-en-Y吻合术进行消化道重建, 对照组应用空肠食管Roux-en-Y吻合术治疗, 术后对两组患者手术时间、术中出血量、术后患者营养状况、并发症发生率以及CyclinD1蛋白表达情况进行对比.
实验结果
我说的是心里话,在这辆老掉牙的古典列车上,看到穿着维多利亚时代服装的老妇人蹒跚走动,本身就有种梦幻般的感觉。
腹腔镜辅助消化道重建术后患者手术时间、肠功能恢复时间相对传统重建术缩短, 白蛋白、总蛋白、血红蛋白水平皆优于传统重建术后, 且CyclinD1蛋白表达水平相对传统无异.
实验结论
本研究认为腹腔镜辅助消化道重建术能在重建消化道的同时有效清除病灶, 缩短手术时间和恢复时间, 治疗效果较好.
展望前景
该研究仅对手术时间、术中出血量、术后患者营养状况、并发症发生率以及CyclinD1蛋白表达情况等指标进行相关分析, 研究较为局限, 进一步应该对术后患者消化功能的恢复情况以及护理方式等进行补充研究, 以指导临床对患者治疗力求最大疗效.
