丹参中三萜酸的分离及其抗炎活性的研究*
2019-05-18黄莉婷许琼明杨世林高红伟
黄莉婷,丁 昉,许琼明,2,杨世林,2,高红伟,3**
(1.广西中医药大学药学院 南宁 530020;2.苏州大学药学院 苏州 215123;3.广西优势中成药与民族药开发工程技术中心 南宁 530020)
丹参Radix Salviae Miltiorrhizae是唇形科植物丹参的干燥根和根茎,它的主产地主要是在江苏、山东、安徽、四川,大多数为栽培品;在春、秋二季采挖,除去它的茎叶、泥沙、须根,晒干。丹参最开始被记载于《神农本草经》,列为上品。它性微寒,味苦。归心、肝经,具有活血通络、祛瘀止痛、凉血消痈、清除心烦等功效,常用于治疗心绞痛、冠心病及胸腹刺痛、经闭痛经等症,入药历史悠久。《本草纲目》中记载,丹参活血,通心包络,治疝痛;《本经》记载,丹参主治心腹邪气,肠鸣幽幽如走水,寒热积聚,破症除瘕,止烦满,益气;《别录》记载,丹参养血,去心腹痼疾结气,腰脊强脚痹,除风邪留热,久服利人,具有“一味丹参,功同四物”的说法[1,2]。丹参作为一种传统中药,长期记载于《中国药典》中,且成功被《美国药典》收录。丹参作为一个在临床上被用了上千年的中药,被开发出很多产品,如复方丹参滴丸、丹参片、复方丹参片、复方丹参注射液、丹参舒心胶囊、丹参酮胶囊等,尤其是丹参复方滴丸是第一个进入美国食品药品监督管理局(FDA)临床试验的复方中药,具有十分重要的意义。
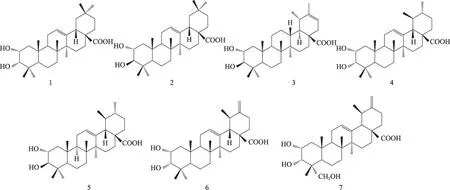
图1 三萜酸化学结构式
早在20世纪30年代,就有国内外的学者对丹参的化学成分进行了研究。丹参化学成分主要包括两大类:一类是以丹参素(Propanoid acid)和丹酚酸(Salvianolic acid)为代表的水溶性成分,主要以丹酚酸A、B、C、D、E最为常见[3]。而且现代药理学研究表明,这些丹酚酸化合物具有明显的生物活性,尤其是丹酚酸B的生活性研究的最为广泛且深入。其明显具有抗心血管疾病[4]、抗动脉粥样硬化[5]、治疗糖尿病[6]、抗炎、抗氧化等药理活性[7]。另一类是以丹参酮(Tanshinone)为代表的脂溶性成分[2,8,9],主要以丹参酮IIA、隐丹参酮、丹参酮I、二氢丹参酮I 最为常见。药理活性研究表明,丹参酮具有明显的生物活性,主要表现在抗炎[10]、抗肿瘤[11]、抗动脉粥样硬化[12]、治疗心血管疾病[13]等。三萜类成分如莫里斯酸、乌苏酸等在唇形科鼠尾草属植物中早已被分离得到[14]。其药理活性亦有很多报道,主要体现在三萜酸对抗氧化、抗菌、抗肿瘤等方面的生物活性[14],对三萜酸抗炎活性研究报道很少。因此,本实验主要是对丹参中三萜酸一类化学成分分离及其抗炎活性进行研究。结果表明,我们分离得到7 个三萜酸(图1),他们都属于本植物首次分离得到。抗炎活性研究表明,他们都具有良好的抗炎活性。
1 仪器与材料
1.1 仪器
半制备岛津高效液相色谱仪(LC-20AB,SPD-20A,日本岛津公司);C18分析色谱柱(4.6 mm×250 mm,5 μm,美国kromasil公司);CPA225D Sartotius电子天平(上海中殷医疗设备有限公司);核磁共振仪(TMS 内标,Bruker AVANCE III600 型,德国布鲁克公司);中压柱色谱(填料为ODS,瑞士Buchi公司);CO2培养箱(美国Thermo 公司);Biotek Synergy H1 酶标仪(美国博腾公司);梅特勒-托利多电子天平(瑞士Mettler Toledo公司)。
1.2 材料
化学试剂(分析纯及色谱纯,国药集团化学试剂有限公司);氘代试剂(德国Merck 公司);多功能酶标仪(美国Biotek 公司);脂多糖(Lipopolysaccharide,LPS)、Greiss 试剂(美国Sigma 公司);胎牛血清(FBS)及高糖培养基(DMEM)(美国Gibco 公司);TNF-α及IL-6 ELISA试剂盒(中国深圳欣博盛公司);RAW264.7细胞(美国ATCC)。丹参药材购自安徽亳州药材市场,经苏州大学药学院李笑然教授鉴定为丹参,药材标本保存于苏州大学药学院标本室(No.20151009-1)。
2 实验方法
2.1 提取与分离
将50 kg干燥丹参饮片用95%乙醇(100 L)加热回流提取两次,减压浓缩至无醇味。分别用二氯甲烷、乙酸乙酯、正丁醇萃取,减压浓缩得到二氯甲烷部位浓缩液(5.2 kg),乙酸乙酯浓缩液(3.8 kg),正丁醇浓缩液(6.3 kg)。将二氯甲烷部位浓缩液(5.2 kg)经减压硅胶柱色谱(200-300目),石油醚-乙酸乙酯(9∶1,6∶1,3∶1,1∶1,0∶1)梯度洗脱得到五个部位Fr.1-Fr.5,合并Fr.3和Fr.4两个部位。将合并的部分样品用纯甲醇溶解,用中压色谱(MPLC)连接ODS 反相色谱柱分离,甲醇-水(1∶9,3∶7,5∶5,7∶3,9∶1)梯度洗脱,并结合SephadexLH-20凝胶色谱及半制备高效液相色谱(HPLC)进一步分离,分离得到化合物1(45.6 mg),2(52.9 mg),3(62.3 mg),4(42.6 mg),5(39.1 mg),6(26.1 mg),7(51.0 mg)。并且这7个化合物都是从该植物中首次分离得到。
2.2 Greiss试剂检测化合物对NO释放的影响
将RAW264.7小鼠单核巨噬细胞培养在含有10%胎牛血清(FBS)高糖培养基(DMEM)中,放在含有5%CO2温度为37℃培养箱中进行培养。将2×104RAW264.7 小鼠单核巨噬细胞种在96 孔板中,然后将其培养在CO2培养箱过夜,用不同浓度的化合物(60,30,15 μM)预处理细胞1 h后,加入LPS(1 μg·mL-1)共培养16 h,取上清液(80 μL)与Griess 试剂(80 μL)混合,在CO2培养箱避光孵育15 min,用酶标仪波长为540 nm检测吸光度值。
2.3 ELISA方法检测TNF-α和IL-6
将2×105RAW264.7 小鼠单核巨噬细胞种在24 孔板中,然后将其培养在CO2培养箱过夜,用不同浓度的化合物(60,30,15 μM)预处理细胞1 h 后,加入LPS(1 μg·mL-1)共培养16 h,取上清液,按照酶联免疫吸附实验(ELISA)试剂盒说明书,检测化合物对炎症因子:肿瘤坏死因子(TNF-α)及白介素-6(IL-6)的释放情况。
2.4 数据统计处理
应用Graphpad Prism 6.0 软件中的单因素方差分析(One way-ANOVA)对实验结果进行比较分析,所有药理实验至少重复3次。
3 实验结果
3.1 结构鉴定
化合物1:白色无定型粉末(甲醇)。1H-NMR(C5D5N,600 MHz)δ:3.96(1H,m,H-2),3.48(1H,m,H-3),5.28(1H,s,H-12),2.25(1H,d,J=11.4 Hz,H-18),0.97(3H,s,H-23),0.87(3H,s,H-24),0.77(3H,s,H-25),0.97(3H,s,H-26),1.17(3H,s,H-27),0.80(3H,s,H-29),0.88(3H,s,H-30)。13C-NMR(C5D5N,125 MHz)δ:42.1(C-1),66.6(C-2),79.1(C-3),38.6(C-4),48.3(C-5),18.7(C-6),33.2(C-7),39.8(C-8),47.6(C-9),38.7(C-10),23.8(C-11),125.7(C-12),138.6(C-13),41.3(C-14),28.6(C-15),24.4(C-16),47.5(C-17),53.2(C-18),39.7(C-19),39.5(C-20),30.4(C-21),37.3(C-22),28.9(C-23),22.5(C-24),16.9(C-25),17.4(C-26),23.9(C-27),181.1(C-28),17.2(C-29),21.6(C-30)。其1H-NMR和13C-NMR数据与文献报道的数据基本一致,故鉴定其为2α,3α-dihydroxyolean-12-en-28-oic acid[15]。
化合物2:白色无定型粉末(甲醇)。1H-NMR(C5D5N,600 MHz)δ:3.45(1H,d,J=9.5 Hz,H-3),4.26(1H,m,H-2),5.49(1H,br,s,H-12),1.28(3H,s,H-23),1.02(3H,s,H-24),1.06(3H,s,H-25),1.08(3H,s,H-26),0.98(3H,s,H-29)1.22(3H,s,H-27),0.95(3H,s,H-30)。13C-NMR(C5D5N,125 MHz)δ:47.9(C-1),69.0(C-2),83.4(C-3),39.6(C-4),55.9(C-5),18.2(C-6),33.8(C-7),48.8(C-8),48.7(C-9),38.9(C-10),23.9(C-11),122.6(C-12),144.3(C-13),42.8(C-14),28.8(C-15),24.2(C-16),46.9(C-17),42.3(C-19),31.5(C-20),34.8(C-21),33.9(C-22),29.8(C-23),17.5(C-24),17.8(C-25),17.9(C-26),26.5(C-27),180.1(C-28),33.9(C-29),24.2(C-30)。其1H-NMR和13C-NMR数据与文献报道的数据基本一致,故鉴定其为Maslinic acid[16]。
化合物3:白色无定型粉末(甲醇)。1H-NMR(C5D5N,600 MHz)δ:3.48(1H,d,J=9.8 Hz,H-3),4.29(1H,m,H-2),5.62(1H,br,s,H-21)1.00(3H,s,H-23),1.09(3H,s,H-24),1.32(3H,s,H-25),1.78(3H,s,H-26),1.06(3H,s,H-27),0.77(3H,d,J=6.4 Hz,H-29),0.88(3H,d,J=6.0 Hz,H-30)。13C-NMR(125 MHz)δ:48.9(C-1),69.7(C-2),84.3(C-3),39.4(C-4),56.7(C-5),19.6(C-6),35.6(C-7),41.3(C-8),51.8(C-9),39.7(C-10),22.7(C-11),33.2(C-12),40.6(C-13),42.8(C-14),28.9(C-15),30.8(C-16),49.8(C-17),49.1(C-18),38.8(C-19),143.9(C-20),118.6(C-21),38.5(C-22),29.1(C-23),17.6(C-24),18.8(C-25),16.1(C-26),15.3(C-27),178.7(C-28),23.2(C-29),22.5(C-30)。其1H-NMR和13C-NMR数据与文献报道的数据基本一致,故鉴定其为Psiguanin A[17]。
化合物4:白色无定型粉末(甲醇)。1H-NMR(C5D5N,600 MHz)δ:3.50(1H,m,H-2),2.89(1H,d,J=9.5 Hz,H-3),5.10(1H,br,s,H-12),0.86(3H,s,H-23),0.78(3H,s,H-24),0.79(3H,s,H-25),0.95(3H,s,H-26),1.02(3H,s,H-27),0.78(3H,d,J=6.4 Hz,H-29),0.88(3H,d,J=6.0Hz,H-30)。13C-NMR(C5D5N,125 MHz)δ:48.1(C-1),69.9(C-2),80.9(C-3),40.8(C-4),56.0(C-5),19.9(C-6),34.6(C-7),41.2(C-8),49.2(C-9),39.5(C-10),24.7(C-11),126.9(C-12),139.1(C-13),43.8(C-14),29.8(C-15),25.6(C-16),48.0(C-17),54.7(C-18),40.0(C-19),40.9(C-20),32.2(C-21),38.7(C-22),29.9(C-23),17.9(C-24),17,1(C-25),17.4(C-26),24.8(C-27),180.6(C-28),17.6(C-29),21.3(C-30)。其1H-NMR和13C-NMR数据与文献报道的数据基本一致,故鉴定其为2α,3α-dihydroxyurs-12-en-28-oic acid[18]。

表1 三萜酸抑制LPS刺激RAW264.7细胞NO释放
化合物5:白色无定型粉末(甲醇)。1H-NMR(C5D5N,600 MHz)δ:3.45(1H,m,H-2),2.96(1H,d,J=9.5 Hz,H-3),5.15(1H,br,s,H-12),0.89(3H,s,H-23),0.85(3H,s,H-24),0.85(3H,s,H-25),0.99(3H,s,H-26),1.05(3H,s,H-27),0.82(3H,d,J=6.4Hz,H-29),0.92(3H,d,J=6.0Hz,H-30)。13C-NMR(C5D5N,125 MHz)δ:48.6(C-1),70.2(C-2),80.5(C-3),41.2(C-4),56.5(C-5),19.4(C-6),34.8(C-7),41.4(C-8),49.7(C-9),40.0(C-10),24.9(C-11),125.9(C-12),139.6(C-13),43.2(C-14),29.2(C-15),25.1(C-16),48.2(C-17),54.4(C-18),40.2(C-19),41.2(C-20),32.7(C-21),38.2(C-22),30.0(C-23),17.2(C-24),17,5(C-25),17.3(C-26),24.1(C-27),180.2(C-28),17.9(C-29),21.7(C-30)。其1H-NMR 和13C-NMR 数据与文献报道的数据基本一致,故鉴定其为2α-hydroxy ursolic acid[19,20]。
化合物6:白色无定型粉末(甲醇)。1H-NMR(C5D5N,600 MHz)δ:3.52(1H,m,H-2),3.12(1H,d,J=9.0 Hz,H-3),5.65(1H,br,s,H-12),0.94(3H,s,H-23),0.93(3H,s,H-24),0.95(3H,s,H-25),0.99(3H,s,H-26),1.10(3H,s,H-27),1.25(3H,d,J=7.8 Hz,H-29),5.82(1H,br,s,H-30),5.94(1H,br,s,H-30)。13C-NMR(C5D5N,125 MHz)δ:47.1(C-1),70.8(C-2),80.9(C-3),41.5(C-4),56.7(C-5),19.9(C-6),34.1(C-7),41.9(C-8),50.1(C-9),40.6(C-10),25.5(C-11),126.3(C-12),139.1(C-13),43.8(C-14),29.6(C-15),25.8(C-16),48.5(C-17),54.8(C-18),39.1(C-19),154.8(C-20),31.7(C-21),38.6(C-22),16.9(C-23),17.8(C-24),17.9(C-25),17.8(C-26),24.5(C-27),178.9(C-28),18.1(C-29),105.4(C-30)。其1H-NMR 和13C-NMR 数据与文献报道的数据基本一致,故鉴定其为2α,3αdihydroxyursa-12,20(30)-dien-28-oic acid[18]。
化合物7:白色无定型粉末(甲醇)。1H-NMR(C5D5N,600 MHz)δ:3.58(1H,m,H-2),3.12(1H,d,J=9.8 Hz,H-3),5.65(1H,br,s,H-12),3.67(1H,d,J =13.8 Hz,H-23),3.52(1H,d,J = 13.8 Hz,H-23),0.91(3H,s,H-24),0.96(3H,s,H-25),1.02(3H,s,H-26),1.12(3H,s,H-27),1.20(3H,d,J=7.8 Hz,H-29),5.78(1H,br s,H-30),5.82(1H,br s,H-30)。13C-NMR(C5D5N,125 MHz)δ:49.3(C-1),71.5(C-2),81.5(C-3),41.8(C-4),56.9(C-5),19.9(C-6),34.1(C-7),41.0(C-8),49.2(C-9),40.4(C-10),24.1(C-11),125.0(C-12),140.2(C-13),43.0(C-14),29.9(C-15),25.7(C-16),48.8(C-17),54.8(C-18),40.8(C-19),153.6(C-20),32.1(C-21),38.8(C-22),71.9(C-23),17.8(C-24),17.0(C-25),17.8(C-26),24.2(C-27),180.8(C-28),17.1(C-29),104.9(C-30)。其1H-NMR 和13C-NMR 数据与文献报道的数据基本一致,故鉴定其为2α,3αdihydroxyursa-12,20(30)-dien-28-oic acid[21]。
3.2 化合物对NO释放情况测定
从实验结果中,我们发现7 个三萜酸都具有较好的抑制NO释放作用(表1)。由于7个化合物的化学结构式非常相似,所以他们体现出的抑制NO 释放的活性基本一致,没有明显的差异性,也没有体现出一定的构效关系。
3.3 化合物对炎症因子TNF-α和IL-6释情况测定
从实验结果中,我们发现7 个化合物在高浓度的情况具有较好的抑制炎症因子TNF-α及IL-6 的释放(图2)。7个化合物在高剂量时(60 μM)对TNF-α及IL-6的释放具有明显的抑制作用,在中剂量时(30 μM)体现出一定的活性,但是不明显,低剂量(15 μM)几乎没有活性。
4 讨论
丹参作为一味常见的活血化瘀类中药,具有悠久的中医临床应用历史。目前,以关键词“Danshen”或“丹参”在PubMed 或CNKI 分别搜到2 975 篇和48 998篇文章,可见国内外学者对丹参研究的非常广泛且深入。有很多研究显示,丹参具有很明显的抗炎活性[22,23],尤其是丹酚酸和丹参酮抗炎效果及机制非常明确。丹酚酸和总丹参酮对各种炎症模型的动物都一定治疗作用,如组织胺造模的血管通透性增加大鼠,蛋清、角叉菜胶或右旋糖酐造模的关节炎肿痛的大鼠,巴豆油、二甲苯造模耳肿胀的小鼠等[7]。其作用机制是通过调节NF-κB信号通路及MAPK信号通路,达到抑制溶酶体、炎症因子(TNF-α,IL-1β,IL-6,NO,PGE2 等)释放及中性粒细胞趋化性,起到减少炎症渗出效果,从而达到抗炎效果[24]。本研究采用ELISA 方法检测了7 个三萜酸对炎症因子TNF-α和IL-6 的影响。结果显示,7 个三萜酸都具有很好抑制炎症因子释放的作用。此外,本研究还采用Griess 试剂检测NO 释放,NO 在机体内极不稳定,容易生成NO2-,NO2-与Griess 试剂发生反应生成重氮化合物[25]。因此,重氮化合物与NO成一定的线性关系,从而反应了NO 的含量。NO 的生成主要是由一氧化氮合成酶(Nitric Oxide Synthase,NOS)的作用下催化L-精氨酸生成的[26,27]。NOS 有三种形式eNOS、nNOS、iNOS。其中,eNOS主要调控内皮细胞生成NO,参与血管功能调控;nNOS 在神经系统中调控NO 产生,参与细胞通讯及信息存储;iNOS 在诱导情况下产生NO,参与机体免疫与抗炎反应等[26,27]。但是,本研究只是检测NO 释放情况,相关的iNOS 的活性及表达则没有进一步研究。综上所述,本研究从丹参中分离鉴定了7个三萜酸,其中4个属于本植物首次分离,丰富了丹参中的化学成分种类。此外,本研究初步探索了三萜酸抗炎活性,证实了7 个三萜酸都具有一定的抗炎活性,初步阐述了丹参发挥抗炎作用物质基础,但是,其作用机制还需要进一步深入探索。
