电针预处理对抑郁模型大鼠电休克治疗后认知功能及腺苷酸活化蛋白激酶信号通路的影响
2019-05-18米智华
米智华,高 巨
(扬州大学临床医学院 江苏省苏北人民医院 麻醉科,江苏 扬州,225001)
抑郁症又称抑郁障碍(DD),是临床上常见的情感性精神障碍(AD),主要表现为认知功能损害和躯体症状,以心境低落、思维迟缓、意志活动减退为主要特征[1]。电休克治疗(ECT)是目前公认的治疗重度抑郁症(MDD)最为有效的治疗手段,具有效率高、起效快等特点,但ECT治疗可导致患者学习记忆功能损害[2-3]。针刺是中国传统医学的瑰宝,在缓解抑郁症状方面具有独特的功效。动物实验[4]证实,电针在减轻脑损伤、改善学习记忆功能等方面,具有显著的效果。电针预处理可激活脑缺血再灌注损伤模型小鼠的AMPK信号通路,减轻海马神经元凋亡。在POCD大鼠模型中,电针预处理也可通过上调海马腺苷酸活化蛋白激酶(AMPK)信号通路,改善大鼠术后认知功能障碍[5]。迄今为止,未见将电针应用于抑郁电休克治疗的报道。本实验拟通过电针预处理,观察其对抑郁模型大鼠电休克治疗后学习记忆能力的影响,并探讨AMPK信号通路的作用,现报告如下。
1 材料与方法
1.1 实验动物
雄性SD大鼠,体质量为180~220 g,购于扬州大学比较医学中心。饲养环境:饲养环境要保持安静,室温(25.00±2.00)℃,湿度(55.00±10.00)%,大鼠可自由摄食饮水,养成固定的昼夜节律(12 h/12 h)。本实验通过扬州大学实验动物伦理审核。实验开始前,大鼠适应性饲养1周。
1.2 实验分组
采用Open-field评分法将水平运动次数加垂直运动次数低于40次或大于100次的大鼠剔除,选择相近的75只大鼠,按照随机数字表法分为正常对照组(Ⅰ组)、模型组(Ⅱ组)、电休克组(Ⅲ组)、电针+电休克组(Ⅳ组)、Sham+电休克组(Ⅴ组),每组15只。
1.3 模型建立
正常对照组每笼5只正常饲养,不做其他实验干预。其余4组参照《神经生物学实用实验技术》[6]介绍的方法,选择其中7种刺激模式造模,包括禁水禁食(24 h)、冰水游泳(4 ℃,5 min)、倾斜鼠笼(45°)、昼夜颠倒(24 h)、潮湿垫料(24 h)、夹尾(1 min)、水平震荡(5 min),每天随机安排1种刺激方式,每种刺激在实验全程中使用3次。连续干预21 d。
1.4 干预措施
1.4.1 麻醉方法:采用腹腔注射异丙酚(北京费森尤斯卡比医药有限公司,国药准字J20160089)100 mg/kg进行麻醉,给药2 min后大鼠出现翻正反应消失,即达到麻醉效果。
1.4.2 电针预处理:麻醉成功后,将大鼠四肢固定在实验操作台上,采用15.00 mm×0.26 mm针灸针针刺穴位。参照《常用动物腧穴图谱》[7]进行取穴。选取百会穴、印堂穴(见图1)。百会穴向前沿皮刺入2 mm,印堂穴针尖向下沿皮刺2 mm,接华佗牌SDZ-Ⅱ型电针仪(苏州医疗用品厂有限公司)。调节刺激参数:疏密波,频率2 Hz/10 Hz,电流强度1 mA,大鼠胡须轻微抖动视为电针刺激有效的标志,持续30 min。Ⅰ~Ⅲ组不进行电针干预。Ⅳ组在ECT治疗前30 min,先行电针刺百会穴、印堂穴,疏密波,强度1 mA,频率2 Hz/15 Hz。Ⅴ组在ECT治疗前30 min,先进行非穴位(百会穴、印堂穴旁开5 mm)电针刺激,操作方法及参数设置同Ⅳ组。
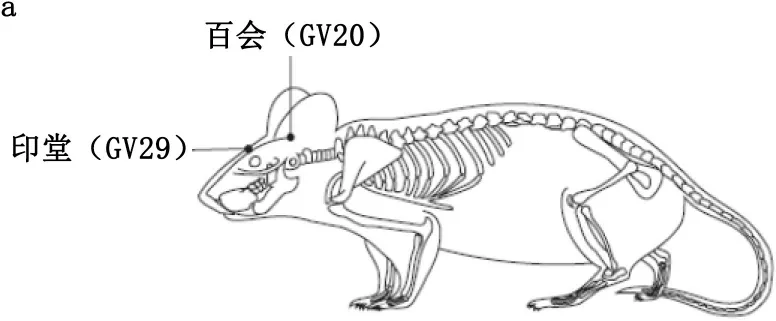
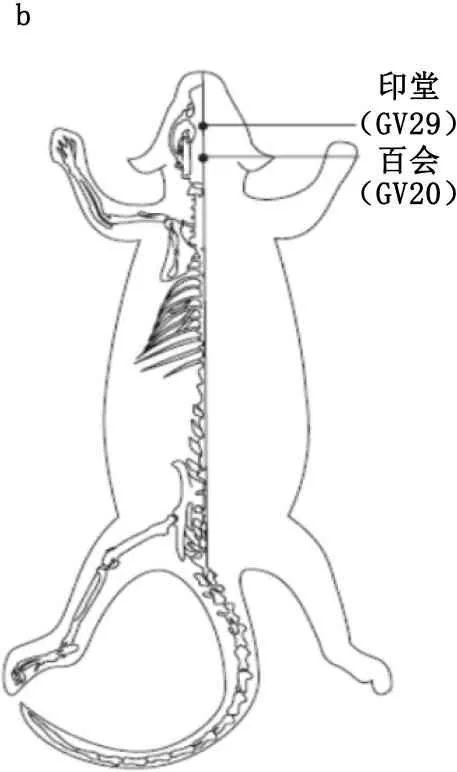
(a.侧面观;b.正面观)
图1 大鼠穴位示意图
1.4.3 电休克治疗:电针干预结束后,按组别进行电休克。Ⅱ组仅进行麻醉,不行ECT治疗;Ⅲ~Ⅴ组进行ECT治疗。采用改良电休克治疗仪(Niviqure公司,印度)进行电刺激。大鼠双耳连接电极,调整治疗参数为双向矩形波,电量120 mC,频率125 Hz,放电时间1 s,波幅0.8 A,波宽1.5 ms,电阻500~1 500 Ω。按下放电按钮,大鼠出现强直-阵挛-肌肉松弛表现,1次/d,连续6 d。
1.5 评价指标
1.5.1 Morris水迷宫:Morris水迷宫由1个圆柱形水池(直径1.2 m,高0.5 m)和图像采集分析系统组成。实验过程中,保持水温22~24 ℃,水深0.3 m。将水池平均划分为A、B、C、D共4个象限,每个象限的中点作为入水点。在D象限的中央放置圆柱形透明平台(直径10.0 cm,高29.0 cm)。在水迷宫的上方安置摄像系统,实时记录大鼠的运动轨迹。在训练期间,保持迷宫内外环境恒定不变[8]。适应性饲养大鼠7 d后,开始实验(作为实验第1天)。分别于实验的第1天(造模前第6天)、第28天(造模成功后第1天)和第40天(ECT结束后第1天)进行Morris水迷宫实验,包括定位航行实验和空间探索实验。
定位航行实验主要用于评估大鼠的学习记忆功能。每天在相同的时间段进行实验。每次实验的第1~4天进行大鼠游泳训练,第5天记录其定位航行时间。训练开始时,将平台置于D象限。训练前将大鼠先放在平台上适应30 s,再将大鼠从池壁任意一个起始点面向池壁放入。摄像系统追踪记录大鼠寻找平台的时间(即逃避潜伏期)和游泳路径,拍摄并连接路径追踪系统进行采集。每次游泳时限为100 s,在100 s内未找到平台者系统自动停止记录(逃避潜伏期记为100 s)。将大鼠引导至平台上,休息30 s后进行下一次试验。在实验第5天(造模前第2天)、第32天(造模成功后第5天)、第44天(ECT治疗结束后第5天),将大鼠从每一象限连续2次放入水池,记录其寻找平台的平均时间作为其逃避潜伏期,并记录其游泳路径[9]。
空间探索实验主要用于观察大鼠的空间记忆能力。在实验的第6天(造模前1天)、第33天(ECT治疗前1天)、第45天(ECT治疗结束后第6天),撤除原平台,将大鼠从任意1个象限的入水点面向水池壁放入水池中(所有大鼠均从同一位置入水)。记录100 s内大鼠穿越原平台区域的次数[10]。
1.5.2 AMPK与磷酸化AMPK(p-AMPK)表达的测定:于实验第6天(造模前1 d)、实验第33天(造模成功后6 d)和实验第45天(ECT治疗后6 d),水迷宫测试结束后即刻,从各组随机选取5只大鼠,腹腔注射10%水合氯醛0.3 mL/100 g麻醉,迅速断头并置于冰面上,分离大脑左右半球皮质,剥离器暴露并取出海马组织,置于-80 ℃冰箱保存。采用Western blot法测定海马AMPK及p-AMPK的表达。在海马组织中加入细胞裂解液和蛋白酶抑制剂PMSF(碧云天生物试剂研究所)进行冰上裂解2 h,超声裂解、低温离心取上清液,95 ℃变性5 min,-20 ℃冰箱冻存。检测p-AMPK指标的组织裂解时,另需加入磷酸酶抑制剂(碧云天生物技术研究所)。采用12%聚丙烯酰胺凝胶电泳分离蛋白,转至PVDF膜(Millipore公司,美国),加小鼠抗大鼠GAPDH内参抗体(稀释度1∶500)、AMPK一抗(稀释度1∶500)、p-AMPK一抗(稀释度1∶300)(Thermo公司,美国)置于摇床上室温孵育2 h,磷酸盐缓冲溶液(PBST)充分漂洗后加入辣根过氧化酶标记的二抗(稀释度1∶6 000,北京中杉金桥科技公司),摇床室温孵育1 h,膜与化学发光底物孵育后显影照相。采用Quantity one图像分析软件(Bio-Rad公司,美国)检测AMPK和p-AMPK的灰度值,以目的蛋白条带灰度值与内参GAPDH条带灰度值的比值反映目的蛋白的表达水平。
1.6 统计学分析
采用SPSS 19.0统计软件对实验数据进行分析,服从正态分布的计量资料以均数±标准差表示,组间及组内比较采用单因素方差分析(One-ANOVA),以P<0.05为差异有统计学意义。
2 结 果
2.1 各组定位航行实验结果比较
与Ⅰ组比较,Ⅱ~Ⅴ组第32天时以及Ⅱ组、Ⅲ组、Ⅴ组第44天时逃避潜伏期和游泳路径明显延长;与第5天时比较,Ⅱ~Ⅴ组第32天时以及Ⅱ组、Ⅲ组、Ⅴ组第44天时逃避潜伏期和游泳路径明显延长;与Ⅲ组比较,Ⅳ组第44天时逃避潜伏期和游泳路径明显缩短,差异均有统计学意义(P<0.05),见表1、2。
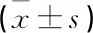
表1 各组大鼠逃避潜伏期比较 s
Ⅰ组:正常对照组;Ⅱ组:模型组;Ⅲ组:电休克组;
Ⅳ组:电针+电休克组;Ⅴ组:Sham+电休克组。
与Ⅰ组比较,*P<0.05;与实验第5天比较,#P<0.05;
与Ⅲ组比较,△P<0.05。
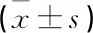
表2 各组大鼠游泳路径比较 cm
Ⅰ组:正常对照组;Ⅱ组:模型组;Ⅲ组:电休克组;
Ⅳ组:电针+电休克组;Ⅴ组:Sham+电休克组。
与Ⅰ组比较,*P<0.05;与实验第5天比较,#P<0.05;
与Ⅲ组比较,△P<0.05。
2.2 各组空间探索实验结果比较
与Ⅰ组比较,Ⅱ~Ⅴ组第32天时及Ⅱ组、Ⅲ组、Ⅴ组第44天时穿越平台次数明显减少;与第5天时比较,Ⅱ~Ⅴ组第32天时及Ⅱ组、Ⅲ组、Ⅴ组第44天时穿越平台次数明显减少;与Ⅲ组比较,Ⅳ组第44天时穿越平台次数明显增多,差异均有统计学意义(P<0.05),见表3。
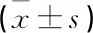
表3 各组大鼠穿越平台次数比较 次
Ⅰ组:正常对照组;Ⅱ组:模型组;Ⅲ组:电休克组;
Ⅳ组:电针+电休克组;Ⅴ组:Sham+电休克组。
与Ⅰ组比较,*P<0.05;与实验第5天比较,#P<0.05;
与Ⅲ组比较,△P<0.05。
2.3 各组海马AMPK和p-AMPK表达比较
与Ⅰ组比较,Ⅱ~Ⅴ组第32天时及Ⅱ组、Ⅲ组、Ⅴ组第44天时AMPK、p-AMPK表达水平明显下调;与第5天时比较,Ⅱ~Ⅴ组第32天时及Ⅱ组、Ⅲ组、Ⅴ组第44天时AMPK、p-AMPK表达明显下调;与Ⅲ组比较,Ⅳ组第44天时AMPK、p-AMPK表达明显上调,差异均有统计学意义(P<0.05),见表4。
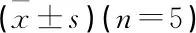
表4 各组大鼠海马AMPK、p-AMPK表达水平比较
Ⅰ组:正常对照组;Ⅱ组:模型组;Ⅲ组:电休克组;Ⅳ组:电针+电休克组;Ⅴ组:Sham+电休克组。
AMPK:腺苷酸活化蛋白激酶;p-AMPK:磷酸化腺苷酸活化蛋白激酶。
与Ⅰ组比较,*P<0.05;与实验第5天比较,#P<0.05;与Ⅲ组比较,△P<0.05。
3 讨 论
近年来,全球抑郁症患者的人数正在持续增长,即将成为威胁人类生命健康的第二大疾病[11]。重度抑郁症患者甚至有自杀倾向,给家庭和社会带来巨大的经济负担。因此,抑郁症的防治及其机制研究已经成为医学领域高度关注的热点问题。
在抑郁症的动物实验中,有多种造模方法,包括使用药物(利血平)、急性应激、强迫游泳等。但是,大多存在模型特征性不稳定、造模成功率低等弊端。慢性不可预知温和应激(CUMS)可较好地模拟临床中抑郁症的发病过程,诱导类似的神经生物学改变[12],具有模型稳定、实施方便等特点,已逐步成为抑郁症造模的经典方法。本实验中,作者采用CUMS刺激21 d后,各组大鼠均出现明显的抑郁样症状,证明造模成功。
电休克治疗技术最早由意大利神经精神病学家Ugo cerletti和Lucino Bini在1938年发明创造。与传统的抗抑郁药物相比,电休克可以更有效、更迅速地发挥其作用,而且通常只经过几次治疗就能获得明显的临床改善[13]。但是,治疗后可导致严重的认知功能受损,其具体机制不明。Fraser等[14]推测可能与电刺激导致物理损伤以及麻醉药物导致的脑细胞缺氧、代谢及递质紊乱有关。
百会穴为督脉经穴,位于巅顶部,其深处为脑之所在,具有振奋诸阳、激发经气、醒脑开窍、益气调神的功效,为治脑病要穴;印堂穴属经外奇穴,位于前额,两眉头的中间,具有通窍苏厥、宁心安神、镇惊止眩之效,其为临床调神的主穴,能调节髓海机能,益智醒脑,发挥抗痴呆的效用[15]。针灸作为中国的传统医学方法,具有无毒、无副作用等特点,在脑功能保护方面更具独特的效果。李斐斐等[16]研究发现,电针百会、大椎等穴位可提高小鼠海马CA1区神经元突触蛋白的表达,改善突触的超微结构,从而有效改善小鼠的学习记忆能力。
AMPK是一种蛋白激酶,由1个催化亚基(α亚基)和2个调节亚基(β亚基、γ亚基)组成的异三聚体[17]。最初从肝脏中分离出来,但3种亚基均可在人体和哺乳动物的多种组织中表达,包括肺、肾、心脏、骨骼肌和大脑[18]。AMPK在大多数哺乳动物组织和细胞类型中都有表达,包括在大脑神经元中,它被认为在控制能量平衡方面发挥着关键作用[19]。AMPK可通过调节下游多种信号通路激活导致的认知功能障碍,具有重要的脑保护效应[20]。
在本实验中,电休克治疗后各组大鼠的抑郁症状均得到了明显的改善,说明电休克在缓解抑郁症状方面具有显著效果。但是,治疗后各组大鼠的学习记忆能力明显下降,说明电休克在治疗抑郁症的同时可导致脑功能受损。电针预处理后,大鼠的逃避潜伏期和游泳路径明显短于电休克组,穿越平台次数明显增加,且海马AMPK和p-AMPK的表达明显上调,说明电针刺百会穴、印堂穴可以改善大鼠的学习记忆功能,可能与AMPK信号通路上调有关。在电休克治疗中,进行电针预处理具有重要的脑功能保护效应。
综上所述,电针预处理不但可以提高电休克治疗的效果,还可以减轻术后学习记忆能力的损害,其机制可能与上调AMPK信号通路有关。
