介入治疗胃静脉曲张:过去、现在和将来
2019-05-17罗薛峰
罗薛峰
作者单位:610041四川大学华西医院消化内科
门静脉高压患者胃静脉曲张(gastric varices,GV)发病率约为20%,包括孤立性胃静脉曲张(isolated gastric varices,IGV)和胃静脉合并食管静脉曲张(esophageal varices,EV)。食管胃静脉曲张是肝硬化门静脉高压的重要并发症,其发病率与肝脏代偿功能有关,在Child-Pugh A级患者中,食管胃静脉曲张的发病率达40%,在Child-Pugh C级患者则达到80%[1]。食管胃静脉曲张每年破裂出血的风险达5%~15%,其中约20%的患者在急性出血6周内死亡,40%~50%的患者出血可自行停止,然而6周内再出血率高达30%~40%,1~2年内再出血率则达60%[2-5]。一般认为,GV出血发生率低于单纯EV,约占曲张静脉出血来源的10%~30%[6]。需要重视的是,GV往往出血更严重,病死率更高,并且急性出血停止后再出血风险高达35%~90%[7]。由于EV发病率更高,临床研究开展充分,国内外指南对其治疗已建立起广泛的共识意见[8-11]。GV发病率相对较低,现有临床研究存在诸多不足之处,学术界争议较大,GV的最佳治疗策略尚未完全确定,仍有许多问题亟待探索,经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)和球囊阻断逆行静脉血管硬化术(balloon-occluded retrograde transvenous obliteration,BRTO) 是目前治疗GV的主流介入微创技术,本文拟对介入治疗GV的过去、现在和将来情况进行探讨。
一、胃静脉曲张分型
根据静脉曲张在胃内所处的位置,GV分为胃食管静脉曲张(gastroesophageal varices,GOV)和IGV。GOV分为GOV1型和GOV2型,GOV1型指食管静脉曲张跨过胃食管交界处,沿胃小弯侧向下延伸2~5 cm,GOV2型指食管静脉曲张跨过食管胃交界处向胃底大弯侧延伸,通常更长、更迂曲,多呈结节性或串珠样。IGV包括IGV1型和IGV2型,IGV1型指位于胃底部的静脉曲张,向贲门部延伸,多呈结节性或串珠样,而IGV2型可发生在胃内任何部位,如胃体、胃窦等(图1)。上述胃静脉曲张分型由印度学者Sarin等[7]建立,对GV流行病学研究、出血风险的评估和临床管理具有重要价值。据Sarin等[7]统计,GOV1型约占全部GV的75%,GOV2型占21%,IGV1型占不到2%,而IVG2型约占4%。需要注意的是,这是相对早期的GV流行病学数据,缺乏更新和其他地区的流行病学支持,有待更新。
二、胃静脉曲张的血流动力学
GV引流至体循环是经过食管、食管旁静脉曲张(胃食管静脉系统)或膈下静脉(膈静脉系统)[13]。引流路径大体上与Sarin分型相对应,GOV1型通过食管、食管旁曲张静脉引流(图2A),IGV1型通过左侧膈下静脉引流(图2B),GOV2型同时通过食管曲张静脉和膈下静脉引流(图2C)。脾静脉回流受限或闭塞致左侧静脉高压时,GV经胃短静脉和胃左静脉引流,与左侧门静脉高压相对应(图2D)。
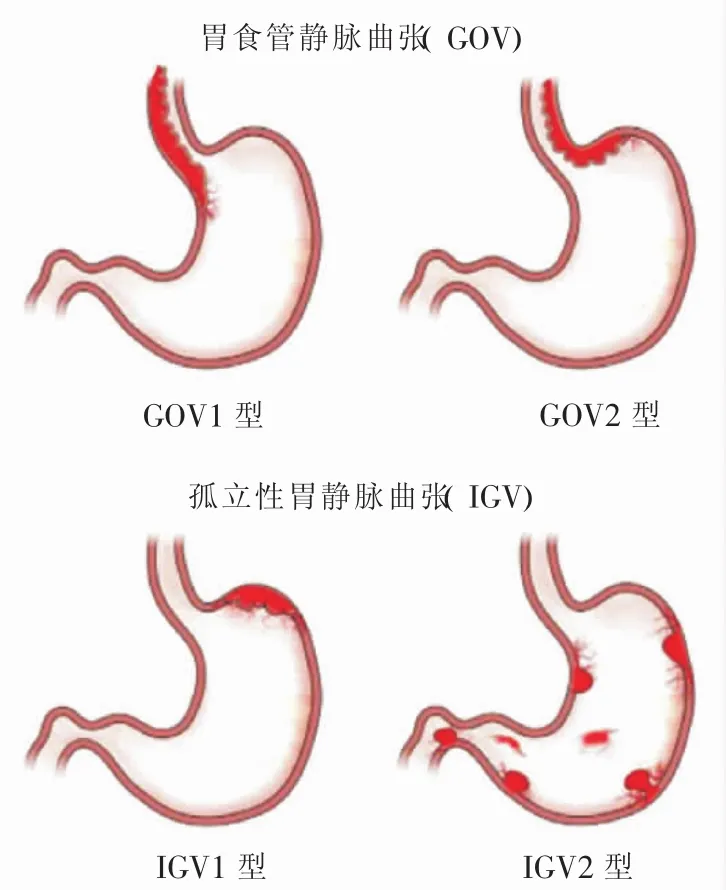
图1 胃静脉曲张Sarin分型[12]
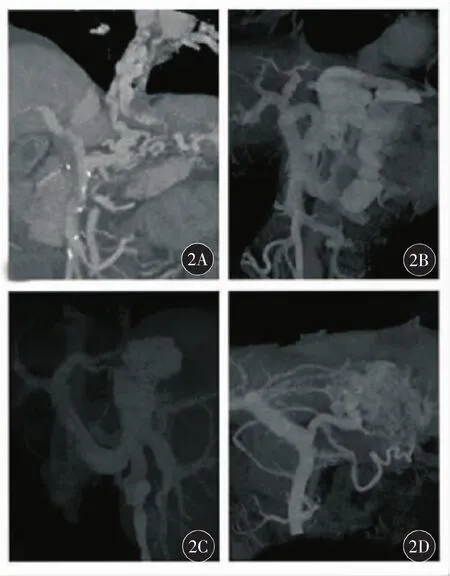
图2 胃静脉曲张引流至体循环的路径
食管下端静脉形成食管静脉丛,常与胃左静脉分支在胃壁内外吻合。食管静脉经胃食管静脉系统汇入上腔静脉。随着门静脉高压的进展,胃左静脉和奇静脉之间的吻合支可形成GOV。胃壁后上段及周围的胃静脉有可能与膈下静脉在胃裸区(胃膈韧带)形成吻合支。大多数IGV的出现是由于门静脉高压导致粗大门体侧支循环形成。左侧膈下静脉近端走形于横膈膜下方,部分分支越过横膈膜供应膈肌上表面,可与左心包旁膈静脉吻合。左膈下静脉也可与其他横膈膜周围或腹膜后血管交通,包括肋下静脉、肋间静脉、肾上腺静脉、右侧膈下静脉的吻合支,或与奇静脉系统交通[14]。因此,GV也可以通过上述血管网汇入体循环。
三、TIPS治疗胃静脉曲张
TIPS是经颈内静脉路径在肝静脉与门静脉之间的肝实质内建立分流道,从结构上可显著降低门静脉阻力,使门静脉系统血流经过分流道直接回到体循环,从而降低门脉压力以治疗门脉高压并发症[15]。早在1969年,Rösch等就提出了经颈静脉建立人工门体分流道的设想,并通过动物实验证实TIPS技术的可行性。随后的一系列成功的临床实践探索包括球囊和裸支架的使用,建立了现代意义上的 TIPS技术[16-21]。
采用裸支架TIPS的早期研究显示TIPS手术成功后绝大多数GV出血都能得到控制[22-23]。Chau等[22]纳入了112例难治性曲张静脉出血行拯救性TIPS的患者,其中84例为EV出血,28例为GV出血,随访中位时间为7个月,结果显示示两组患者的止血成功率、再出血率以及死亡率均无明显差异。Tripathi等[23]报道272例因胃或食管静脉曲张出血而接受TIPS的患者,GV患者TIPS术前门体压力梯度(portosystemic pressure gradient,PPG) 为 15.8 mmHg(1 mmHg=0.133 kPa),低于EV患者的21.4 mmHg。但两组患者TIPS术后的再出血率、分流道失效率和肝性脑病发生率无明显差异,且GV患者生存率更高。
以下多项研究比较了TIPS与内镜下组织胶注射治疗GV出血的临床疗效。其中一项回顾性研究发现内镜下注射组织胶治疗GV的再出血率高于TIPS(30%vs.15%),TIPS组住院时间更长且治疗费用更高,而两组的病死率无明显差异,说明内镜治疗可能具有更好的成本效益[24]。另一项回顾性研究结果显示,内镜治疗组和TIPS组的再出血率和病死率均相当,但TIPS组的肝性脑病发生率明显高于内镜治疗组[25]。Lo等[26]开展的一项前瞻性随机对照试验纳入了72例患者,均因肝硬化急性GV出血入院,所有患者在随机化入组前均用内镜下组织胶注射控制活动性出血,然后均采用TIPS与内镜下组织胶注射预防胃底静脉曲张再出血,结果显示TIPS组的GV再出血率明显较低(11%vs.38%),但TIPS组的肝性脑病发生率较高(26%vs.3%),两组的并发症发生率和生存率无明显差异。较新的一项非随机对照研究比较了TIPS与内镜下组织胶注射治疗GV出血的效果,结果显示两组在控制急性出血、预防再出血和生存率方面无明显差异,但TIPS组术后肝性脑病的发生率更高[27]。上述研究显示,TIPS虽然能够很好的控制和预防GV出血,其临床疗效与EV大体相当,也同样存在术后肝性脑病高发的风险。
笔者总结了2011年至2015年因肝硬化伴GV出血于四川大学华西医院行TIPS治疗的患者共82例,其中56例(68.3%)内镜分型为GOV2型,76例(96.7%)存在胃肾分流,平均Child-Pugh和MELD评分分别为(7.3±1.9)分和(9.3±3.9)分,55例患者行TIPS联合GV栓塞,余27例仅行TIPS[28]。随访21.9个月后,13例患者发生曲张静脉再出血(TIPS联合栓塞组6例,TIPS组7例)。TIPS联合栓塞组的曲张静脉累积再出血率明显低于TIPS组,术后1年:3.8%vs.16%,术后2年:13.4%vs.28%;但两组的支架通畅率、肝性脑病发生率和病死率均没有统计学差异;结果证明单纯门体分流降低门静脉压力并不能有效控制和预防GV出血。新的疑问随之产生,分流和栓塞在预防再出血中各自扮演了什么角色,既然单纯分流临床疗效不佳,单纯栓塞是否能够有效地控制出血?
四、BRTO治疗胃静脉曲张
BRTO是指经股静脉或颈内静脉将球囊导管插入胃肾或胃腔分流道的流出端,充盈球囊以阻止血液流动,并注射硬化剂以消除静脉曲张[29]。大多数学者认为Kanagawa是这一技术的发明者,其在1991-1993年进行临床探索并发表BRTO相关论文[30]。Saad等[31]认为尽管Kanagawa比较早的发表BRTO相关技术论文,提出并统一了BRTO技术名称,但首例BRTO仍应归功于印第安纳大学的Olson等。早在1984年,Olson等[32]就尝试球囊封堵胃肾流出道,并成功使用乙醇完成了首例GV硬化治疗。
2003年,韩国的一项小样本随机对照研究比较了BRTO与TIPS治疗14例GV活动性出血合并胃肾分流的患者,结果示两组的即刻止血、再出血及肝性脑病情况无明显差异[33]。Hong等[34]比较了BRTO与内镜下组织胶注射治疗GV急性出血的疗效,结果示内镜治疗组和BRTO组的止血成功率无明显差异(100%vs.77%),但内镜治疗组的再出血率高于BRTO组(71%vs.15%),两组的并发症(7.1%vs.15.4%)和死亡率(50%vs.23.1%)无明显差异[34]。一项样本量较大的回顾性研究评估了6家大学附属医院213例患者接受BRTO治疗胃静脉曲张出血的临床预后,结果发现BRTO的技术成功率为97%,与手术相关的并发症(如肺栓塞和肾脏梗死)发生率为4.4%,151例行内镜复查的患者中79例(52.3%)GV 消失,110例(72.8%)明显缓解[35]。平均随访3年后,39例(18.3%)患者再出血,GV出血7例,EV出血18例,非静脉曲张出血4例,原因不明10例[35]。Cho等[36]分析了49例GV合并自发性分流道的患者,BRTO手术成功率为84%,2例死于围手术期并发症,无静脉曲张复发或再出血患者。
BRTO在日韩临床应用经验较多,发表论文也是国际上最多的,欧美国家近年来开展例数也在逐渐增加。但目前BRTO技术国内发展不尽如人意,一方面是部分学者关注不够,理念上仍片面追求降低压力,另一方面是缺乏合适的介入器械。笔者所在团队在李肖教授的带领下一直在探索BRTO技术的规范化和国产化,并于2017年发表了基于华西经验的BRTO技术[37]。2014-2015年,我院采用BRTO技术(聚桂醇泡沫硬化)治疗32例肝硬化合并GV出血患者,BRTO技术成功率为96.9%,仅有1例患者因缺乏合适的球囊无法彻底封堵分流道。泡沫硬化可以大大降低硬化剂的使用量,减少硬化剂相关并发症,本组患者聚桂醇的平均用量为12.4 ml(8~20 ml)。BRTO术后2例患者新发门静脉血栓自行缓解,7例(22.6%,7/31)患者EV加重行内镜治疗,5例(16.1%,5/31)患者腹水加重。随访2年后,2例患者死亡,31例患者经内镜或CT证实GV消失。
需要注意的是,BRTO会增加PPG,加重食管静脉曲张或导致腹水形成。Park等[38]关于BRTO的荟萃分析研究纳入24项研究,总计1 016例患者,技术成功率6.4%,临床成功率97.3%,严重并发症发生率2.6%,而食管静脉曲张新发或加重比例33.3%,腹水加重比例9.2%。对于BRTO术后EV加重风险及内镜随访、治疗策略,学术界尚没有共识意见。笔者的经验是:IGV1型患者BRTO术后需每半年至1年行内镜复查,必要时联合食管静脉曲张套扎(esophageal variceal ligation,EVL)或使用非选择性β受体阻滞剂,对于GOV2型患者则需要尽快开始序贯行EVL治疗以根除EV。
五、BRTO和TIPS疗效比较
虽然BRTO和TIPS这两种介入微创技术几乎同时进入临床应用,但对不同介入术式的使用偏好存在明显的东西方差异。BRTO治疗GV在东方国家(如日本和韩国)更为普遍,遗憾的是西方国家(如美国)在Olson之后对BRTO治疗GV领域并没有太多的探索。这或许是因为美国学者经历了经皮经肝曲张静脉栓塞失败的教训,更认同门体分流(外科分流或TIPS)降低门静脉压力以治疗门脉高压并发症。另一个原因是美国介入医师并不熟悉日本使用的硬化剂(油酸氨基乙醇),而美国市场也缺乏油酸氨基乙醇拮抗剂。随着BRTO的疗效得到越来越多临床研究的支持,相比于TIPS,BRTO也没有分流道失效和肝性脑病的并发症,使得BRTO在欧美地区比过去更受欢迎[31]。
BRTO和TIPS治疗GV的机制不尽相同,但它们都是主流介入技术,具有较好的可比性。比较这两项介入手术治疗GV的对照研究目前还比较少,多为单中心研究且样本量较少。2015中国学者发表的一项荟萃分析纳入了5项比较BRTO和TIPS的临床研究,其中210例患者行BRTO,143例患者行TIPS,研究显示BRTO的技术成功率(87.91%)略低于TIPS(98.33%),但并无统计学差异,这可能是因为BRTO的应用受限于专用设备以及介入医师经验不足;BRTO不仅再出血率明显低于TIPS(7.43%vs.22.79%),肝性脑病发病率也更低一些(1.43%vs.29.79%)[39]。这一结果可能是因为BRTO控制GV出血的机制在于使门体侧支循环彻底闭塞从而根除静脉曲张,并没有在肝内建立人工分流道,大大降低了术后分流性脑病的风险。不足之处在于这项研究纳入的患者基线不一致,既包括没有发生静脉曲张破裂出血的患者,也包括急性出血恢复的患者,影响了结论的可信度。
另有两项来自韩国的回顾性研究比较了BRTO和TIPS治疗GV的临床预后[40-41]。Kim等[40]的研究纳入52例患者(25例行BRTO和27例行TIPS),两组的技术成功率、再出血率和生存率均无明显差异,但BRTO组的肝性脑病发生率更低(0vs.22%)。Lee等[41]的研究纳入了142例GV患者(95例行BRTO和47例行TIPS),45.1%的患者合并肝细胞肝癌,结果示BRTO组患者再出血率(术后3年:22.7%vs.48.2%)和肝性脑病发生率更低(0%vs.29.8%),且生存期更长(术后3年:72.3%vs.48.5%),但和死亡率相关的预测因子是肝细胞肝癌、更高的Child-Pugh评分和术后肝性脑病,而非BRTO本身。以上研究结果均提示BRTO可能比TIPS能更好地控制GV出血并降低肝性脑病的发生风险。
六、共识意见
受限于高质量临床研究的匮乏,GV治疗策略目前尚缺乏广泛接受的共识意见。就GV二级预防而言,美国肝病学会推荐TIPS或BRTO为一线治疗,内镜下组织胶注射为二线治疗[10]。英国指南则推荐内镜下组织胶注射为一线治疗,TIPS为二线治疗[8]。国际上最有影响力的Baveno共识意见则认为内镜下组织胶注射、β受体阻滞剂、内镜联合药物治疗或TIPS为均可应用于预防GV再出血[9]。与此同时,Baveno共识和英国指南都认为BRTO治疗GV值得进一步探索。
七、总结
TIPS和BRTO都是能够有效控制和预防GV出血的介入微创技术。但需要大量的临床研究去明确不同术式的风险利弊及在不同人群的临床应用价值。理想情况下,应该根据患者的具体情况选择个体化治疗策略:(1)是用于一级预防还是二级预防,或急性出血的控制;(2)分型是GOV2型还是IGV1型;(3)是否合并大量腹水、分流性脑病、门静脉血栓、肝细胞肝癌等;(4)患者的基础肝脏功能如何。以上因素都可能影响临床上的治疗选择,在某些患者中,TIPS联合BRTO或许才是最佳的方案。在既往指南的制订过程中,大多借鉴国外临床研究而没有太多国内经验可供参考。我们有责任和担当,通过严格设计的前瞻性临床研究,探索中国GV患者的最佳治疗策略,为国际门脉高压治疗指南提供高质量的中国循证医学证据的支持。
