珊瑚共附生黄柄曲霉次级代谢产物研究
2019-05-16王洪亮姜文丽许聪聪
王洪亮,姜文丽,李 冉,许聪聪,张 文
(1.海军军医大学药学院 上海 200433; 2.陆军军医大学士官学校,河北 石家庄 050000;3.安徽中医药大学,安徽 合肥 230000)
真菌是珊瑚共附生微生物的主要组成部分,目前已报道的珊瑚共附生真菌涵盖44个属[1]。在海洋高盐、高压、低温、寡营养的生存环境下,以及真菌与宿主珊瑚之间的相互作用下,形成了独特的代谢机制,产生了许多结构新颖、活性显著的次级代谢产物[2]。
曲霉属(Aspergillussp.)真菌是海洋真菌中优势菌种之一,分布非常广泛[3]。黄柄曲霉(Aspergillusflavipes)属于伞囊菌目发菌科曲霉属,在海洋和陆地均有分布。其次级代谢产物的主要类型包括细胞松弛素类[4-6]、epicoccine衍生物[7-8]、丁内酯类[9]等。本次研究的黄柄曲霉是采自东沙的短足软珊瑚(Cladiellasp.)中分离得到的,通过运用多种色谱分离技术,得到4个细胞松弛素类化合物(图 1)。对这4个化合物进行体外抑制破骨细胞分化活性测试中,发现化合物3和4对BMMs向成熟破骨细胞分化有不同程度的抑制活性。本文是对化合物3和4抑制破骨细胞分化活性的首次报道。
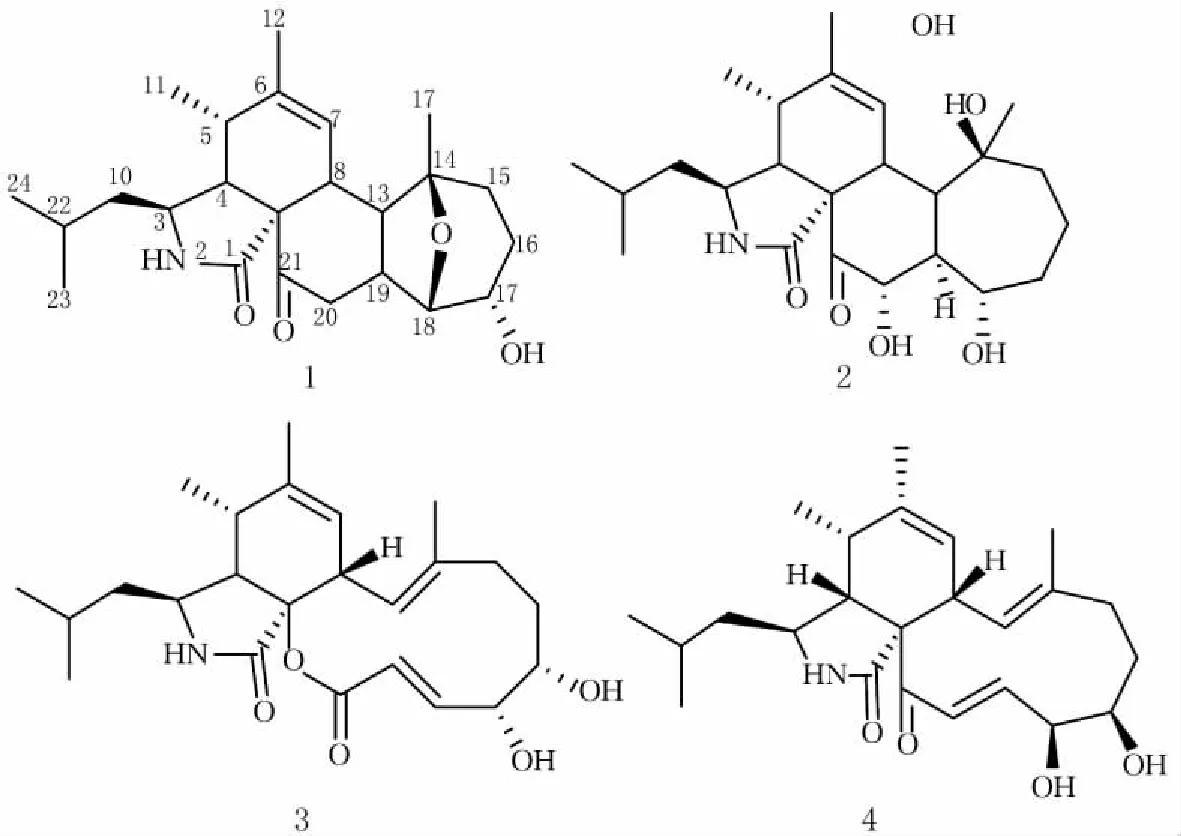
图1 4个细胞松弛素类化合物的结构式
1 材料和方法
1.1 样品
从采自东沙的短足软珊瑚(Aspergillusflavipes),菌种目前保存于海军军医大学药学院海洋药物研究中心备查(菌株编号 33)。菌株接种至20 L Biomalt琼脂培养基上,28 ℃培养28 d得到真菌发酵物。
1.2 主要仪器和试剂
仪器:制备HPLC [DAD检测器](美国Aglient公司),DRX 500核磁共振仪(瑞士Bruker公司),高压灭菌锅(上海申安医疗器械厂)。
试剂:α-MEM培养基(美国Hyclone公司),灭活胎牛血清(美国Thermo Fisher Scientific公司),巨噬细胞集落刺激因子、核因子kB受体活化因子配基、抗酒石酸酸性磷酸酶(美国R&D公司)。
1.3 提取与分离
真菌经28 d发酵后,加入乙酸乙酯对发酵物进行超声萃取(5次),合并萃取液,经减压浓缩得到粗浸膏10.7 g。采用正相硅胶柱层析,经梯度洗脱[二氯甲烷-甲醇(80∶1 ~ 1∶1)]得到12个组分(Fr.1 ~ 12)。Fr.7经 Sephadex LH-20 凝胶柱层析[二氯甲烷-甲醇( 2 ∶1)]、正相硅胶柱层析[二氯甲烷-甲醇( 40∶1)]和制备HPLC[甲醇-水(70∶30);流速∶2.0 ml/min]得化合物1(tR=21.0 min,13.3 mg);Fr.9 经Sephadex LH-20 凝胶柱层析[二氯甲烷-甲醇(2∶1)]、正相硅胶柱层析[二氯甲烷-甲醇(40∶1)]和制备HPLC[甲醇-水(63∶37);流速∶2.0 ml/min]得到化合物2(tR=29.0 min,8.1 mg)和3(tR=32.5 min,5.0 mg);Fr.10 经 Sephadex LH-20 凝胶柱层析[二氯甲烷-甲醇(2∶1)]、正相硅胶柱层析[二氯甲烷-甲醇(30∶1)]和制备HPLC[甲醇-水(75∶25);流速∶2.0 ml/min]得化合物4(tR=19.0 min,18.2 mg)。
1.4 活性测试
从C57BL/6小鼠的股骨及胫骨分离出小鼠骨髓单核巨噬细胞(bone marrow macrophage cells,BMMs),采用CCK-8法检测化合物1-4对BMMs细胞毒性。检测无毒性后,向BMMs中加入含有M-CSF(30 ng/ml)和RANKL(100 ng/ml)的α-MEM培养基,以受试化合物作为实验组,不加化合物的为对照组,37 ℃,5% CO2培养箱中孵育,每48 h换一次含有化合物的培养基,并观察细胞状态。孵育5 ~ 6 d,当对照组出现成熟破骨细胞时,停止换液。使用TRAP染色,染色后在显微镜下观察并拍照。采用Image J 图像分析软件对TRAP+ 面积进行分析。
2 结果与分析
2.1 化合物的结构鉴定
化合物1:白色粉末,ESI-MS (m/z)∶402.26 [M+H]+,分子式为C24H35NO4。其NMR数据如下:1H-NMR (600M ,CDCl3)δ=3.08 (1H,dt,J=10.5,3.5 Hz,H-3),2.62 (1H,dd,J=5.0,3.5 Hz,H-4),2.34 (1H,brs,H-5),5.40 (1H,s ,H-7),2.41 (1H,brd,H-8),1,26,1.70 (2H,m,H-10),1.14 (3H,d,J=7.5 Hz,H-11),1.76 (3H,brd,H-12),2.84 (1H,dd,H-13),1.56,1.68 (2H,m ,H-15),1.72,1.96 (2H,m,H-16),3.78 (1H,brs,H-17),3.64 (1H,d,J=3.4 Hz,H-18),3.26 (1H,dd,J=9.0,9.0 Hz,H-19),2.52 (2H,d,J=9.0 Hz,H-20),1.55 (1H,m,H-22),0.91 (3H,d,J=6.5 Hz,H-23),0.94 (3H,d,J=6.5 Hz,H-24),1.19 (3H,s,H-25);13C-NMR (150M,CDCl3)δ=173.9 (C-1),52.1 (C-3),52.0 (C-4),35.2 (C-5),139.9 (C-6),127.3 (C-7),36.7 (C-8),64.3 (C-9),47.6 (C-10),13.8 (C-11),20.4(C-12),44.5 (C-13),82.1 (C-14),38.7 (C-15),27.0 (C-16),68.1 (C-17),83.5 (C-18),36.4 (C-19),43.0 (C-20),210.9 (C-21),25.4 (C-22),21.3 (C-23),24.0 (C-24),22.7 (C-25)。以上数据与文献[10]报道一致,确定化合物1为trichalasin H。
化合物2:白色粉末,ESI-MS (m/z)∶420.27 [M+H]+,分子式为C24H37NO5。其NMR数据如下:1H-NMR (600M,CDCl3)δ=3.07 (1H,dt,J=10.5,3.4 Hz,H-3),2.63 (1H,t,J=4.5 Hz,H-4),2.34 (1H,m,H-5),5.40 (1H,s,H-7),2.40 (1H,m,H-8),1.27,1.68 (2H,m,H-10),1.14 (3H,d,J=7.2 Hz,H-11),1.75 (3H,s,H-12),2.95 (1H,m,H-13),2.53,2.95 (2H,m,H-15),1.41,1.88 (2H,dd,td,J=13.2,5.0 Hz,J=13.1,4.6 Hz,H-16),1.71,2.01 (2H,m,H-17),3.55 (1H,brs,H-18),2.53 (1H,m,H-19),3.69 (1H,s,H-20),1.56 (1H,m,H-22),0.92 (3H,d,J=6.5 Hz,H-23),0.89 (3H,d,J=6.5 Hz,H-24),1.21 (3H,s,H-25);13C-NMR (150M,CDCl3)δ=174.0 (C-1),52.1 (C-3),51.9 (C-4),35.3(C-5),140.0 (C-6),127.2 (C-7),36.5 (C-8),64.4 (C-9),47.6 (C-10),13.7 (C-11),20.4 (C-12),39.0 (C-13),82.8 (C-14),42.7 (C-15),35.2 (C-16),24.8 (C-17),66.8 (C-18),42.8 (C-19),84.3 (C-20),210.3 (C-21),25.3 (C-22),24.0 (C-23),21.3 (C-24),23.4 (C-25)。以上数据与文献[9]报道一致,确定化合物2为aspergilluchalasin。
化合物3:白色粉末,ESI-MS (m/z)∶418.60 [M+H]+,分子式为C24H35NO5。其NMR数据如下:1H-NMR (600M,CD3OD)δ=3.21 (1H,m,H-3),2.89 (1H,dd,J=3.0,5.1 Hz,1H),3.04 (1H,brs,H-5),5.25 (1H,brs,H-7),3.82 (1H,d,J=11.1 Hz,H-8),1.47,1.71 (2H,m,H-10),1.25 (3H,d,J=7.3 Hz,H-11),1.76 (3H,m,H-12),6.15 (1H,dt,J=10.8,1.6 Hz,H-13),2.14,2.32 (2H,m,H-15),1.37,2.10 (2H,m,H-16),3.75 (1H,brd,J=5.4 Hz,H-17),4.46 (1H,s,H-18),7.25 (1H,dd,J=2.45,15.3 Hz,H-19),5.91 (1H,dd,J=2.45,15.3 Hz,H-20),1.70 (1H,m,H-22),0.94 (3H,d,J=6.0 Hz,H-23),0.94 (3H,d,J=6.0 Hz,H-24),1.37 (3H,brs,H-25);13C-NMR (150M,CD3OD)δ=175.3 (C-1),51.7 (C-3),53.5 (C-4),35.5 (C-5),141.5 (C-6),125.2 (C-7),41.1 (C-8),90.3 (C-9),50.0 (C-10),14.2 (C-11),19.7 (C-12),123.8 (C-13),140.5 (C-14),40.7 (C-15),28.4 (C-16),79.2 (C-17),74.4 (C-18),154.5 (C-19),120.5 (C-20),169.3 (C-21),25.7 (C-22),22.0 (C-23),24.1 (C-24),15.4(C-25)。以上数据与文献[11]报道一致,确定化合物3为aspochalasin I。
化合物4:白色粉末,ESI-MS (m/z)∶402.26 [M+H]+,分子式为C24H35NO4。其NMR数据如下:1H-NMR (600M,CDCl3)δ=3.14 (1H,ddd,J=9.5,3.0,3.0 Hz,H-3),3.03 (1H,dd,J=6.0,3.0 Hz,H-4),2.49 (1H,m,H-5),5.44 (1H,brs,H-7),2.90 (1H,d,J=10.5 Hz,H-8),1.20 (2H,m,H-10),1.23 (3H,d,J=6.0 Hz,H-11),1.75 (3H,brs,H-12),5.96 (1H,d,J=10.5 Hz,H-13),2.18 (2H,m,H-15),1.45,2.04 (2H,m,H-16),3.80 (1H,brs,H-17),4.56 (1H,s,H-18),6.40 (1H,dd,J=16.4,4.8 Hz,H-19),7.15 (1H,d,J=16.5 Hz,H-20),1.51 (1H,m,H-22),0.89 (3H,d,J=7.0 Hz,H-23),0.89 (3H,d,J=7.0 Hz,H-24),1.31 (3H,d,J=0.5 Hz,H-25);13C-NMR (150M,CDCl3)δ=175.0 (C-1),51.2 (C-3),49.7 (C-4),35.2 (C-5),140.5 (C-6),125.9 (C-7),43.7 (C-8),68.1 (C-9),48.5 (C-10),13.6 (C-11),20.0 (C-12),124.4 (C-13),137.4 (C-14),39.6 (C-15),29.5 (C-16),79.3 (C-17),75.7 (C-18),141.5 (C-19),129.8 (C-20),197.6 (C-21),25.2 (C-22),21.6 (C-23), 23.7 (C-24), 15.7 (C-25)。以上数据与文献[12]报道一致,确定化合物4为aspochalasin D。
2.2 活性测试结果
细胞毒性检测结果表明,所有化合物在10 μmol/L浓度下对BMMs细胞没有毒性。抑制破骨细胞分化结果显示,在5 μmol/L和10 μmol/L浓度下,化合物3和4对BMMs向破骨细胞分化表现出不同程度的抑制(见图2)。
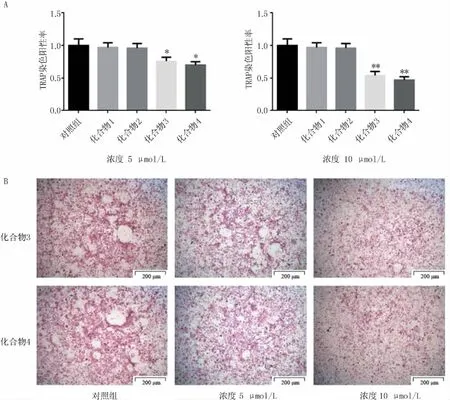
图2 化合物1~4抑制破骨细胞分化结果 A.TRAP+ 细胞面积统计;B.TRAP染色显示破骨细胞形态(40×);*P<0.05,**P <0.01,与对照组比较
3 讨论
本次研究从东沙短足软珊瑚共附生的黄柄曲霉中分离得到4个细胞松弛素类化合物。细胞松弛素在真菌中来源非常广泛,在多个真菌属中都有发现,包括曲霉属[5,13](Aspergillussp.),青霉属[14](Penicilliumsp.),团碳菌属[15](Hypoxylonsp.),茎点霉属[16](Phomasp.)等。其结构上都具有异吲哚酮骈合大环的结构,主要变化集中在大环的取代基上。这类化合物具有多种生物活性,包括抗菌、抗肿瘤、抗HIV、自由基清除等[4,10-11,17]。文献报道化合物1具有抗菌活性,同时对肿瘤细胞HL-60具有细胞毒性[10];化合物3具有抑制黑色素生成作用[11];化合物4具有诱导IL-3依赖的Ba/F3细胞凋亡活性[12];化合物3和4都对肿瘤细胞THP1、HL-60、PC3具有较弱的细胞毒性[18]。
研究表明,在骨骼形成和发育过程中,破骨细胞和成骨细胞处于相互协调的动态平衡状态。当破骨细胞数量增加,破骨功能增强时,这一平衡将被打破,会造成骨质疏松,增加骨折风险等骨代谢疾病[19-20]。本研究中测试了这4个化合物对破骨细胞分化的抑制活性,发现化合物3和4对破骨细胞分化有一定程度的抑制活性,可以减少破骨细胞的生成。表明这两个化合物对新型抗骨质疏松药物的研究具有重要意义。本文是对化合物3和4抑制破骨细胞分化活性的首次报道。化合物3和4在结构上都含有C-13,14和C-19,20双键,推测活性的存在可能与这两个位置的双键有关。
