45份小麦种质赤霉病抗性评价与农艺性状分析
2019-05-15徐乔乔李巧云牛吉山于东艳段宗彪梁晓龙焦志鑫
徐乔乔,李巧云,牛吉山,于东艳,段宗彪,梁晓龙,焦志鑫
(河南农业大学国家小麦工程技术研究中心/河南省粮食作物生理生态与遗传改良重点实验室,河南郑州 450002)
小麦赤霉病(Fusarium head blight of wheat, FHB)主要由禾谷镰刀菌(FusariumgraminearumSchw.)侵染引起,该病菌可侵染小麦苗、叶、穗等部位,引起苗腐、茎基腐、穗枯等,是温暖潮湿地区常见的重要小麦病害[1-2]。小麦赤霉病除引起小麦产量、籽粒品质和商用价值降低外,病原菌产生的真菌毒素,如脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)等严重影响人和动物的健康[3-4]。我国小麦赤霉病由长江中下游地区向黄淮麦区蔓延,发病面积日渐扩大,对国内小麦生产和粮食安全带来严重威胁[5-7]。培育抗赤霉病品种是防治小麦赤霉病危害最经济、有效的方法。然而,小麦对赤霉病的抗性属于数量性状遗传,受环境和遗传因素的影响,抗病性复杂[8],且缺乏抗赤霉病的小麦资源。小麦赤霉病侵染主要在花期,抗病性鉴定受时间限制,对小麦抗赤霉病育种有一定的影响[9-10]。
目前,已鉴定出与小麦赤霉病抗性相关的QTL(quantitative trait loci)200多个[11]。其中,SSR(simple sequence repeats)标记 Xbarc147、Xgwm493和Xgwm 533等与抗赤霉病的主效QTL基因Fhb1连锁[12-16]。近些年,这些分子标记已经用于小麦抗赤霉病育种工作中,但至今尚未见利用这些主效QTL培育成生产上推广品种的报道。本研究以F.graminearum菌株F15为供试菌,采用微量移液器进行单花滴注接种的方法,以国家小麦工程技术研究中心小麦遗传育种课题组的小麦品系09X15作为感赤霉病对照,对从南京农业大学等七家单位收集的45个小麦材料进行赤霉病的抗性鉴定与农艺性状调查,并利用分子标记检测这些材料携带Fhb1基因的情况,以期获得农艺性状较好且高抗赤霉病的小麦种质资源,加快抗赤霉病株系的选育进程。
1 材料与方法
1.1 试验材料及田间种植
供试的45个小麦材料收集自南京农业大学、山东农业大学、四川农业大学等七个单位,其中,苏麦 3 号用作抗赤霉病对照,09X15(高产)用作感赤霉病对照,具体信息见表1。
供试的禾谷镰孢菌(F.graminearum)株F15由南京农业大学马正强教授惠赠。
小麦材料于2014-2015、2015-2016与2016-2017三个小麦生育期(下简称2015、2016与2017)在河南荥阳市豫龙镇试验田种植。三次重复,随机排列。每个材料种植一行,每平方米种植195粒,行长1 m,行距20 cm。试验田的管理如施肥、除草、灌溉及虫害防治同常规育种田。
1.2 赤霉病抗性鉴定
采用微量移液器进行单花滴注接种。在小麦始花期,于下午4点以后,每个重复选取10个单穗,每穗选中部1个小花注射F15孢子悬浮液10 μL,分生孢子悬浮液的浓度为5×105· mL-1,套袋保湿 3 d。接菌21 d后调查发病小穗数与总小穗数,并计算发病小穗率(percentage of diseased spiklet, PDS)。
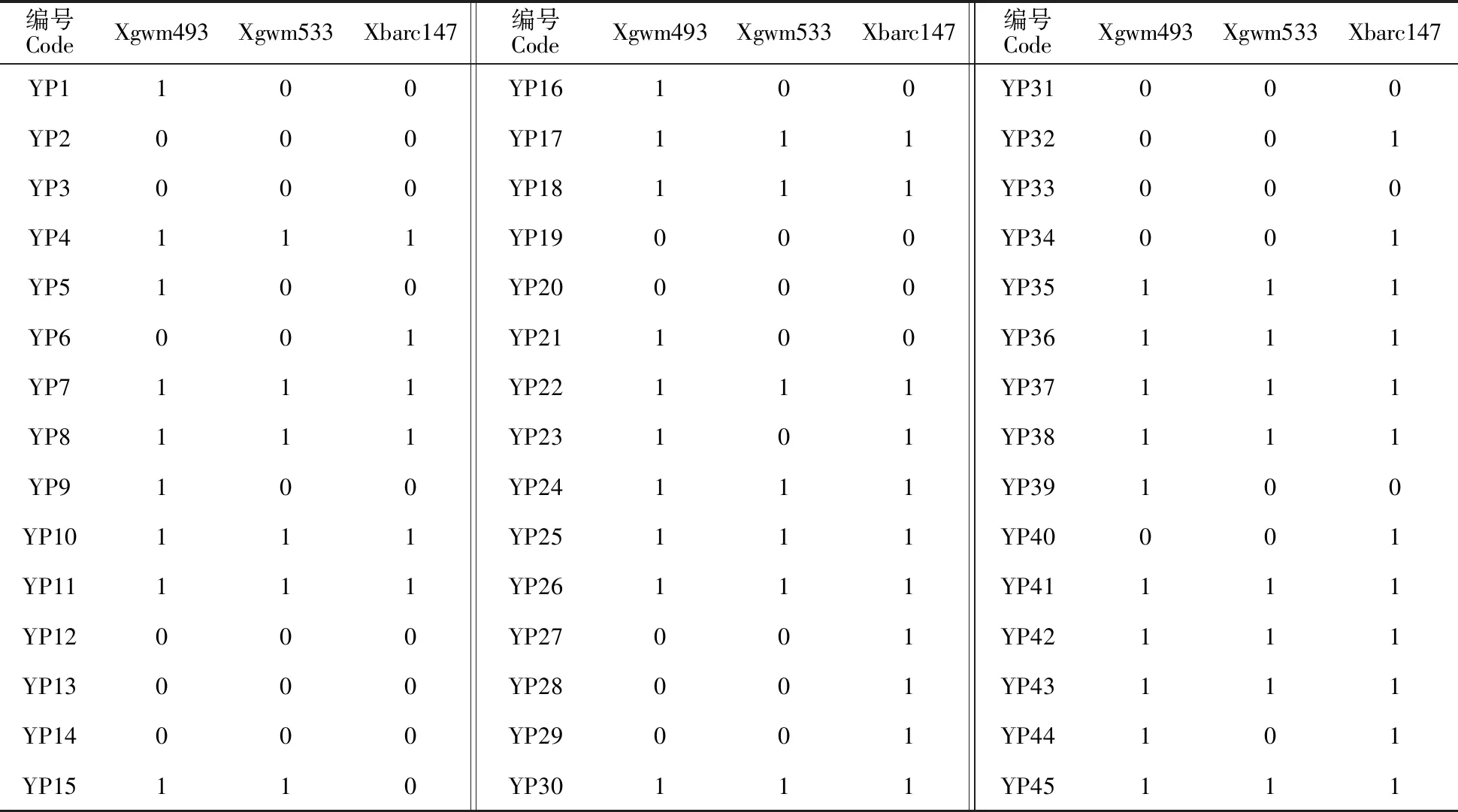
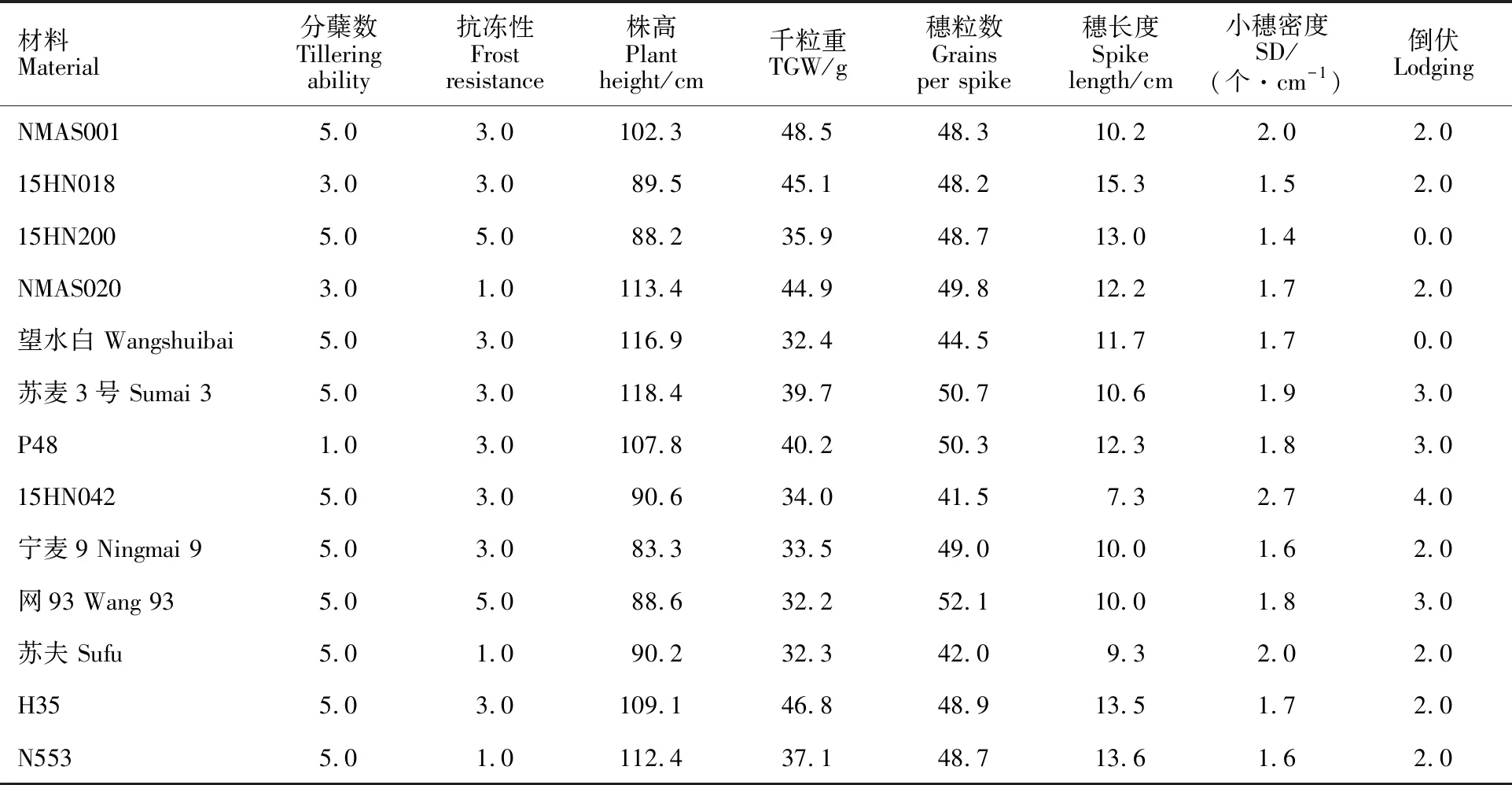
参照国家农业行业标准(NY/T 1443.4-2007)进行小麦抗赤霉病抗性评价。小麦赤霉病严重度分为 5 个等级:0 级(接种小穗无可见发病症状),1 级(小穗发病或相邻个别小穗发病,病斑不扩展到穗轴),2 级(穗轴发病,病小穗率<1/4),3 级(穗轴发病,病小穗率1/4~1/2),4 级(穗轴发病,病小穗率>1/2)。小麦赤霉病抗性分为 5 个等级:免疫(I,X=0),抗(R,0 1.3.1 基因组DNA提取 小麦基因组DNA的提取参照 Saghai-Maroof 等[17]报道的 CTAB 法进行,DNA干燥后溶于 TE 缓冲液,4 ℃贮存备用。 1.3.2 分子标记检测 与Fhb1基因连锁的三个SSR标记 Xgwm493、 Xgwm533和Xbarc147检测参照文献[16],目的条带大小分别为210 bp、140 bp、120 bp,以苏麦 3号为阳性对照,09X15 为阴性对照。PCR 反应体系为 10 μL,含5.0 μL 2×M5 Taq PCR Mix,上、下游引物(浓度均为10 μmol·L-1)各 0.4 μL,1.0 μL 模板 DNA(50 ng·μL-1),ddH2O补足至 10 μL。PCR 扩增程序:94 ℃ 预变性 3 min;94 ℃变性 30 s,56/60 ℃退火 30 s(Xgwm493和Xgwm533退火温度为60 ℃、Xbarc147退火温度为56 ℃),72 ℃延伸 30 s,35个循环;72 ℃延伸 10 min;4 ℃保存。 表1 45 份小麦材料2015-2017年的赤霉病抗性田间鉴定评价Table 1 Evaluation on resistance of 45 wheat germplasm to Fusarium head blight based on field tests from 2015 to 2017 -:数据丢失。-:Missing data.JAAS:Jiangsu Lixiahe Agricultural Science and Technology Institue. PCR 产物用8%(w/v)的非变性聚丙烯酰胺凝胶,在1倍TBE缓冲液500 V电泳70 min,银染后照相观察并记录。 分蘖能力与抗冻性:参照中华人民共和国农业行业标准(NY/T 1301-2007)测定。 株高:开花期每个材料取10株测量主茎高度,取平均值。 穗长、小穗数、穗粒数、千粒重调查:小麦收获期每个材料每重复选10株的主茎穗,测量穗长、小穗数、穗粒数、小穗密度(单穗的小穗数/穗长);小麦收获晾干后测千粒重。 从表1可以看出,45份小麦材料中,共有13个材料表现抗赤霉病,其中,4个材料(NMAS001、宁麦9号、网93、苏夫)在2015、2017生长季表现为抗病,1个材料(15HN018)在2016、2017,1个材料(NMAS020)在2015、2016生长季表现抗病,7个材料(15HN200、苏麦3号、15HN042、H35、N553、望水白、P48)连续三年均表现为抗病。感病品系09X15三年的发病小穗率均大于87%。 用SSR标记Xgwm493、Xgwm533、Xbarc147 检测45个小麦材料携带Fhb1的结果(表2)表明,有20个材料的三个分子标记检测结果均为阳性。在13个表型鉴定为抗病的小麦材料中,有9个材料(NMAS001、NMAS020、望水白、苏麦3号、P48、宁麦9号、网93、苏夫与N553)用三个标记均扩增出目的条带,有4个材料(15HN018、15HN200、15HN042与H35)扩增出一或两个标记的目的条带。在三个分子标记检测均为阴性的9个小麦材料(09M20、10M10、节燕2000、PIC447、11-267、L658、L699、09X15、Tybalt)中,2个(节燕2000和PIC447)表型鉴定在2015年表现中抗(图1,表2)。 45个小麦材料的农艺性状调查结果(表3)表明,表型鉴定为抗病的13个小麦材料的主要农艺性状大多表现不良,NMAS001、NMAS020、望水白、苏麦3号、P48、H35、N553 共7个材料的株高较高,均在1m以上; NMAS020、苏夫和N553 表2 45个小麦材料 Fhb1位点的分子检测Table 2 Detection of the major gene Fhb1 resistance to Fusarium head blight in the 45 wheat germplasm 1:阳性;0:阴性。 1:Positive; 0:Negitive. A:分子标记 Xgwm493;B:分子标记Xgwm533;C:分子标记Xbarc147;黑色箭头所指为目标条带;M:DNA分子量标记;1:阳性对照(苏麦3号);2:阴性对照(09X15);条带3~47依次对应编号YP 1~45的小麦品种(系)(表1)。 表3 赤霉病抗性较好的 13 个小麦材料的主要农艺性状Table 3 Main agronomic traits of 13 wheat germplasm resistance to Fusarium head blight TGW:Thousand grain weight; SD:Spikelet density. 3个材料的抗冻害能力不强;苏麦3号、P48、网93和15HN042共4个材料的抗倒伏性较弱;除小麦品系15HN042外,其他材料的小穗密度都较低。综合农艺性状和抗病性,以15HN018、15HN200和宁麦9号为较优选择。 本研究用微量移液器进行单花滴注接种鉴定的方法,连续三年对收集于7个单位的45个小麦材料进行了赤霉病抗性的表型鉴定,共筛选出来13个抗病材料(NMAS001、宁麦9号、网93、苏夫、15HN018、NMAS020六个材料在两年表现抗病,15HN200、苏麦3号、15HN042、H35、N553、望水白、P48七个材料连续三年表现抗病)。用抗赤霉病主效QTLFhb1连锁的三个SSR标记 Xgwm493、Xgwm533、Xbarc147检测,13个抗病的小麦材料中,有9个材料用三个标记均扩增出与目标条带,有4个材料扩增出一或两个标记的目标条带。在三个分子标记检测均为阴性的小麦材料中,2个材料(节燕2000和PIC447)在2015年表现中抗。即用三个分子标记检测为阳性的材料不一定表现抗病,部分表现抗病的材料用本研究所用的三个分子标记检测不到Fhb1基因。导致分子检测与表型鉴定结果不完全一致的主要原因可能为:① 不同小麦材料遗传背景不同,抗病基因与其他基因互作导致其效应改变,携带有某个抗病基因的材料表型不一定表现为抗病[18-19]; ② 小麦赤霉病抗性表现为数量性状遗传,不同小麦品系所含的抗病基因不同[20]。推测本研究中表现抗病而没有检测Fhb1基因的材料可能含有Fhb1以外的抗病基因。 前人研究表明,赤霉病抗性往往与株高等不良的农艺性状连锁。有学者认为,小麦赤霉病抗性与株高呈正相关[21]。 另有学者认为,小穗密度对植株抗赤霉病侵染能力有一定影响,小穗密度越高越易感病[22]。这可能是因为植株较高、小穗密度较小的小麦穗部周围的小环境湿度偏低,抑制了病原菌的侵入[23-24]。Gervais 等[25]检测出 3 个赤霉病抗性主效 QTL 与植株高度 QTL 重叠,表明小麦株高与赤霉病的抗性具有一定的相关性。本研究结果与这些报道相似,如抗病的13个小麦材料,有 7 个株高在 1 m 以上,除材料 15HN042 外,其他抗病材料的小穗密度都较低。 结合农艺性状与表型鉴定的结果,本研究共筛选出三个抗病且农艺性状较好的小麦品(种)系(15HN018、15HN200和宁麦9号),可以作为小麦抗赤霉病育种的优质种质资源,宁麦9号经三个SSR标记检测均为阳性,可以优先考虑在小麦抗赤霉病育种中应用。其他表型抗病、分子检测为阴性的小麦品(种)系可以作为挖掘其他抗病QTL的种质资源。由于本研究所用的小麦材料较少、来源地偏窄,表性鉴定也仅在一个试验地点进行,为抗赤霉病育种提供的种质资源相对有限,因此,还需继续收集更多的材料、进行更多优异的鉴定以服务于小麦育种和生产。1.3 Fhb1基因的检测

1.4 农艺性状测定
2 结果与分析
2.1 供试材料的赤霉病抗性
2.2 Fhb1位点的分子检测
2.3 农艺性状表现

3 讨 论
