肿瘤内神经新生在口腔鳞状细胞癌 进展中的作用及机制
2019-05-14杨春雪汪园圆韩洪秀
杨春雪, 张 圆, 汪园圆, 韩洪秀
(上海交通大学医学院附属第九人民医院病理科,上海 200011)
近年来,越来越多的研究表明在多种肿瘤组织中存在神经新生,例如前列腺癌[1-2]、结肠癌[3]、乳腺癌[4]和胰腺癌[5-6]等,然而口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)组织中的神经新生与疾病进展的关联少见报道。因此本研究首先在人OSCC标本中检测泛神经标记物蛋白基因产物(protein gene product, PGP)9.5表达特点以揭示OSCC神经新生与疾病进展的相关性。
侵袭和转移是恶性肿瘤的本质特征,支配肿瘤组织的神经末梢释放的神经递质对肿瘤细胞的迁移、侵袭及远处转移有一定影响[7]。降钙素基因相关肽(calcitonin gene related peptide, CGRP)是一种含有37个氨基酸残基的神经递质,广泛存在于中枢神经系统及包括头颈部在内的外周神经末梢[8-9]。Nagakawa等[10]通过离体实验发现CGRP能增强前列腺癌细胞的侵袭能力,也有研究[11]认为内源性CGRP可能促进肿瘤生长和血管新生。丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK),主要包括ERK、p38和JNK等3种,可被神经递质或细胞因子激活发生磷酸化,参与调控恶性肿瘤细胞诸如人肺腺癌细胞[12]、骨肉瘤细胞[13]、结肠癌细胞[14]等的增殖、迁移和侵袭。目前并未在人OSCC中检测出CGRP的表达,这可能是抗体的有限性导致的。为了揭示OSCC组织中新生神经释放的神经递质在疾病进展中的可能作用机制,本研究利用培养舌SCC细胞株初步探讨CGRP对OSCC细胞迁移和侵袭的影响及其机制。
1 材料与方法
1.1 材料
1.1.1 收集上海交通大学医学院附属第九人民医院人OSCC石蜡包埋组织样本,排除放疗、化疗或其他外科手术外治疗的患者,共167例,常规进行切片、HE染色。根据头颈部肿瘤WHO分类,对样本肿瘤进行组织学分级。患者年龄23~81岁,平均(59±27.5)岁,102例(61.0%)患者无病存活期在3年以上。回顾总结患者临床病理学指标,包括肿瘤大小、有无血管浸润、神经浸润及淋巴结转移等。
1.1.2 细胞系 人舌SCC细胞株TSCCA购自上海中乔新舟生物科技有限公司。
1.1.3 实验用药 CGRP购自美国Sigma公司。ERK抑制剂PD98059、p38抑制剂SB203580和JNK抑制剂SP600125购自英国Tocris公司。
1.1.4 实验试剂 MEM培养基、0.25%胰酶、胎牛血清购自美国Gibco公司;BCA蛋白浓度测定试剂盒、Transwell小室购自美国Millipore公司;Matrigel基质胶购自美国BD公司;兔单克隆抗体p-ERK、兔单克隆抗体p-p38、兔单克隆抗体p-JNK购自美国Cell Signaling Technology公司;辣根酶标记山羊抗兔IgG抗体购自美国Bio-Rad公司。
1.1.5 主要仪器 CO2培养箱、超净工作台购自美国Thermo公司;全自动酶标光度仪购自美国Biotek公司;多功能成像仪购自美国GE公司。
1.2 实验方法
1.2.1 免疫组织化学方法 存档肿瘤组织蜡块,切白片,切片置于60℃烘箱烤片2h后,二甲苯脱蜡,梯度乙醇水化。组织切片于3% H2O2中室温孵育10min,双蒸水冲洗后放入预热(100℃)的EDTA抗原修复液中孵育10min。自然冷却至室温,于兔抗人PGP9.5多克隆抗体(1∶500)4℃孵育过夜,于EnVision通用型抗兔/鼠二抗室温孵育1h,DAB显色,苏木精复染、水洗,脱水后树胶封片。空白对照用PBS代替一抗。
1.2.2 免疫组化结果判读 用Optimas 6 Image Analyse Suite评估神经束的直径,大多数(96.1%)神经束直径<100μm。通过在200倍高倍镜视野下连续20个视野计数直径<100μm的神经纤维束来分析PGP9.5的表达强弱。将PGP9.5表达程度分为3类。(1) 阴性: 既无神经束也无散在的神经纤维;(2) 弱阳性: 1~10个神经束;(3) 中/强阳性: >10个神经束。
1.2.3 细胞培养 用含10%胎牛血清的MEM培养基在37℃、5% CO2细胞培养箱中常规传代培养TSCCA细胞,取对数生长期的细胞进行实验。
1.2.4 Transwell小室细胞迁移和侵袭实验 迁移实验: 取对数生长的细胞,调整细胞密度为3×105/mL,接种200μL细胞悬液于孔径为8μm的聚碳酸酯的Transwell小室上室,下室加入含10%胎牛血清的培养基500μL,于37℃细胞培养箱培养24h,然后用4%多聚甲醛固定10min,结晶紫染色20min,PBS洗3次,棉棒擦除小室上层的细胞,于倒置显微镜下观察,随机选取5个视野,拍照并计数迁移到小室下的细胞数,取平均值,实验重复3次。侵袭实验: 在Transwell小室上铺60μL的Matrigel胶(1∶8稀释),待胶凝固后,调整细胞密度为1.5×106/mL,接种到小室上室,余步骤同迁移实验。为了检测CGRP对细胞迁移和侵袭的影响,100nmol/L CGRP(溶于0.1% DMSO)加入小室下室,对照组(control)为加入等体积的0.1% DMSO;为了检测ERK/p38/JNK抑制剂对CGRP效应的影响,分别在小室上室加入PD98059、SB203580和SP600125(10mol/L,溶于1% DMSO),对照组(control)加入等体积的1% DMSO。
1.2.5 免疫印迹检测 提取总蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),冰浴下130mA转膜100min,于5%脱脂牛奶室温封闭1h,于兔抗p-ERK(1∶500)、兔抗p-p38(1∶500)或兔抗p-JNK(1∶500)4℃摇床孵育过夜;第2天转入HRP标记的羊抗兔二抗(1∶3000)室温孵育1h,化学发光(ECL)显影,利用多功能成像仪扫描目的条带和对照条带,然后用Image J软件测算条带的密度,计算相对变化值(目的条带与对照条带之比)。
1.3 统计学处理

2 结 果
2.1 人OSCC组织中的神经新生
免疫组织化学结果显示,88.0%(147/167)的人OSCC组织中可见PGP9.5表达,神经束片段或纤细的神经纤维大多分布于肿瘤间质,也可见细小的神经纤维包绕于癌细胞周围,癌旁正常黏膜上皮下组织中均可见神经束分布(图1)。82.6%(138/167)的癌旁正常黏膜上皮下组织中PGP9.5的表达为弱阳性,而49.7%(83/167)的人OSCC组织中PGP9.5的表达为中/强阳性(P<0.0001)。不同解剖部位的OSCC组织中PGP9.5的阳性表达情况如下: 舌SCC 89.2%(66/74),颊SCC 83.3%(20/24),唇SCC 83.3%(5/6),口底SCC 95.0%(19/20),咽和喉SCC 92.3%(12/13),牙龈SCC 89.5%(17/19),颌SCC 72.7%(8/11)。不同部位的OSCC的PGP9.5的阳性表达情况差异无统计学意义(表1)。
2.2 人OSCC组织中的神经新生与临床病理学特征之间的关系
在OSCC 1级组织中PGP9.5的中/强阳性表达率为21.7%(15/69),而在2、3级组织中PGP9.5中/强阳性表达率明显提高为69.4%(68/98),差异有统计学意义(P=0.008)。在无神经浸润的组织中PGP9.5中/强阳性表达率为45.5%(61/134),而在有神经浸润的组织中表达率增高为66.7%(22/33)(P=0.034)。无病生存期<3年的患者的PGP9.5中/强阳性表达率(61.6%,40/65)高于无病生存期≥3年的患者(42.2%,43/102)(P=0.017)。PGP9.5的中/强阳性表达与肿瘤分级、神经浸润和患者短生存期正相关(r=0.425、0.166、0.186,均P<0.05)。然而,PGP9.5的中/强阳性表达与肿瘤大小、淋巴结转移、血管浸润无关(均P>0.05),见表2。

图1 人口腔鳞状细胞癌及周围正常组织中 PGP 9.5的表达Fig.1 The expression of PGP9.5 in human OSCC and adjacent normal tissuesA: 人口腔鳞状细胞癌的H-E染色;B: 肿瘤周围正常组织内的PGP9.5表达;C、D: 肿瘤组织内PGP9.5的表达;标尺: A: 100μm;B~D: 50μm
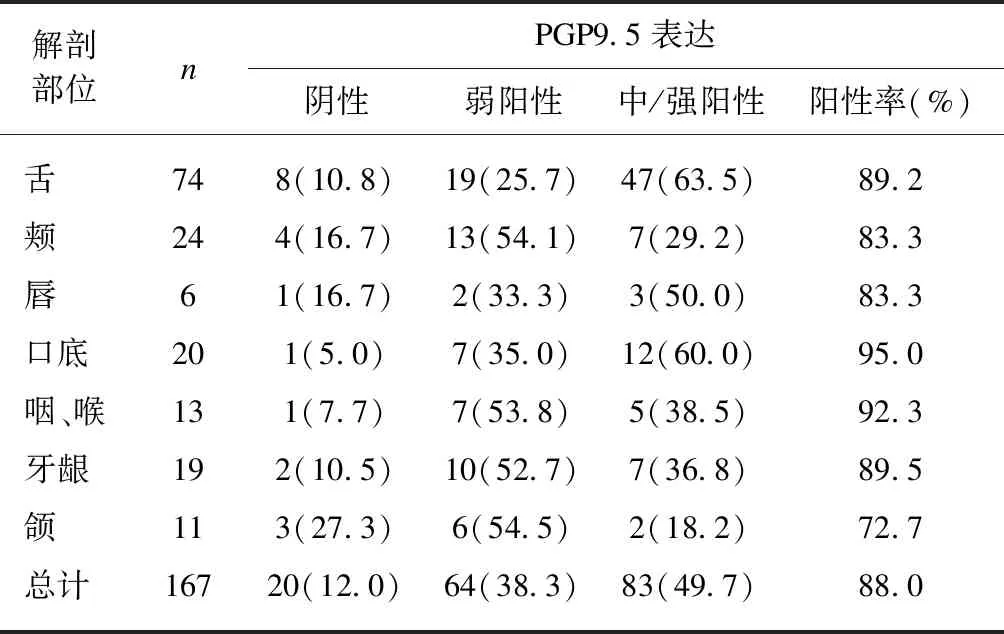
2.3 CGRP促进TSCCA细胞迁移和侵袭
CGRP是一种广泛分布于中枢和外周的神经递质。预实验发现CGRP浓度依赖性(1、10、100nmol/L)促进TSCCA细胞的迁移和侵袭,100nmol/L CGRP的效应最显著,因此后续实验采用100nmol/L CGRP刺激细胞。相比对照组,CGRP处理组的细胞迁移到小室下的数目明显增多(CGRP: 165.4±14.2,对照: 110.2±5.3),差异具有统计学意义(P=0.008)。同样,利用侵袭实验,发现经CGRP处理的细胞侵袭到小室下的数目明显增多(CGRP: 68.3±23.5,对照: 12.8±2.8),差异具有统计学意义(P=0.002),见图2。

表2 PGP9.5的表达与人口腔鳞状细胞癌组织 临床病理学特征之间的关系
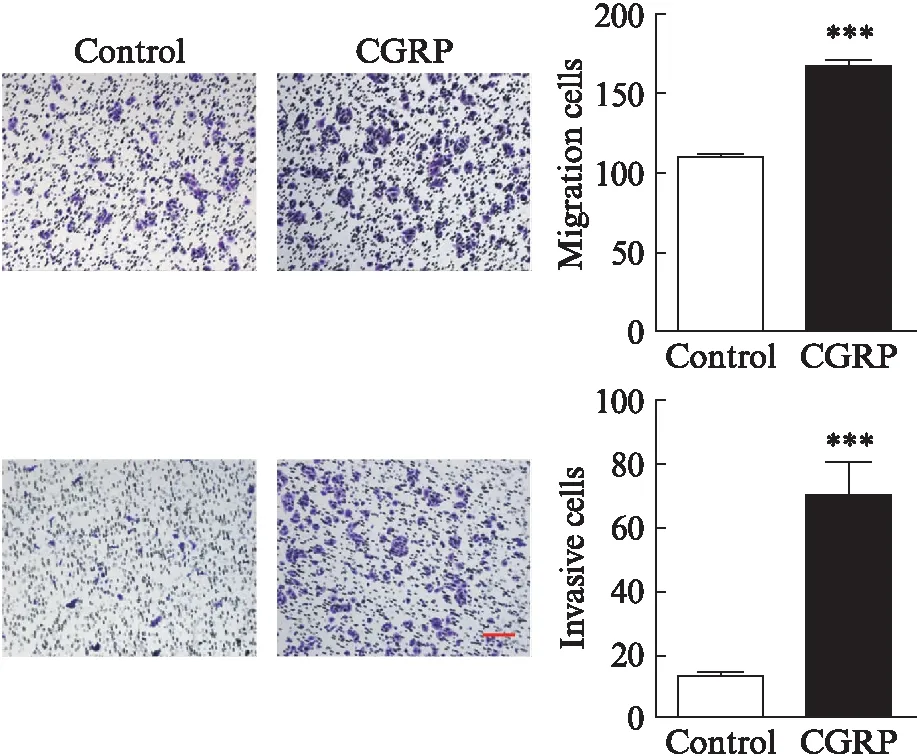
图2 100nmol/L CGRP促进TSCCA细胞的迁移和侵袭Fig.2 The migration and invasion of TSCCA cells were promoted by 100 nmol/L CGRP标尺: 100μm;与对照组相比,***P<0.001
2.4 CGRP对ERK、p38和JNK磷酸化表达的影响
CGRP处理TSCCA细胞1h后,其p-ERK的表达水平与对照组相比明显升高(P=0.007),但CGRP处理6、24h后,其p-ERK的表达与对照组差异无统计学意义(图3A)。CGRP处理6h后细胞p-p38的表达水平高于对照组(P=0.043),但CGRP处理1、24h后,其p-p38的表达水平与对照组差异无统计学意义(图3B)。CGRP处理24h后细胞p-JNK的表达高于对照组(P=0.035),但CGRP处理1、6h后,p-JNK的表达水平与对照组差异无统计学意义(图3C)。
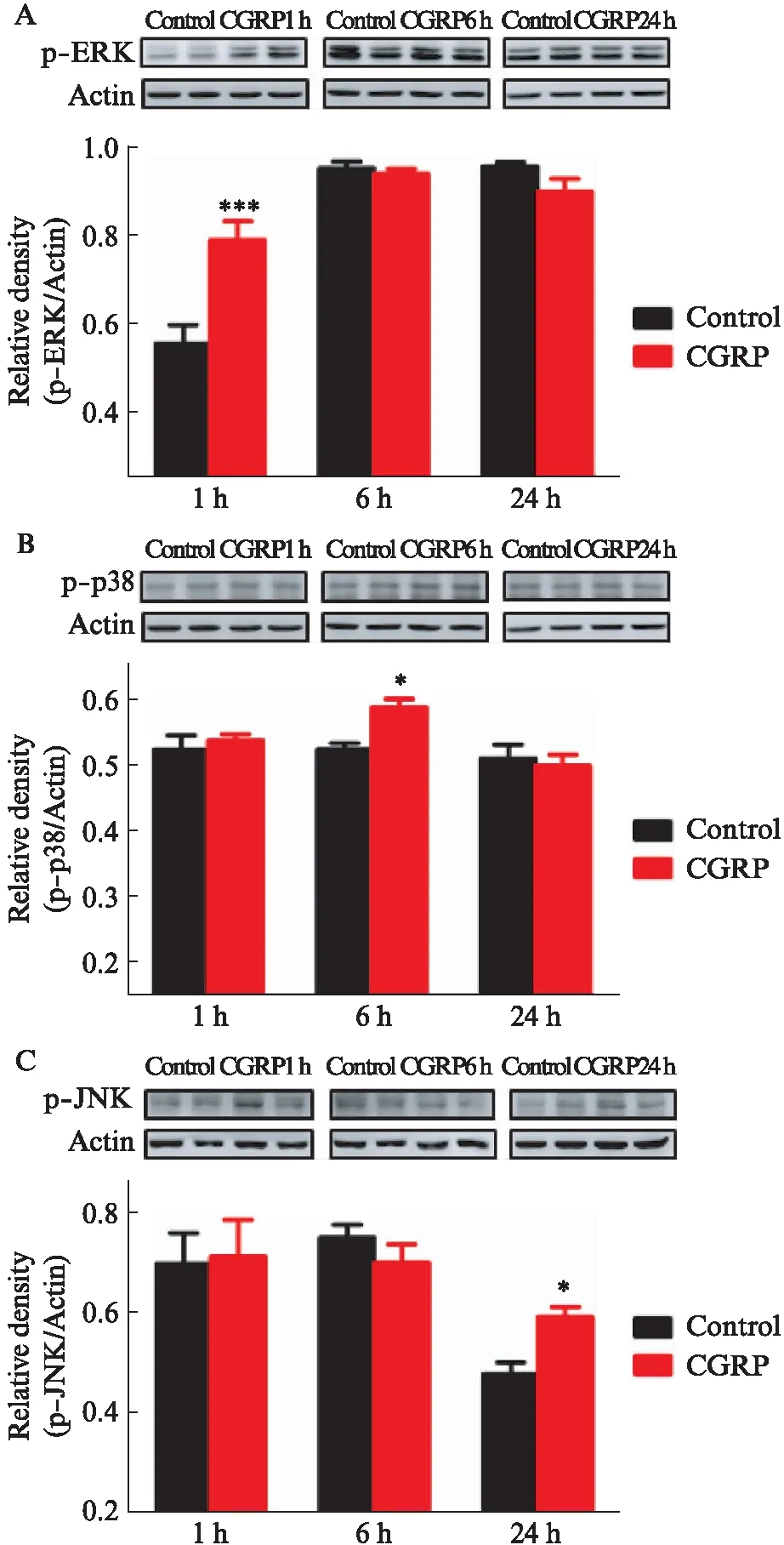
图3 100nmol/L CGRP刺激TSCCA细胞1、6和24h后 p-ERK (A)、p-p38 (B)和p-JNK (C)蛋白水平的表达Fig.3 The expression of p-ERK (A), p-p38 (B) and p-JNK (C) in TSCCA cells at 1, 6 and 24 h after stimulation by 100 nmol/L CGRP与对照组相比,*P<0.05,***P<0.001
2.5 ERK、p38和JNK抑制剂对CGRP促进TSCCA细胞迁移和侵袭的影响
1μmol/L的ERK抑制剂PD98059、p38抑制剂SB203580和JNK抑制剂SP600125均不影响CGRP的效应。而10μmol/L的SP600125明显减弱CGRP引起的TSCCA细胞的迁移(SP600125: 94.5±15.5,对照: 142.5±20.8,P=0.028)和侵袭(SP600125: 52.5±16.5,对照: 118.4±38.1,P=0.029),10μmol/L的PD98059和SB203580对CGRP引起的TSCCA细胞迁移和侵袭没有影响(图4)。
图4 10mol/L SP600125减弱CGRP引起 TSCCA的迁移和侵袭Fig.4 CGRP-stimulated migration and invasion of TSCCA cells were attenuated by 10 mol/L SP600125标尺: 100μm;与对照组相比,*P<0.05
3 讨 论
本研究发现88.0%(147/167)的人OSCC组织中可能存在新生神经,神经束片段或纤细的神经纤维大多分布于肿瘤间质中,也可见细小的神经纤维包绕于癌细胞。这与之前研究中前列腺癌、结肠癌、乳腺癌、胰腺癌等组织出现神经新生相一致[1-6]。另外,本研究发现OSCC比癌旁正常黏膜上皮下组织中神经纤维数目增多。
Magnon等[15]认为在小鼠前列腺癌组织中出现的交感神经和副交感神经是前列腺癌发生发展中所必需的。最近,Zhao等[16]利用小鼠胃癌模型证明去神经支配能抑制胃癌发生。这些证据提示肿瘤组织中的神经新生可能在疾病进展中起重要作用。本研究发现OSCC组织中PGP9.5的中/强阳性表达与神经浸润相关,提示OSCC中的神经新生可能在癌细胞侵袭过程中起一定作用,这与Entschladen等[17]的观点一致: 癌症相关的神经新生很可能促进了癌细胞神经浸润的发生,从而成为癌组织中神经上皮相互作用的第二步。此外,本研究显示OSCC的神经新生与肿瘤的组织学分级和患者的无病生存期呈正相关;这表明新生神经可能是促进人OSCC的进展因素之一。然而,本研究并没有发现神经新生与OSCC肿瘤大小、血管浸润和淋巴结转移有关。癌细胞的转移机制非常复杂,与癌组织增大、癌细胞迁移和侵袭能力及其与转移部位微环境之间的相互作用密切相关,参与调控的分子复杂多样[18-19]。推测支配OSCC的神经末梢释放的神经递质促进癌细胞向不同部位(血管、淋巴、神经)转移与其和转移部位微环境之间的相互作用不同有关,这尚进一步研究验证。
越来越多研究证明神经递质在肿瘤的微环境中发挥重要作用,加速了肿瘤的进展。例如,神经递质参与肿瘤的免疫抑制[20],肿瘤的血管化和血管密度的改变受神经递质的影响[21-22]。因此,本研究利用舌SCC细胞株间接从细胞水平探讨CGRP对OSCC细胞迁移和侵袭能力的影响,结果发现CGRP能促进TSCCA细胞的迁移和侵袭能力,从细胞水平直接证明神经递质可能促进了OSCC细胞的和转移和浸润。这与Nagakawa等[10]报道CGRP能增强前列腺癌细胞的侵袭能力相一致。另外,本研究发现CGRP可使TSCCA细胞内丝裂原活化蛋白激酶(MAPKs)的三条主要信号通路ERK、p38和JNK发生磷酸化。但由于刺激细胞时间不同,MAPKs信号通路分子的表达情况有所不同。CGRP作用1h后p-ERK的表达水平明显高于对照组;CGRP作用6h后p-p38的表达水平高于对照组;而CGRP作用24h后p-JNK的表达水平高于对照组。有研究表明苦参碱通过p38通路抑制宫颈癌细胞的增殖和迁移[23],与本研究不同;这可能是由于ERK、p38和JNK激活在细胞增生、迁移、侵袭和死亡中的作用不同,与细胞种类、刺激条件、刺激时间不同有关[24]。有研究表明,外源性CGRP改善缺血/再灌注诱导的大脑组织损伤是通过下调p-JNK/p38和上调p-ERK实现的[25]。本研究提示,CGRP均能引起p-ERK、p-p38和p-JNK上调,但具有不同的时间依赖性。为了明确是哪种MAPKs信号通路参与了CGRP引起的TSCCA细胞的迁移和侵袭,本研究给予MAPK信号通路相应信号元件抑制剂切断信号转导,发现JNK抑制剂SP600125减弱了CGRP引起的舌SCC细胞的迁移和侵袭能力,而ERK抑制剂PD98059和P38抑制剂SB203580对CGRP引起舌SCC细胞的迁移和浸润能力无影响。因此,认为JNK信号分子的活化可能介导了CGRP对OSCC细胞迁移和侵袭的促进作用。
综上,OSCC组织中确实存在神经新生,而且其与OSCC的进展密切相关。体外细胞学实验提示神经递质促进OSCC细胞迁移和侵袭;这些研究结果表明神经新生可能在OSCC进展和转移的过程中发挥了重要的调控作用。
