一种新的黄瓜细菌性叶斑病拮抗细菌的筛选鉴定及其发酵条件的初步研究
2019-05-14穆晓雅谭志琼彭正强张荣意
穆晓雅,谭志琼,刘 铜,彭正强,张荣意*
(1.热带农林生物灾害绿色防控教育部重点实验室/海南大学热带农林学院,海南 海口 570228;2.中国热带农业科学院环境与植物保护研究所,海南 海口 571101)
【研究意义】黄瓜(CucumissativusL.)葫芦科黄瓜属一年蔓生草本植物,是我国重要的栽培蔬菜之一。黄瓜生长周期长,易受各种病害累积量大,黄瓜细菌性病害时常发生。【前人研究进展】国内已报道由胡萝卜软腐果胶杆菌巴西亚种(Pectobacteriumcarotovorumsub sp.brasiliense)引起的黄瓜细菌性软腐病[1]、丁香假单胞菌流泪致病变种(Pseudomonassyringaepv.lachrymans)引起的黄瓜细菌性角斑病[2]、野油菜黄单胞菌黄瓜致病变种(Xanthomonascampestrispv.cucurbitae)引起的黄瓜细菌性叶斑病[3]。由于黄瓜细菌性病害传播速度快,如果病害发生会造成严重的损失。黄瓜作为中国南繁瓜菜科研育种的主要作物之一,各种黄瓜种植及育种在海南南繁区汇聚,而各种细菌性病害可以随着种子传播,使得南繁区域极易成为黄瓜细菌性病害的传播和扩散的源头,对南繁瓜菜科研育种的健康发展构成了潜在的威胁,甚至影响到全国黄瓜用种安全。【本研究切入点】本研究团队在海南南繁区调查黄瓜病害时,发现了一种新的细菌性病害,一些品种发病率达90 %。论文“First Report of Bacterial Leaf Spot of Cucumber Caused byP.cichoriiin China” Plant Disease 已在线发表。目前化学药剂防治是黄瓜细菌性病害的主要防治办法,由于化学药剂使用次数多,用药量大,不仅使病原菌产生耐药性,而且容易造成环境污染,对人类的健康以及其他生物生长均形成了一种潜在的威胁[4]。生物防治现成为人们研究的重点。许多生物制剂已经在防治中取得了显著效果。由于黄瓜新的细菌性病害生防研究在国内外还未见报道,由此本文开展了对黄瓜新的病原菌菊苣假单胞的拮抗菌筛选鉴定的研究。【拟解决的关键问题】通过抑菌圈试验筛选出对黄瓜叶斑病具有拮抗作用的菌株,通过形态学、生理生化测定、16S rDNA以及gyrA基因序列分析及构建系统发育树对该拮抗细菌进行鉴定,最后对此拮抗细菌的发酵条件进行初步研究,为黄瓜一种新的叶斑病病原菌的生防制剂研发提供菌种资源,为有效控制黄瓜叶斑病提供参考。
1 材料与方法
1.1 试验材料
供试土壤样品从海南、安徽、浙江等地采集。供试病原菌为海南大学植病生防课题组分离、鉴定的黄瓜叶斑病病原菌菊苣假单胞(P.cichorii)。生理生化试验对照菌株为海南大学植病生防课题组分离、鉴定的枯草芽孢杆菌(B.subtilis)。固体培养基为牛肉膏蛋白胨培养基[5](NA培养基),液体培养基为不加琼脂的NA。
1.2 试验方法
1.2.1 拮抗菌的分离与纯化 采用《微生物学实验》[6]中的操作方法分离、纯化拮抗细菌。
1.2.2 拮抗菌抑菌效果测定 采用抑菌圈法[7]筛选具有拮抗作用的细菌:将培养24 h的黄瓜叶斑病病原菌菌液倒入熔融状态下的NA培养基中(温度55 ℃左右)。充分混均后倒平板,将之前分离出的的细菌接在上述带菌平板上,3次重复。28 ℃培养,观察是否有抑菌圈出现。
1.2.3 拮抗菌的鉴定 (1)菌株的形态以及生理生化性状测定。根据《常见细菌系统鉴定手册》[8],对拮抗细菌的生理生化性状进行测定,为保证试验方法的准确性,对照菌株也一起进行测定。
(2)菌株16S rDNA序列测定以及系统发育树的构建。用细菌DNA提取试剂盒提取拮抗菌DNA,16S rDNA的PCR扩增采用细菌通用引物:(27f:5′-AGAGTTTGATCCTGGCTCAG-3′;1492r:5′-GGTTACCTTGTTACGACTT-3′)[9]进行PCR扩增。PCR反应体系:2×PCR-Mixture 12.5 μl,引物各0.5 μl,总DNA 1 μl,dd H2O 10.5 μl,总体积25 μl。PCR的反应条件:预变性,94 ℃ 5 min;变性,94 ℃ 1 min;退火,50 ℃ 1 min;延伸,72 ℃ 1.5 min;30个循环后终止延伸72 ℃ 10 min;4 ℃保存。PCR产物送华大基因公司测序。系统发育树的构建:将测序结果在NCBI中进行BLAST比对,并通过MEGA6.0软件进行系统发育树的构建。系统发育树构建方法采用Neighbor-join,自展数(Bootstrap)[10]为1000。
(3)菌株gyrA基因序列测定以及系统发育树的构建。根据文献[11]选择高变异性蛋白酶促旋酶gyrA基因序列进行分析及构建系统发育树。gyrA基因引物:(L100:5′-AAATCTGCCCGTATCGTCG-3′;R836:5′-GCGTCACGGCGRATCTCAA-3′)[12]。PCR反应体系同上。PCR的反应条件:预变性,94 ℃ 3 min;变性,94 ℃ 40 s;退火,61.7 ℃ 40 s;延伸,72 ℃ 25 s;30个循环后终止延伸72 ℃ 10 min;4 ℃保存。将PCR产物送到生工生物工程有限公司测序,将测序后的结果在NCBI中进行BLAST比对,并通过MEGA6.0软件进行系统发育树的构建。
1.2.4 拮抗菌发酵条件的研究 ①最适pH的测定。采用稀释平板计数法[7]测定拮抗细菌的最适pH:配制pH分别为4、5、6、7、8、9、10、11的NA培养基,将拮抗菌稀释液涂布在不同pH的平板上。28 ℃培养,观察平板上菌落数并记录。②最适碳、氮源的测定。根据《常见细菌系统鉴定手册》[8]配制碳源、氮源基础培养基,将拮抗菌接入上述培养液基,在28 ℃转速为150 r/min的摇床中摇至48 h,采用紫外吸收比浊法[13](600 nm)测定吸光度,以不接菌的培养液为对照。③最适温度的测定。将拮抗菌株接在NA培养液中,放在转速为150 r/min温度分别为20、25、30、35、40和45 ℃的摇床中,48 h后测定其吸光度,以不接菌的培养液为对照。④最适转速的测定。将拮抗菌株接在NA培养液中,放在温度为28 ℃转速分别为90、120、150、180和220 r/min的摇床中,48 h后测定其吸光度,以不接菌的培养液为对照。
2 结果与分析
2.1 拮抗细菌的分离与筛选
从采集的土壤中分离到650株细菌,以1种新的黄瓜叶斑病病原菌菊苣假单胞菌为目标菌株,通过抑菌圈法筛选得到10株具有拮抗作用的细菌,将其中具有较好拮抗效果的菌株编号为菌株JNL。
2.2 拮抗细菌的抑菌效果以及形态特征
从图1可以看出,菌株JNL对黄瓜叶斑病病原菌菊苣假单胞具有拮抗作用。JNL菌落圆形,边缘不整齐,半透明,质软,易挑起。3 d后,菌落表面出现褶皱,质地硬,不透明,乳白色,不易挑起。
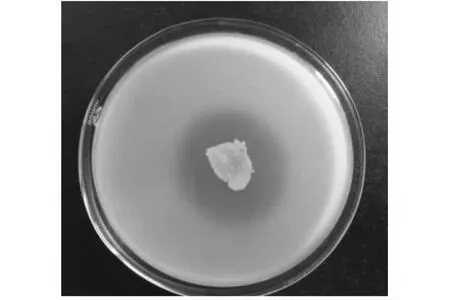
图1 菌株JNL抑菌效果Fig.1 Bacterial effect of strain JNL
2.3 菌株生理生化特性
根据菌株形态特征以及表1的生理生化特性测定结果,对照《常见细菌系统鉴定手册》,可以初步确定菌株JNL为解淀粉芽孢杆菌(B.amyloliquefaciens)。
16S rDNA及gyrA基因同源性分析。拮抗细菌的16S rDNA基因片段大小为1453 bp。在NCBI中进行BLAST比对,构建系统发育树(图2),发现其与解淀粉芽孢杆菌在同一分支。将数据上传至NCBI中,得到该菌株登录号为MH588397。菌株JNLgyrA基因片段大小为713 bp,将数据上传至NCBI中,得到登录号为MH982189。用NCBI软件比对、构建系统发育树后,图3显示其与解淀粉芽孢杆菌在同一分支。综合考虑菌株JNL的形态特征、生理生化特性、16S rDNA以及gyrA基因的比对结果。菌株JNL鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens)。
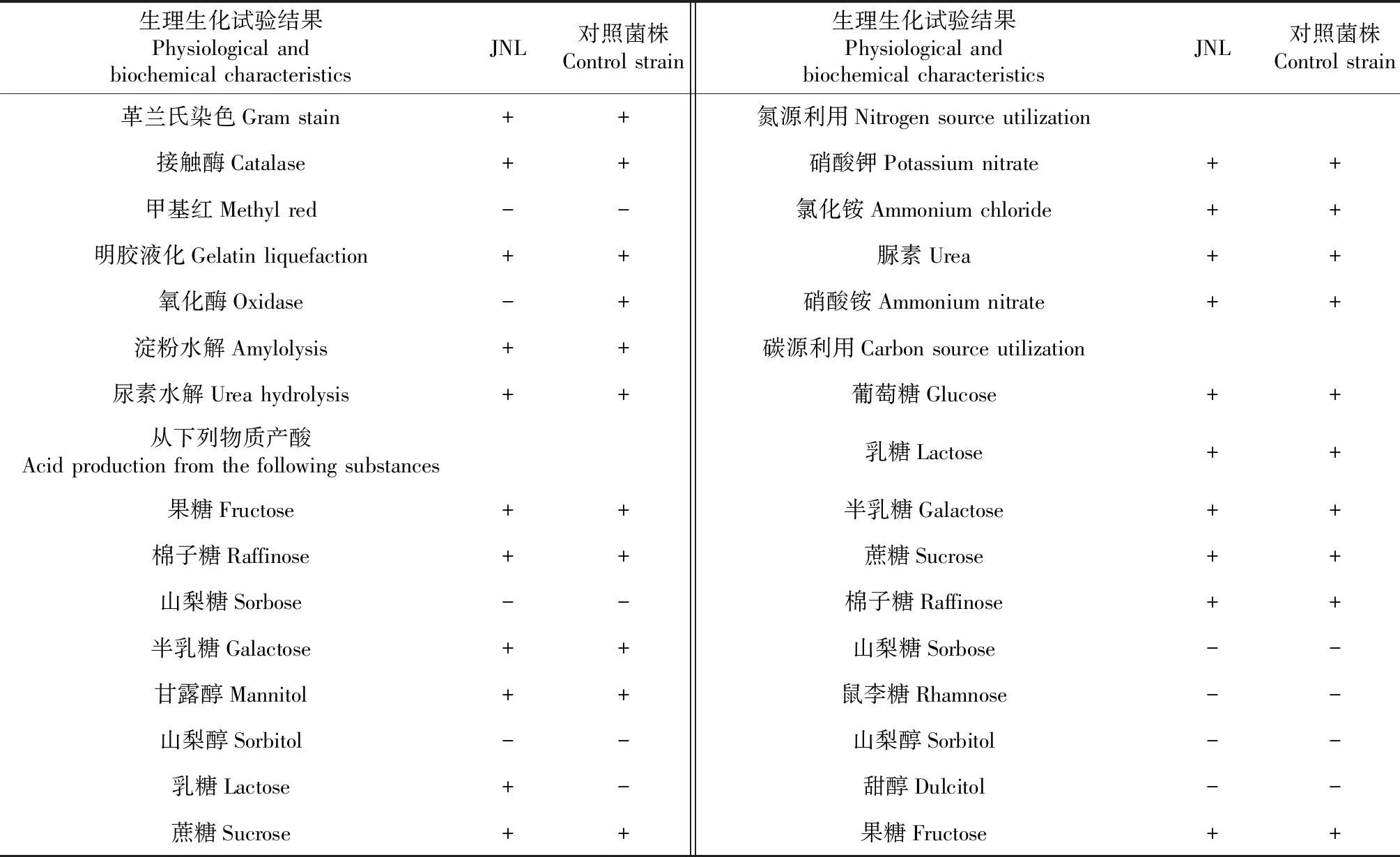
表1 菌株JNL生理生化特性
注:表中“+”表示阳性,“-”表示阴性。
Note: ‘+’ indicates positive in the table and ‘-’ indicates negative.

图2 菌株JNL基于16S rDNA基因构建的系统发育树Fig.2 Phylogenetic analysis of the strain JNL based on 16S rDNA sequence

图3 菌株JNL基于gyrA基因构建的系统发育树Fig.3 Phylogenetic analysis of the strain JNL based on genegyrAnucleotide sequences
2.4 拮抗菌发酵条件的分析
2.4.1 最适pH测定 由图4可见,菌株JNL对酸碱环境有较强的适应能力,在pH 4.0~11.0的范围内均可生长,在pH 5.0~9.0范围内生长情况最好,最适pH为7.0。

图中小写字母不同表示差异显著(P≤0.05),下同The difference in lowercase letters in the figure indicates significant difference (P≤0.05),the same as below图4 菌株JNL在不同pH下的生长情况Fig.4 Growth of strain JNL at different pH
2.4.2 最适碳源、氮源测定 由图5~6可见,菌株JNL在碳源为葡糖糖、棉子糖、蔗糖、乳糖、半乳糖、果糖时,在氮源为脲、氯化铵、硝酸铵、硝酸钾时均可生长,其中当氮源是氯化铵、硝酸铵时,不存在差异显著性。其最适碳源为半乳糖,氮源为硝酸钾。

图5 菌株JNL在不同碳源下的生长情况Fig.5 Growth of strain JNL under different carbon sources
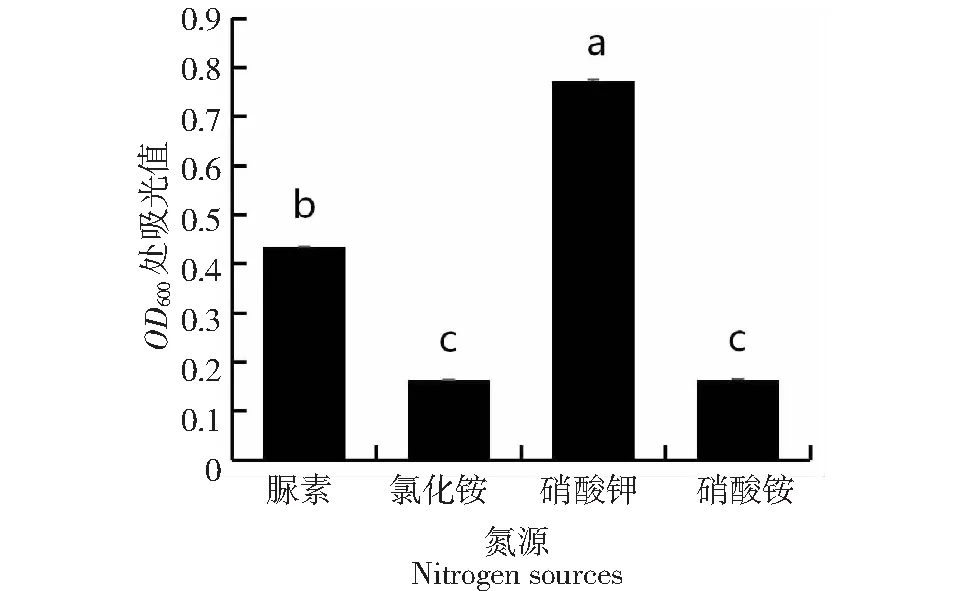
图6 菌株JNL在不同氮源下的生长情况Fig.6 Growth of strain JNL under different nitrogen sources
2.4.3 最适温度的测定 由图7可见,菌株JNL最适生长温度为30 ℃,在温度下降或上升时,其生长效果均减弱。且不同温度之间存在显著性差异。
2.4.4 最适转速的测定 由图8可见,菌株JNL在转速上升或者下降时,其生长效果均有所下降。其最佳转速为150 r/min。且不同摇床转速之间存在显著性差异。
3 讨 论
解淀粉芽孢杆菌属于芽孢杆菌属,在形态学上很难对芽孢杆菌进行分类,因此属种主要根据生理生化特性和16S rDNA序列分析进行鉴定,但是由于枯草芽孢杆菌近缘种群分类变化速度快,如枯草芽孢杆菌(B.subtilis)、解淀粉芽孢杆菌(B.amyloliquefaciens)、短小芽孢杆菌(B.pumilus)及暹罗芽孢杆菌(B.siamensis)等。对该群菌株准确鉴定的难度越来越大,因此只有把传统的方法与先进的分子生物学方法相结合,才能对该群菌株进行准确的鉴定[11]。本研究采用形态学观察、生理生化特性测定与16S rDNA以及gyrA基因序列分析相结合的方法对枯草群进行了有效区分,最终将菌株JNL鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens)。
芽孢杆菌内生芽孢,对不利环境适应力强,繁殖速度快,自然界中分布广泛,并且是一类非致病细菌。解淀粉芽孢杆菌不仅可以通过分泌次生代谢产物(抑菌蛋白类、脂肽类抗生素、大环内酯类、寡肽酶、肽类和聚酮化合物等)来抑制病原菌的生长,还可通过诱导提高植株自身的抗病能力。解淀粉芽孢杆菌对植物病原细菌有显著的防治效果,可以作为生物农药来适当替代化学农药使用[14]。
4 结 论
试验从海南、安徽、浙江等地的土壤中分离出一株对新的黄瓜细菌性叶斑病的病原菌菊苣假单胞具有拮抗作用的菌株。通过形态学观察、生理生化性状测定、16S rDNA同源性序列分析以及gyrA基因序列分析,确定菌株JNL为解淀粉芽孢杆菌(B.amyloliquefaciens)。通过单因子变量法测定菌株JNL在pH为7、温度为30 ℃、碳源为半乳糖、氮源为硝酸钾、转速为150 r/min的条件下生长效果最好。
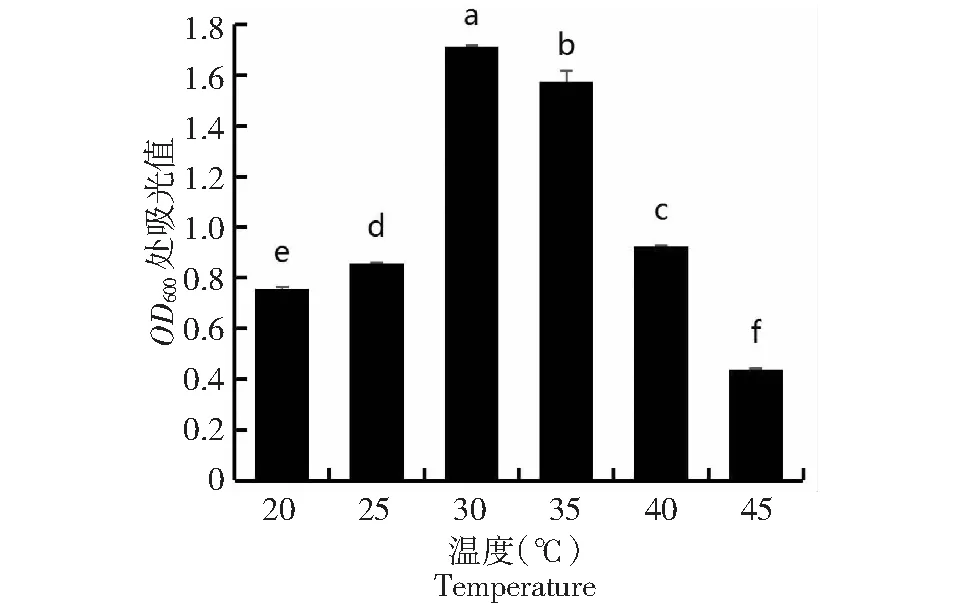
图7 菌株JNL在不同温度下的生长情况Fig.7 Growth of strain JNL at different temperatures
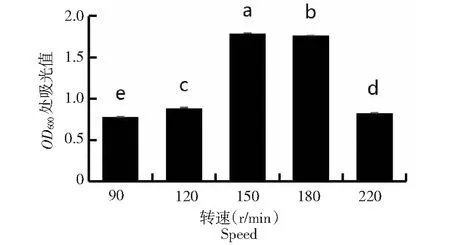
图8 拮抗菌JNL在不同转速下的生长情况Fig.8 Growth of antagonistic antibacterial JNL at different speeds
拮抗菌JNL对一种新的黄瓜细菌性叶斑病的病原菌菊苣假单胞具有拮抗作用。为微生物农药开发奠定了菌源基础,对减少黄瓜细菌性叶斑病病害,增加黄瓜产量具有一定的研究意义。
