不同林龄油茶人工林土壤酶化学计量及其影响因素
2019-05-13莫小勤罗艳华刘兴元胡亚军陈香碧苏以荣
乔 航,莫小勤,罗艳华,刘兴元,胡亚军,陈香碧,苏以荣,*
1 中国科学院亚热带农业生态研究所,农业生态系统过程重点实验室,长沙 410125 2 邵阳县林业局,邵阳 422100
土壤酶是一类主要源自土壤微生物且具有生物催化活性的物质,是微生物参与土壤生物化学地球循环的载体,也是土壤生态系统物质转化的核心动力[1]。碳(C)、氮(N)和磷(P)是土壤养分循环的核心要素[2],土壤C、N、P 转化酶对土壤中的C、N、P 元素转化和迁移具有重要作用。基于生态化学计量学原理,生态系统中任何生物组成物质都是由C、N、P和其他元素按照一定比例组成,并且不同营养层级生物在物质能量传递过程中存在特定的化学计量关系[3]。土壤微生物为满足生理上C、N、P 合理比率的需求,将分泌与之对应的胞外酶将土壤中有机态C、N、P 转化为可利用的小分子或者无机养分[4-5]。土壤微生物分泌碳转化酶主要包括β-葡糖苷酶(BG)、α-纤维素酶(CBH)和多酚氧化酶(PPO)等;氮转化酶主要包括β-乙酰葡糖胺糖苷酶(NAG)、亮氨酸氨基肽酶(LAP) 和脲酶(Urease)等;磷转化酶主要包括磷酸单酯酶(AP)和磷酸双酯酶(PD)等,这些微生物胞外酶的活性与微生物代谢、土壤养分含量密切相关,微生物胞外酶比值反应了微生物对养分的需求差别,Sinsabaugh 等也由此提出了土壤酶化学计量的概念[6-7]。目前的研究常将微生物酶的ln(CBH+BG)∶ln(NAG+LAP)、ln(BG+CBH)∶ln(AP)和ln(NAG+LAP)∶ln(AP)与土壤的C∶N、C∶P 和N∶P 相联系,用于评价微生物养分利用、微生物群落新陈代谢和养分需求,并在一定程度上指示土壤养分有效性[8]。在全球尺度上,Sinsabaugh 等发现总体上土壤C、N、P 酶化学计量比遵循1∶1∶1 的关系(ln(CBH+BG)∶ln(NAG+LAP)∶ln(AP)=1∶1∶1),揭示了土壤酶化学计量比对生物地球化学循环的重要影响[9]。
在特定的生态系统中,土壤微生物的生长受到环境胁迫和养分的限制,其酶的表达受到环境状况的调控,可能不遵循1∶1∶1 的关系。以往研究表明,非生物因子与生物因子均能影响土壤酶化学计量比[10]。例如:Sardans 等通过长期研究,发现增温会不同程度的增加灌丛生态系统土壤酶化学计量比ln(BG+CBH)∶ln(AP)和ln(NAG+LAP)∶ln(AP)的值[11-12]。土壤理化性质,如pH、全磷等也能够影响土壤酶化学计量比[13-14],例如:Xu 等对我国不同区域森林土壤研究表明,随着pH 增大,土壤酶化学计量比ln(BG+CBH)∶ln(AP)和土壤酶化学计量比ln(NAG+LAP)∶ln(AP)呈减小趋势[15]。Peng 等对我国温带草原研究发现全磷与土壤酶化学计量比ln(NAG+LAP)∶ln(AP)呈显著正相关[16]。此外,土壤酶还受地上植被等生物因子的影响[17]。植被可通过凋落物和根系分泌物对土壤酶化学计量产生影响[18]。例如:王冰冰等发现岷江干旱地区飞虹样地内灌丛地ln(BG)∶ln(NAG+LAP)显著高于空地[19]。在不同的生态系统中,影响土壤酶化学计量的因素可能完全不同,因此特定生态系统中土壤酶化学计量的控制因子仍值得我们研究。
油茶(CamelliaoleiferaAbel.),属山茶属(CamelliaL.)山茶科(Theaceae)植物,为常绿小乔木或灌木,是我国特有木本食用油料树种,是世界四大木本油料之一[20]。油茶主要生长在我国南方亚热带区丘陵地带,具有较强经济价值,也具有较强的生态功能。油茶人工林作为中国独有的经济林生态系统,目前已有的研究侧重于油茶栽培和育种等[21],如不同地块上肥料配比对油茶生长的影响[22],这些单个肥料试验由于立地条件、土壤肥力的差别,结果差异较大,缺乏对亚热带区油茶人工林养分需求的宏观理解。本文在区域尺度上,以中国亚热带油茶人工林为研究对象,测定土壤C、N、P 转化酶活性及土壤基本理化性质,从生态化学计量学的角度解析土壤微生物养分限制因子,旨在提高人们对油茶人工林的养分限制状况的理解,亦为油茶人工林可持续经营管理提供理论指导。有研究表明:林龄的变化显著改变土壤环境,如:柽柳人工林随林龄增加,土壤结构改善,有机质增加[23],这些生态系统组成结构、内部环境及土壤性质的改变,养分分配格局的变化,深刻的影响土壤酶活性及土壤酶化学计量比[24]。此外,油茶人工林由于果实采摘带走N、P 养分,这势必造成不同林龄土壤微生物可利用养分的差别,从而改变土壤微生物养分限制因子。因此本文探究林龄是否影响土壤酶活性与酶活性化学计量,为油茶人工林的土壤养分状况管理研究提供科学理论依据。
1 研究方法
1.1 样地选择和研究区概况
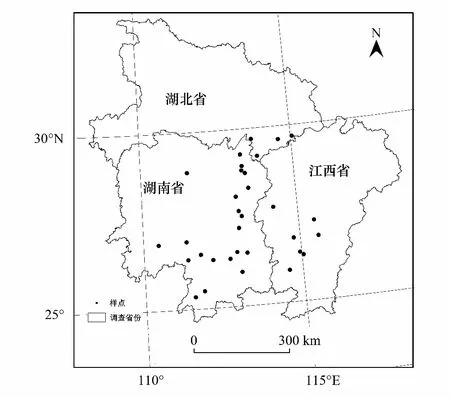
图1 样点信息图Fig.1 Soil sampling sites
试验研究区位于湖南、江西和湖北三省。该地区为中国油茶的主产区,油茶面积分别为1.4×106hm2[25]、8.9×105hm2[26]和2.5×105hm2[27],属典型亚热带季风气候区,夏季高温多雨,冬季温和少雨,年平均气温17 ℃,极端最高温39 ℃,极端最低温度-10 ℃,年平均降水量约1600 mm。本试验采用随机取样法在该区域内共选择32 个样地(图1),其中湖南省21 个,江西省7 个,湖北省4 个。样地土壤类型主要以红壤为主,土壤质地以壤质黏土为主(表1)。根据油茶人工林的林龄分为四个林龄组,其中< 9 年(a)油茶幼龄林9 个,9—20 年(a)油茶近熟林10 个,21—60 年(a)油茶成熟林6 个,> 60 年(a)油茶过熟林7 个。
1.2 研究方法
1.2.1样品采集与处理
土壤样品于2017 年12 月至2018 年1 月在选择的32 个典型油茶人工林样地中采集,每个油茶人工林样地中设置3 个10 × 10 m 的样方。在每个样方内选择生长状况相近的三棵油茶树,在每棵油茶树的滴水线内距基部20—30 cm 之间随机取4 个点,取0—15 cm 表层土壤,每个样方内三棵油茶树土壤混合成一个土壤样品。每个样地内采集三个土壤样品作为重复,32 个试验样地共采集96 个土壤样品。土壤样品带回实验室后挑拣出可见根系及石子,过2 mm 筛,充分混合并分为两份子样。一份子样自然风干用于测定土壤基本理化性质,一份子样用于测定土壤C、N、P 酶活性。在测定土壤酶活性之前,土壤进行培养。取300 g 土壤调整至田间持水量的40 %,在25 ℃条件下黑暗静置培养15 d,测定土壤酶活性。
1.2.2土壤酶活性测定
参照Saiya-Cork 等[28]的荧光光度法测定土壤酶活性。本研究测定了五种酶活性,分别为β-葡糖苷酶(BG)、α-纤维素酶(CBH)、β-乙酰葡糖胺糖苷酶(NAG)、亮氨酸氨基肽酶(LAP)、酸性磷酸酶(AP)。酶活性测定的简要步骤为:称取新鲜土壤1 g 于200 mL 灭菌乐扣盒中,加入125 mL 50 mmol/L 的醋酸钠缓冲液(pH=5),磁力搅拌5 min 使之均质化。使用移液器向96 孔酶标板中分别对应加入250 μL 缓冲液、200 μL 土壤匀浆样品、50 μL标物、50 μL 底物。置于25 ℃黑暗条件下培养4 h后,加入10 μL 1 mol/L 的NaOH 终止反应。采用多功能酶标仪(SynergyH4,BioTek)测定其荧光度。每种酶活性底物如表2 所示。
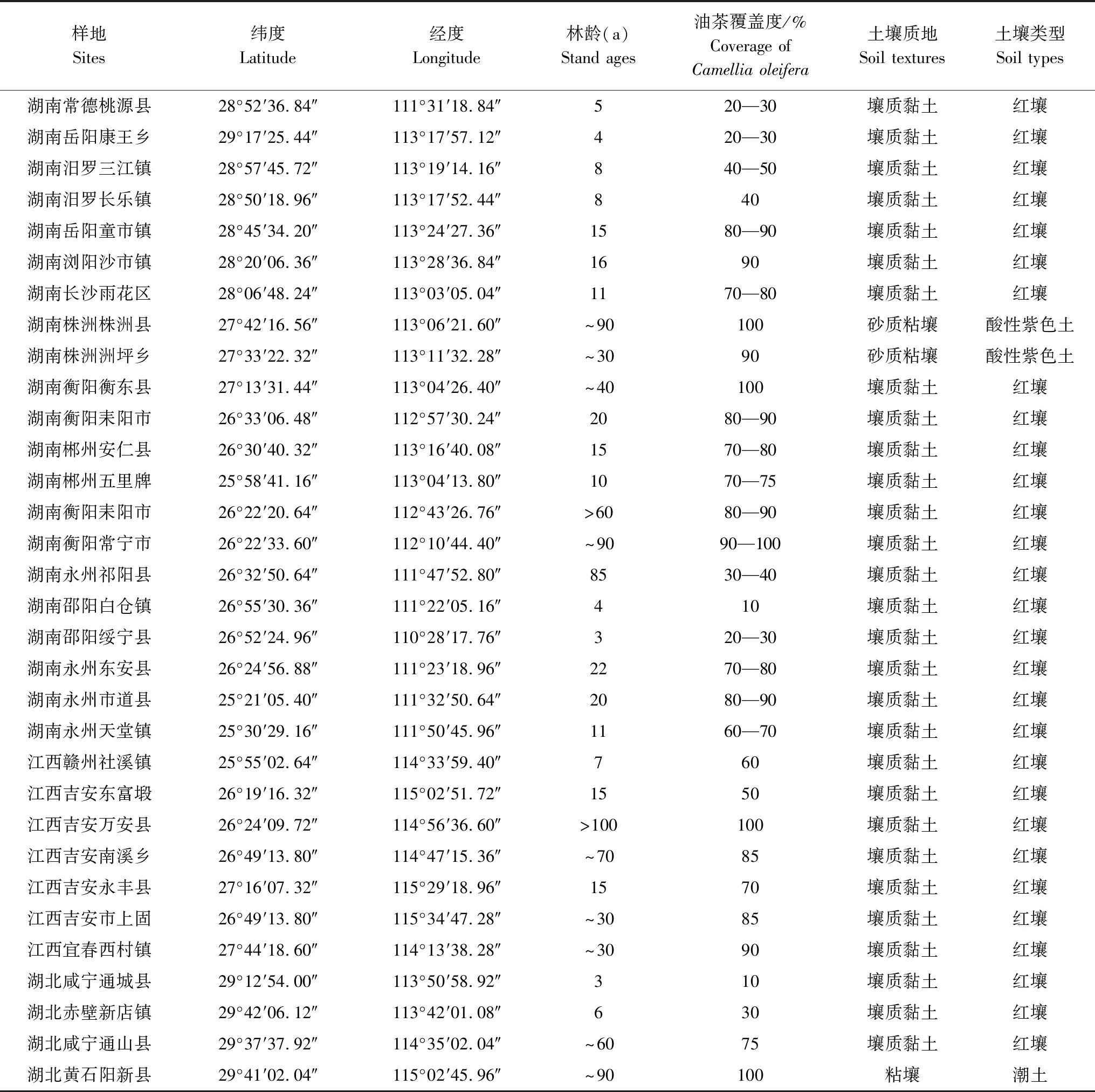
表1 样地基本概况
1.2.3土壤理化性质测定
土壤pH 值采用风干土加去CO2蒸馏水(土水比:1∶2.5,W/V)浸提15 min,用Mettler-toledo 320 pH 计测定;土壤有机碳(SOC)采用外加热法(油浴温度为180 ℃,沸腾5 min),用重铬酸钾-硫酸溶液氧化有机碳,剩余重铬酸钾用硫酸亚铁溶液滴定,从所消耗的重铬酸钾量计算有机碳含量;全氮(TN)采用半微量开氏法-流动注射仪分析测定,将风干土样加入高锰酸钾用浓硫酸消煮,经高温分解,转化为硫酸铵后冷却洗出,用流动注射分析仪(AA3)自动上机测定氮浓度;全磷(TP)采用氢氧化钠熔融-钼锑抗比色法测定,将风干土样与氢氧化钠熔融,使得土壤中含磷矿物及有机磷矿物全部转化为可溶性的正磷酸盐,用水洗出,冷却定容,将样品溶液与钼锑抗显色剂反应,生成磷钼蓝,用分光光度计在700 nm 波长比色,读取吸光值;速效磷(Olsen-P)采用碳酸氢钠-钼锑抗显色法,用0.5 mol/L碳酸氢钠加入风干土样,震荡培养30 min,过滤,取样品溶液与钼锑抗显色剂反应,生成磷钼蓝,用分光光度计在882 nm 波长比色,读取吸光值[29]。

表2 土壤酶种类、缩写以及底物
1.3 数据分析
采用SPSS 19.0 进行数据处理和数据分析,不同林龄土壤理化性质、土壤酶活性及其计量比采用单因素方差分析(One-way ANOVA)中的Duncan 法检验;采用Pearson 相关分析土壤酶活性、土壤酶化学计量比与土壤理化性质之间的关系;采用Canoco 5 软件以土壤酶活性和土壤酶化学计量比为响应变量,土壤基本理化性质及C、N、P 元素计量比为解释变量进行冗余分析(RDA)。图表数据均采用平均值±标准差表示。
2 结果分析
2.1 不同林龄油茶人工林土壤理化性质
油茶人工林土壤pH 值都较低(pH < 5),21—60 a 林龄组的土壤pH 显著高于< 9 a、21—60 a 和> 60 a 林龄组。SOC 含量随林龄增大而增加(P< 0.05),但在21—60 a 和> 60 a 林龄组间差异不显著;TN 含量随林龄的增大有一定程度的增加,< 9 a 林龄组显著低于其余三个林龄组;土壤TP 和Olsen-P 在各林龄组中无显著差异(表3)。

表3 不同林龄油茶人工林土壤基本理化特征
不同小写字母代表差异性显著(P< 0.05); SOC:土壤有机碳 soil organic carbon;TN:总氮 total nitrogen;TP:总磷 total phosphorus;Olsen-P:速效磷Olsen phosphorus
2.2 不同林龄油茶人工林土壤酶活性及酶化学计量比特征
总体上,土壤酶活性随林龄增大都有一定程度增加(图2),BG 活性在> 60 a 林龄组中最高,与9—20 a 和21—60 a 林龄组没有显著差异,但显著高于< 9 a 林龄组;CBH 活性在< 9 a 和9—20 a 没有显著差异。21—60 a 和> 60 a 林龄组CBH 活性没有显著差异,且显著高于< 9 a 和9—20 a 林龄组;NAG 在< 9 a 林龄组中活性最低,在9—20 a 和21—60 a 无显著差异,> 60 a 林龄组显著高于其他三个林龄组;LAP 和AP 活性在< 9 a 林龄组中活性最低,在9—20 a、21—60 a 和> 60 a 三个林龄组中均无显著差异。土壤酶C∶N∶P 化学计量比用ln(CBH+BG)∶ln(NAG+LAP)∶ln(AP)表示,总体上亚热带区油茶人工林土壤酶化学计量C∶N∶P 为1∶1∶1.5。土壤酶化学计量比C∶N 在一定的林龄内(< 60 a)具有增加的趋势;土壤酶化学计量比C∶P 在四个林龄组中均无显著差异;土壤酶化学计量比N∶P 在> 60 a 林龄组显著高于其他三个林龄组(图3)。
2.3 土壤理化因子对土壤酶活性及土壤酶化学计量比的影响
从整体上看,油茶人工林土壤的C、N、P 转化酶活性之间呈显著正相关关系(图4)。土壤酶活与土壤理化性质之间的相关性分析表明:五种酶活性与SOC 和TN 都呈显著正相关。LAP 和CBH 与pH 呈显著正相关,而AP 和pH 为显著负相关。土壤酶化学计量比C∶N仅与土壤N∶P 呈正相关;土壤酶化学计量比C∶P 和N∶P 与土壤C∶N 呈显著正相关(P< 0.05,表4)。RDA 排序图结果显示,第1 轴和第2 轴的解释变量分别为40.05%和0.73%,土壤SOC(F=38.1;P=0.002)、TP(F=5.9;P= 0.016)和pH(F=4.1;P=0.03)是影响土壤酶活性和酶化学计量比的显著影响因子,分别解释了土壤酶活性和土壤酶化学计量比的28.9%,4.2%,2.9%的变异(图5)。

图2 不同林龄油茶人工林的土壤酶活性Fig.2 Soil enzyme activities in Camellia oleifera plantation at different stand ages误差线上方不同小写字母表示不同林龄间差异显著(P<0.05)

图3 不同林龄油茶人工林土壤酶化学计量比特征Fig.3 Ecoenzymatic stoichiometry in Camellia oleifera plantation at different stand ages误差线上方不同小写字母表示不同林龄间差异显著(P<0.05); BG:β-葡糖苷酶β-glucosidase;CBH:α-纤维素酶 β-D-cellobiosidase;NAG:β-乙酰葡糖胺糖苷酶N-acetyl-β-glucosaminidase;AP:亮氨酸氨基肽酶 leucine aminopeptidase;AP:酸性磷酸酶 acid phosphatase;ln(CBH+BG)∶ln(NAG+LAP)表示土壤酶化学计量C∶N;ln(CBH+BG)∶ln(AP)表示土壤酶化学计量N∶P;ln(NAG+LAP)∶ln(AP)表示土壤酶化学计量N:P
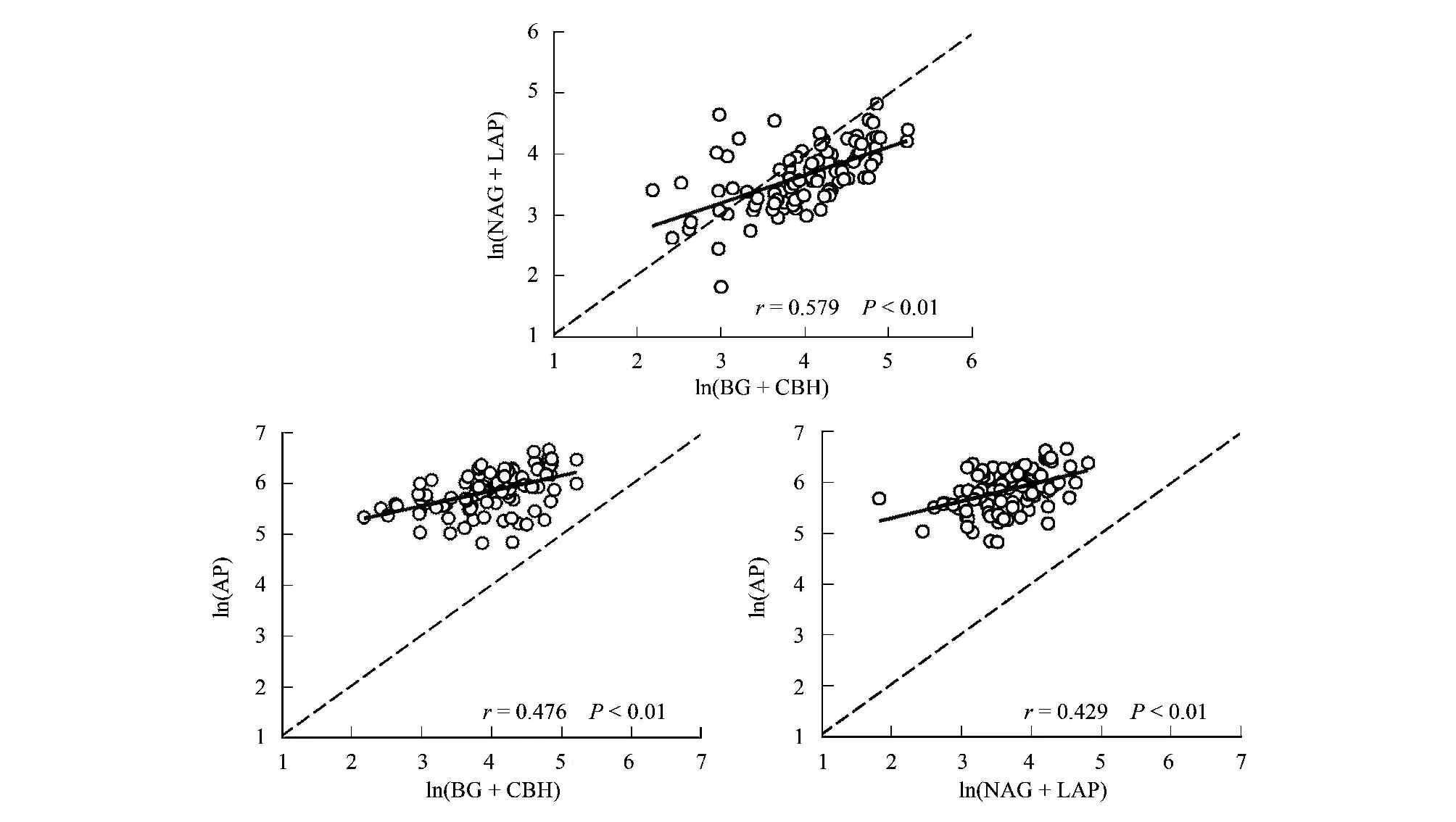
图4 不同林龄油茶人工林土壤酶化学计量关系图Fig.4 Relationships between ecoenzymatic stoichiometry in Camellia oleifera plantation at different stand ages
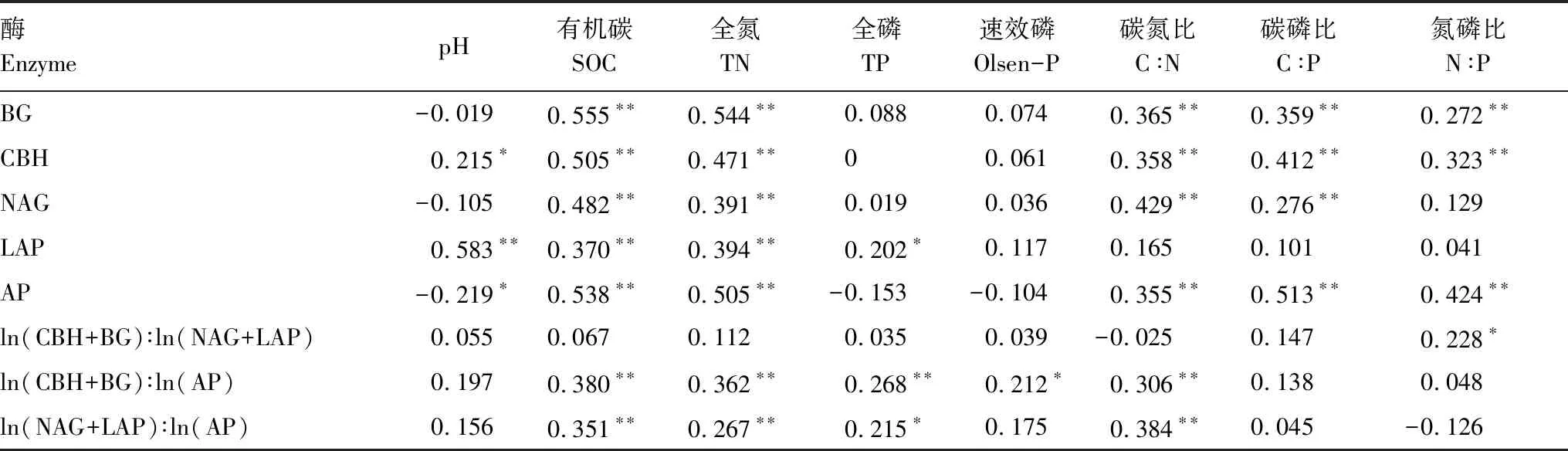
酶EnzymepH有机碳SOC全氮TN全磷TP速效磷Olsen-P碳氮比C∶N碳磷比C∶P氮磷比N∶PBG-0.0190.555∗∗0.544∗∗0.0880.0740.365∗∗0.359∗∗0.272∗∗CBH0.215∗0.505∗∗0.471∗∗00.0610.358∗∗0.412∗∗0.323∗∗NAG-0.1050.482∗∗0.391∗∗0.0190.0360.429∗∗0.276∗∗0.129LAP0.583∗∗0.370∗∗0.394∗∗0.202∗0.1170.1650.1010.041AP-0.219∗0.538∗∗0.505∗∗-0.153-0.1040.355∗∗0.513∗∗0.424∗∗ln(CBH+BG)∶ln(NAG+LAP)0.0550.0670.1120.0350.039-0.0250.1470.228∗ln(CBH+BG)∶ln(AP)0.1970.380∗∗0.362∗∗0.268∗∗0.212∗0.306∗∗0.1380.048ln(NAG+LAP)∶ln(AP)0.1560.351∗∗0.267∗∗0.215∗0.1750.384∗∗0.045-0.126
*在0.05水平上显著相关,**在0.01水平上显著相关; 碳氮比 carbon to nitrogen ratio;C:P:碳磷比carbon to phosphorus ratio;N:P:氮磷比nitrogen to phosphorus ratio

图5 土壤酶活性和酶化学计量比与土壤理化因子的冗余分析(RDA)Fig.5 Redundancy analysis (RDA) of soil enzyme activities and ecoenzymatic stoichiometry ratios
3 讨论
3.1 土壤养分和土壤酶活性对不同林龄油茶人工林的响应
林龄通过改变植被状况和林分环境对土壤理化性质产生影响,同时通过影响凋落物的形成分解、根系分泌物含量进而改变微生物群落与数量,从而影响土壤酶活性[30-31]。不同林龄油茶人工林SOC、TN 含量及酶活性均表现为幼龄林最低,过熟林最高,这可能与不同林龄油茶人工林凋落物产量、分解速率和根系生物量不同有关[32]。随林龄增大,林下凋落物及植物残体增多,补充了土壤SOC 含量和TN 含量,为土壤微生物提供使其生存的碳源和氮源,微生物酶活性增加[33]。此外,随林龄增加,长时间的土壤微生物固碳、固氮和大气氮干湿沉降也使得土壤养分积累[34-36],微生物酶活性增加。新造油茶人工林一般采用全垦方式[37],表层土壤养分含量低,微生物量少,酶活性较低,且在油茶幼龄期间,油茶生长速率快,需要大量土壤养分以满足自身需求,并与土壤微生物竞争氮磷养分,因此通过植物根际过程能够提供给微生物的养分含量少。在油茶生长的中后期,油茶生长缓慢,养分积累速率下降,C、N、P 转化酶活性缓慢增加,趋于稳定[38-40]。由此可得,随林龄改变,土壤养分和土壤酶活性变化具有趋同性。一般而言,土壤酶活性与土壤养分含量呈显著正相关,如吕春花等的研究,这与本文研究基本一致[41]。值得注意的是,油茶人工林的磷转化酶活性并没有随着土壤磷含量的变化而变化,且活性一致处于较高水平,这可能与研究区普遍缺磷有关。本研究大部分的油茶人工林土壤Olsen-P 含量一般低于5 mg/kg,显著低于该区域内柑橘园Olsen-P 含量(14.3 mg/kg)和茶园土壤Olsen-P 含量(11.2 mg/kg)[42]。
3.2 油茶人工林土壤酶化学计量比与土壤理化性质的关系
土壤酶化学计量受土壤C、N、P 资源有效性的调控[43]。本研究结果发现,SOC 是影响土壤酶化学计量比的关键因子,且相关分析结果表明土壤酶化学计量比C∶P 和N∶P 与SOC 呈显著的正相关关系,SOC 含量越高,土壤酶化学计量比C∶P 和土壤酶化学计量比N∶P 越高,说明SOC 含量增加,能够同时促进土壤微生物分泌C、N 转化酶。这与曹等的研究结果增加土壤有机质,土壤蔗糖酶和几丁质酶活性增高一致[44]。研究发现土壤酶化学计量比C∶N 为1∶1,与SOC 含量无关,表现出C、N 等速矿化的特征,这与全球尺度酶C∶N 化学计量比一致。
此外,本研究中土壤酶化学计量比还受到土壤C∶N 和N∶P 的影响。鉴于土壤酶主要来源于土壤微生物、植物根系分泌及植物降解的产物,而微生物生物量化学计量比随土壤和植物组织养分化学计量比的改变而改变[45],导致了土壤酶化学计量比亦能够受土壤养分化学计量比的影响。值得注意的是,土壤酶C∶N 化学计量比与土壤C∶N 无显著相关,而土壤酶N∶P 化学计量比和C∶P 化学计量比均与土壤C∶N 显著相关,表明了土壤酶化学计量与土壤元素计量不存在严格的对应关系,体现了土壤酶化学计量关系的复杂性。土壤酶化学计量比并不能够很好的反映土壤元素的比例组成,可能的原因之一是土壤元素的计量比不能表征有效态养分的计量比,此外,一些未测量因子如土壤温度、土壤水分可能间接的调控了土壤酶化学计量比[46-47]。
3.3 油茶人工林土壤养分限制因子
土壤酶化学计量比是指示微生物养分限制的重要因子,土壤C、N、P 转化酶活性对数转换后的比值为1∶1∶1.5,与全球生态系统1∶1∶1 的比值相偏离[13],表明研究区域内具有较高的P 转化酶活性,从而反应了研究区内土壤P 素的相对缺乏。微生物为满足自身P 的需求,将分泌更多的P 转化酶矿化土壤中的有机磷,本研究结果与大多数的研究认为亚热带地区磷是生态系统生产力的限制因子一致[48-49]。全球范围内,土壤全磷含量平均为0.5 g/kg,远大于亚热带地区全磷含量(0.35 g/kg),且亚热带地区土壤高度风化呈酸性,土壤磷被含量较高的活性铁和铝强烈吸附,形成难溶性磷酸铁和磷酸铝等,导致亚热带地区有效磷含量低[50]。本研究还发现,四个林龄组土壤酶活性比(CBH+BG)∶(AP)和土壤酶活性比(NAG+LAP):(AP)均显著低于全球尺度上土壤酶活性比(CBH+BG)∶(AP)(0.62)和(NAG+LAP):(AP)(0.44)[13],说明所有林龄油茶人工林土壤均存在磷限制。此外,随林龄增加土壤P 转化酶活性有增加趋势,表明成年林土壤较幼龄林土壤磷限制更严重,这可能的原因是长期的油茶果实采摘带走的磷素导致土壤磷缺乏趋于严重。
4 结论
亚热带区不同林龄油茶人工林生态系统的C、N、P 转化酶活性存在显著差异。土壤C、N、P 转化酶活性随林龄增大均有一定程度增加。在四个林龄组中,P 转化酶的活性均高于C 和N 转化酶活性。整体上,油茶人工林土壤酶活C∶N∶P 计量比值为1∶1∶1.5,与全球生态系统中土壤酶活C∶N∶P 计量比1∶1∶1 的比值发生偏离,表明该区域的油茶人工林土壤受P 限制。土壤SOC 含量是驱动土壤酶活性和改变酶化学计量比的关键因子。因此,在油茶人工林经营管理中,应长期注重磷养分以及有机物料的添加管理。
