微振动应力环境影响羟基磷灰石陶瓷生物活性及力学稳定性的体外评价
2019-05-11吴金结魏仁初汪建新屈树新
吴金结,李 艳,魏仁初,汪建新,屈树新,翁 杰,智 伟
(西南交通大学 材料科学与工程学院,材料先进技术教育部重点实验室,成都 610031)
羟基磷灰石(HA)陶瓷作为骨骼的主要无机成分,具有良好的生物相容性、骨传导性以及潜在的骨诱导能力[1-3],作为骨修复替代材料和组织工程骨的支架材料被广泛应用于临床骨缺损治疗中[4-5]。由于材料的生物活性以及力学稳定性在植入初期对骨组织再生过程起着至关重要的作用[6-8],因此有必要对其生物活性及力学稳定性进行体外评价。
研究证实骨原位环境中磷酸钙陶瓷具有骨诱导活性,其诱导触发机制是从磷酸钙陶瓷中释放出的Ca2+、PO43-、HPO42-导致材料周围体液环境出现离子局部过饱和状态,继而在材料表面形成包含钙离子、磷酸根和其他离子(Mg2+,Na+,CO32-)的类骨磷灰石层,同时也使蛋白质和其它有机物沉积其中[3,9]。因此磷酸钙陶瓷生物活性体外评价通常考察材料的化学成分、宏观和微观几何结构以及孔隙率等材料因素对钙离子释放、蛋白吸附、钙磷矿化沉积和体外降解性能的影响。但研究同时也发现,生物陶瓷骨诱导性的体外评价结果与体内评价结果之间常出现较大差异[10]。
目前对生物陶瓷骨诱导性的体外评价方式通常在静态环境中进行[11],而如果考虑到材料植入后所处的生理应力环境,在体外考察应力环境作用下材料的生物活性行为就可能更具真实性和准确性[12-13]。此外,骨作为承力组织始终处于持续的应力负荷状态,研究应力环境下对材料力学性能的影响非常必要[14]。
微振动(Micro Vibration Stress,MVS)是振幅≤50 μm、强度<1 g、频率范围在1~100 Hz的极低幅度、低强度、低频率的应力刺激[15-16],被认为是一种生理适宜性的力学刺激,具有良好的促进骨形成和骨重建效应[17-18]。研究表明,微振动所引起的流体双向流动可以模拟生理运动状态下骨组织中组织液的双向流动方式,能促进基质细胞向成骨分化,是一种能真实模拟生理应力环境的体外加力方式[10,19]。但迄今为止,针对微振动应力环境与材料生物活性及力学性能之间相关性的研究尚未见报道。
基于此,本研究采用前期工作中建立的溶胶-凝胶法制备了HA材料[20-22],考察了MVS对HA材料钙离子释放[23]、蛋白吸附[24-25]、生物矿化[26-28]和抗压性能[29]的影响,并初步探讨了力学因素对磷酸钙陶瓷骨诱导行为的调控作用。
1 实验方法
1.1 原料及试剂
氯化钠、碳酸氢钠、氯化钾、磷酸氢二钾、氯化镁、N,N-二甲基乙酰胺(Dimethylacetamide,DMAC),盐酸、氯化钙、硫酸钠、Tris均为分析纯,由成都科龙化工试剂厂出品。直径20 μm的球状HA粉体由四川大学国家生物医学材料工程技术研究中心制备。血清白蛋白(BSA)由美国BI公司生产;无钙镁离子的 PBS缓冲液由美国 GIBCO公式生产;钙离子试剂盒、BCA法蛋白定量测试盒由南京建成生物制剂有限公司生产。
1.2 微振动参数
采用自主设计制备的微振动培养一体装置(中国发明专利申请号:201610900515.6;实用新型专利授权号:ZL 201621126644.6)。目前的研究显示振幅为50 μm,强度0.3 g的微振动应力刺激最有利于诱导细胞的成骨分化[15],振动频率在 25~50 Hz范围内上调成骨细胞的成骨基因表达和促进骨形成,而60 Hz以上则倾向于抑制细胞增殖[16],因此在本研究中将样品分为40 Hz组、60 Hz组、静态组。将微振动组样品牢固固定于振动台台面上。振动参数设置为:振幅50 μm,强度0.3 g,频率分别为40 Hz、60 Hz,振动方向及波形:垂直正弦振动。
1.3 HA陶瓷材料制备
1.3.1 制备具有不同表面微孔隙率的HA片
将5 g无水氯化锂加入100 mL DMAC中,加入0.7 g甲壳素,溶解后形成溶胶。按照HA/Chitin质量比 10 :1、20 :1 和 35 :1 分别向溶胶体系中加入HA粉末,搅拌均匀,密封静置24 h后倒入24孔板内,每孔加入4 mL浆料,静置2 h后加入去离子水得到凝胶化的 HA片。用去离子水将三组样品充分洗涤后干燥,常压烧结至1200 ℃(升温速率为2.5 ℃/min)即得到具有不同微孔隙率的HA片,分别用HA10、HA20、HA35表示。
1.3.2 模板法制备HA多孔支架
按照本课题组前期发明的方法[26],即将5 g无水氯化锂加入100 mL DMAC中,加入0.7 g甲壳素,溶解后形成溶胶。按照HA/Chitin质量比20/1向溶胶体系中加入 HA粉末,搅拌均匀,密封静置 24 h后将浆料注入石蜡球粒堆积的模具中,推入去离子水中得到凝胶化的多孔HA支架粗坯。用去离子水充分洗涤样品使材料粗坯中绝大部分 Li2+溶出,以保证余下痕量 Li2+不会对材料的生物学性能产生影响[30]。37 ℃干燥,常压烧结至 1200 ℃(升温速率为2.5 ℃/min)即得到HA多孔支架。
1.4 材料表征
利用密度法测定HA片的微孔隙率;采用液体置换法测定HA多孔支架的总孔隙率。Brunauer-Emmett-Teller(BET)法计算 HA片的比表面积;扫描电子显微镜(FEI Quanta 200)观察分析材料的表面微形貌;X-射线衍射仪(XRD,XD1000)分析材料相组成。密度法测定孔隙率的公式如下:
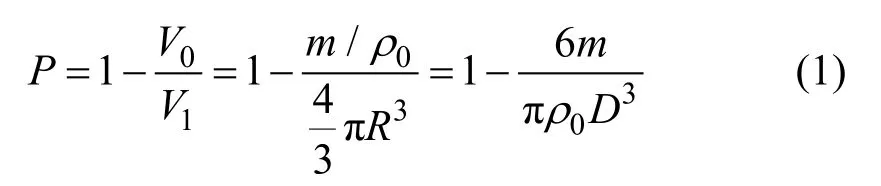
ρ0为H A理论密度(3.16 g/cm3);m为单颗HA球形颗粒的质量;V0为致密的HA球形颗粒的体积;V1为实测HA球形颗粒的体积。
液体置换法测定总孔隙率的公式如下:

1.5 MVS对HA陶瓷生物活性的影响
取三组 HA(HA10、HA20、HA35)片按 5 g/100 mL的比例浸泡在不含钙镁的PBS中,置于37 ℃,分为40 Hz组、60 Hz组和静态组,在浸泡3、7、14 d后,取样品上清液,在碱性环境中与甲基百里香酚蓝(MTB)结合,生成蓝色络合物,通过比色与同样处理的钙标准进行比较,计算样本中钙离子的含量,再计算样品单位质量钙离子释放浓度。
取三组 HA(HA10、HA20、HA35)片按 5 g/100 mL的比例加入2 mg/mL的BSA溶液,置于37 ℃,分为40 Hz组、60 Hz组和静态组,浸泡1、3 d后,用BCA试剂盒测定上清液中蛋白质含量,再根据质量守恒原则计算单位样品蛋白吸附量。
取三组 HA(HA10、HA20、HA35)片按 5 g/100 mL的比例浸泡在仿生矿化液 SBF中,置于 37 ℃,分为40 Hz组、60 Hz组和静态组,进行仿生矿化实验,每24 h更换一次,共矿化3、7 d。纯净水和乙醇轻柔冲洗样品,80 ℃干燥24 h,用扫描电镜观察矿化沉积物形貌,EDS能谱分析钙磷比。
1.6 力学稳定性测试
将多孔HA支架分为40 Hz组、60 Hz组和静态组,按照5 g/100 mL的比例浸入无钙镁PBS缓冲液中,置于37 ℃,在0、7、14 d取样,用纯净水和无水乙醇轻柔冲洗样品,150 ℃干燥24 h,用电子万能力学测试机(INSTRON,美国)测试(载荷速率为0.5 mm/min,载荷测量精度为1 N,变形测量精度为0.005 mm)函数记录仪记录载荷-变形曲线。
2 结果与讨论
2.1 成分分析及表面微形貌观察
烧结后三组HA片和HA多孔支架的XRD结果(图1)显示,各组样品经过 1200 ℃高温烧结后,在约 26°、32°、40°、47°、50°的位置均出现了明显的HA特征峰,与标准图谱完全吻合(JCPDS09-0432),且未见其他杂相,说明本研究所制备的 HA材料在制备和烧结过程中没有引入其他物质。

图1 HA10、HA20、HA35和HA多孔支架烧结后XRD图谱Fig.1 XRD patterns of HA10,HA20,HA35 and porous HA scaffolds
扫描电镜观察结果显示(图2),HA10表面存在大量微孔,且尺寸分布在 10 μm以下,部分微孔尺寸小于1 μm,HA20微孔数量少于 HA10,HA35表面光滑、致密,仅存在少数微孔。多孔 HA支架的总孔隙率为(87.7±2.2)%,其表面形貌与HA20相似,这是因为两者的浆料配制比例相同。
2.2 MVS应力环境下HA材料的钙离子释放
微孔隙率检测及BET测试结果显示,随着HA粉体比例的提高,HA片微孔隙率呈显著下降趋势,HA10微孔隙率为(29±1.2)%,比表面积为121.97 m2/g;HA20微孔隙率为(26.4±0.3)%,比表面积为87.41 m2/g;HA35微孔隙率为(10.6±0.8)%,比表面积为16.53 m2/g。

图2 HA材料的SEM照片Fig.2 SEM images of HA materials
钙离子释放结果显示(图3),三组HA片在静态和微振动环境下其单位质量钙离子释放浓度均随时间延长而增加,这说明钙离子释放具有时间累积效应。静态组中随着 HA材料微孔隙率的降低,Ca2+释放浓度随之显著下降,这是因为比表面积的降低使得钙磷溶解度减小;而振动组(40 Hz组和60 Hz组)的结果却呈相反趋势,随着微孔隙率的降低,Ca2+释放浓度呈显著上升态势。此外,对于具有较高微孔隙率(10%)的HA材料,在40 Hz的MVS应力环境下Ca2+释放浓度显著低于静态环境,而在60 Hz时 Ca2+释放浓度在初期降低,随后显著增高;对于微孔隙率较低(35%)的 HA35组,随着频率的增加,Ca2+释放浓度相较于静态环境则始终呈现显著上升的趋势。这说明40 Hz应力环境能促进具有较高微孔隙率 HA材料的钙离子再沉积,同时有利于具有低微孔隙率HA材料的钙磷溶解;而60 Hz应力环境则能促进全部HA材料的钙磷溶解。这可能是因为对于微孔隙率较高的 HA材料来说,其本身较大的比表面积有利于钙离子的释放,局部钙离子浓度已经接近饱和浓度,中低频(40 Hz)的 MVS所引起的流体双向流动使材料局部钙离子浓度很快达到过饱和,从而引起了钙磷的再沉积,因此溶液中钙离子浓度较静态组显著降低;而高频(60 Hz)MVS尽管在早期也引起了钙磷的再沉积,但高频所致的流场流体行为最终更利于钙离子释放。对于低微孔隙率HA材料,其比表面积较小,钙离子释放少,因此MVS对其的影响以促进钙离子释放为主,频率越高,钙离子释放越多。此外,材料在静态环境和中低频MVS应力环境中的钙离子释放在沉积到第14 d时已经趋于平衡状态,而在高频 MVS应力环境中则明显仍以钙离子释放为主。Zhi等[10]的研究证实微孔隙率通过对磷酸钙生物陶瓷比表面积的影响来调控蛋白吸附和钙离子的释放/再沉积过程,从而影响磷酸钙陶瓷的生物活性。本研究的结果则进一步表明应力环境和材料结构因素对于材料钙离子释放/再沉积过程具有共同调控作用。

图3 微振动对不同微孔隙率HA陶瓷片钙离子释放的影响Fig.3 Calcium release concentration of HA slices with different mass fraction(HA10,HA20,HA35)under 40 Hz and 60 Hz frequency and static state incubation environment at d3,d7 and d14(* represents statistical difference,P<0.05)
2.3 MVS应力环境下HA材料的蛋白吸附研究
蛋白吸附结果(图4)显示,三组HA片在静态环境和 MVS应力环境下单位质量吸附量均随时间增加,并随着微孔隙率的降低而呈现下降趋势,这说明 HA10在表面具有最多吸附位点,这应该与其具有最大比表面积相关。40 Hz 的MVS应力环境下三组 HA片的蛋白吸附量均显著高于静态环境,而60 Hz的MVS应力环境下三组HA片的蛋白吸附量又显著低于静态组。这可能与 MVS环境下流体在材料表面流动带来的剪切应力有关[10],不同频率的MVS明显影响了流体的剪切应力,从而对材料的蛋白吸附行为造成了显著的影响。表面吸附蛋白质是生物材料植入体内后在体液环境下的初始行为,这一行为对于随后发生的细胞行为及最终植入物的使用效果起着重要的作用[24]。一般认为,材料对蛋白的吸附量与其比表面积呈正性相关[31-32]。本实验结果与该结论一致,并进一步揭示了应力环境在磷酸钙陶瓷蛋白吸附行为中所起到的重要调控作用。
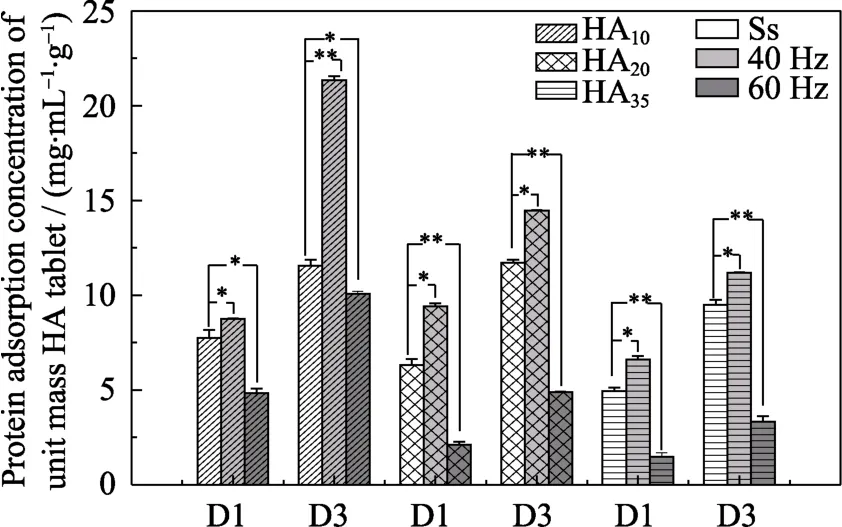
图4 微振动对不同微孔隙率HA片蛋白吸附的影响Fig.4 Protein adsorption concentration of HA discs with different mass fraction(HA10,HA20,HA35)under 40 Hz and 60 Hz frequency and static state incubation environment at d1 and d3(* represents statistical difference,P<0.05)
2.4 MVS应力环境下HA材料的仿生矿化研究

图5 HA在SBF溶液中3,7 d后的SEM照片Fig.5 SEM results of HA ceramic discs with different mass fraction soaked in SBF solution for 3 and 7 d
三组HA片在静态和MVS应力环境中置于SBF溶液中分别浸泡3和7 d后,表面矿化情况如图5所示。在静态环境中,矿化3 d后,HA10组和HA20组均在表面观察到大量片状矿化物沉积,HA35组则为散开的片状和颗粒状矿化物混合沉积,且矿化沉积物分布为 HA10组>HA20组>HA35组(图5(a1)、(a3)、(a5))。7 d后在HA10组和HA20组表面的片状矿化层覆盖更为密集,而在 HA35组表面沉积的矿化物较 3 d时明显增多,主要以颗粒状和絮状为主(图5(a2)、(a4)、(a6))。在 40 Hz的 MVS应力环境下,HA10组和HA20组在矿化3 d时即观察到材料表面有均匀致密的颗粒状矿化层的覆盖,并在矿化层上观察到絮状矿化沉积物,HA35组表面颗粒状矿化沉积物零散分布(图5(b1)、(b3)、(b5));7 d时HA10组和 HA20组矿化层明显增厚,矿化层上的絮状矿化物增多、增大,HA35组表面颗粒状矿化物增多,但与静态组相比矿化沉积量较少(图5(b2)、(b4)、(b6))。在60 Hz的MVS应力环境下,三组HA材料在矿化3 d时表面矿化沉积情况均与40 Hz时相似(图5(c1)、(c3)、(c5)),但在矿化7 d时HA10组和HA20组表面矿化沉积物并未见明显增多;而 HA35组表面矿化沉积物则更为疏松(图5(c2)、(c4)、(c6))。EDS能谱分析结果(图6)显示,矿化 7 d的三组样品在静态组、40 Hz组和60 Hz组的钙磷比均在1.62~1.73的范围内。研究发现在仿生矿化过程中,Ca/P摩尔比在 1.5~1.67 范围内,产物为 HA+β-TCP(β-Ca3(PO4)2),当Ca/P摩尔比在1.68~1.7范围内时,产物为HA,当Ca/P摩尔比大于或等于1.7时,产物为HA + CaO[33]。该结果证实了沉积产物是类骨磷灰石。
磷酸钙陶瓷的仿生矿化过程包括两个阶段:晶核形成和晶核长大[11]。材料表面的局域钙磷浓度被认为是成核的关键[12]。具有较大比表面积的磷酸钙陶瓷能提供更多的磷灰石晶体的成核位点,更容易促进钙磷矿化层的成核生长,并且更高的微孔隙率使得更多的来自于材料的Ca2+、PO43-、HPO42-扩散到周围,从而使得钙磷再沉积更容易发生。磷酸钙源的存在是发生异位骨形成的前提条件之一[34-35]。而本研究的结果表明,中低频的 MVS应力环境能够更好地促进具有较高微孔隙率的HA钙磷离子的矿化沉积,而对具有较低微孔隙率的 HA矿化沉积则显示出抑制作用;高频的 MVS应力环境从最终结果来看并不利于HA的矿化沉积。这可能是因为中低频的微振动环境使得模拟体液处于往复流动状态,这种流动状态加速了表面钙磷离子溶出。由于粗糙表面具有较多的微孔,这些区域会阻碍液体的流动和离子的扩散,因而较快地达到成核阈值,一旦晶核形成,流动状态更有利于离子的交换,晶核很快长大并均匀分布。而光滑致密表面由于缺少这些“阻碍区域”,因此离子容易扩散,不利于材料表面的离子浓度达到成核阈值。对于高频的微振动环境,模拟体液流速过快以致材料表面的钙磷离子扩散较快,不利于离子浓度达到成核阈值,因此抑制了HA材料表面类骨磷灰石的形成[12,14,36]。
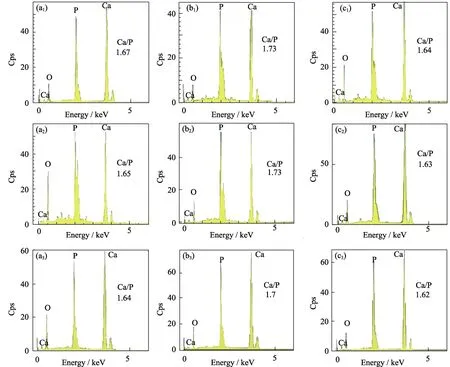
图6 HA材料浸泡在SBF溶液中7 d后的EDS能谱分析Fig.6 EDS spectra of HA materials after 7 d in SBF solution
过去的研究显示,尽管致密 HA的体外仿生矿化结果显示其通常能在矿化7 d后形成类骨磷灰石层[10],但体内实验中从未有过致密HA异位骨形成的报道[37],而类骨磷灰石层的形成通常被认为是诱导骨形成的起始[10],这就使得体内外实验结果发生了矛盾。而本研究结果则提示体内生理应力环境很可能不利于微孔隙率较低的HA材料植入后的矿化沉积,从而抑制了随后的一系列细胞分化和组织形成过程,最终影响了骨形成的发生。此外,不同频率的MVS应力环境对HA矿化沉积的不同影响也可以用于解释材料植入体内不同应力部位后骨诱导行为的差异性。
2.5 MVS应力环境下HA多孔支架的抗压性能
抗压试验结果显示(图7),MVS应力环境对HA多孔支架力学稳定性没有明显影响。在40和60 Hz的MVS环境中浸泡7和14 d后,HA多孔支架的抗压强度仍与初始强度相仿。这意味着微振动不会显著影响HA多孔支架的抗压强度。这可能是因为HA具有极低的体外降解速度,即使在 MVS应力环境促进其钙离子释放的情况下,材料的降解也是极其有限的。骨生物支架的降解行为对细胞长入、宿主反应和组织再生有重要作用[10]。理想的支架降解速度应与新生骨组织再生的速度相匹配。而骨形成是一个缓慢的过程,尤其是在支架植入初期,因此支架的力学稳定性就成为再生修复成功的前期要素之一。虽然理论上植入物能发生更快的改建过程是一个优点,但从临床角度来看对改善修复失败或是并发症的发生并无明显效果[10]。前述HA陶瓷生物活性体外评价实验的结果已经显示在 MVS应力环境下得到的评价结果可能更真实可靠,因此实验证明MVS应力环境不至于造成HA多孔支架的力学性能破坏,具有重要的临床应用指导意义。
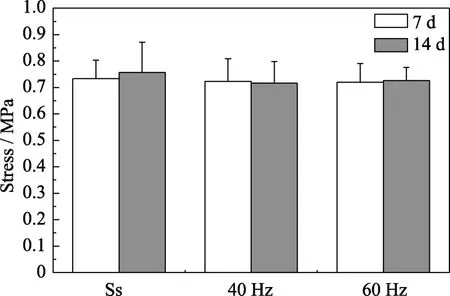
图7 微振动对HA多孔支架抗压强度的影响Fig.7 Compressive strength of HA porous scaffold under static state,40 and 60 Hz vibration frequency incubated for 7 and 14 d
3 结论
本研究首次尝试在体外构建MVS应力环境来模拟体内生理应力环境,从而得到更真实准确的HA生物活性和力学稳定性评价结果,这将有助于骨诱导性磷酸钙陶瓷的设计和优选,并为深入理解磷酸钙陶瓷骨诱导机制提供理论依据和实验基础。
研究证实应力环境是影响 HA陶瓷生物活性和骨诱导性的重要因素,并且这种力学因素与材料本身的理化因素共同作用于HA陶瓷的生物活性。在没有影响HA支架抗压性能的前提下,具有较高孔隙率HA材料的生物活性在中低频MVS应力环境中得到了明显增强;但对于较低孔隙率的 HA材料,其在MVS应力环境中生物活性有所降低。