海洋源乳酸菌AI-2类群体感应抑制剂对单增李斯特菌抑制效果研究
2019-05-09黄湘湄吴雅茜刘颖梁嘉烨苏伟明
黄湘湄 吴雅茜 刘颖 梁嘉烨 苏伟明
(广东省水产品加工与安全重点实验室 广东海洋大学食品科技学院,湛江 524088)
单增李斯特菌(Listeria monocytogenes,L. m)因含有内化素、李斯特菌溶血素、蛋白ActA、磷酸脂酶C等毒力因子,极易引发高的致死率(高达20%)[1],同时,形成的生物被膜(Biofoilm,BF)加剧了L. m对不良外界环境因素的耐受力[2-3],可在酸性、碱性及低温条件下生长,而且L. m生活范围非常广泛,因此对各类食品的安全构成极大的威胁。自美国甜瓜污染L. m造成33人死亡的食源性感染[4],至死亡率达15%的27个欧盟成员国报告的2161例L. m污染食品等灾难性事件的爆发[5],已引起各国政府的高度关注,并被WTO世界卫生组织定义为四大食源性致病菌之一[6]。
越来越多的研究显示,L. m毒力及生物被膜的形成等致病力相关的生物现象是受细菌群体感应系统(Quorum-Sensing,QS)自诱导物质(Autoinducer,AI)的信号分子调控的[7-8]。信号分子AI能够感应细菌种群密度及周围环境的变化,当信号分子AI-2浓度达到一定阈值时,可以结合细胞膜上的受体并通过信号传递系统调控如毒力等特定基因表达[9],因此,通过阻断信号分子AI-2的传递成为控制L.m等致病菌的一个有效策略。而群体感应抑制剂(Quorum sensing inhibitor,QSIs)可以阻断细菌种内或种间信号分子的形成与交流,使致病细菌及腐败细菌的致病能力与致腐能力下降[10],也使得寻找新型、有效的QSIs成为研究热点。目前,科学家通过对海洋生物的研究发现了许多具有QS系统活性的抑制剂,如海洋红藻(Delisea pulchra)[11-14]、莱茵衣藻(Chlamydomonas reinhardtiij)[15]分泌产生的卤代呋喃酮等多种化合物,与细菌AI-2类QS信号分子结构类似,通过与信号分子受体蛋白竞争性结合抑制细菌QS调控的多种功能。海洋微生物在物种、生态、遗传等方面都呈现丰富的多样性[16],其中海洋微生物代谢产物由于化学结构的多样性成为筛选、开发新型QSIs潜在的重要资源宝库[17-18]。
本研究以测定报告菌哈维氏弧菌BB170的发光值作为筛选指标,对具有抗菌活性的16株海洋源乳酸菌代谢产物进行L. mAI-2信号分子QSIs的筛选,并对控制L. m的效果进行评价,研究旨在为从海洋环境中筛选与开发乳酸菌源L. mQSIs提供理论依据。
1 材料与方法
1.1 材料
单增李斯特菌标准株ATCC 19111购于广东省微生物研究所,哈维弧菌(Vibrio harveyi)BB170由中国农业科学院韩先干教授惠赠,乳酸菌为本实验室从湛江海域中的海洋动物肠道分离得到的;LB培养基、MRS肉汤培养基、胰酪胨大豆酵母浸膏肉汤(TSB-YE)、胰酪胨大豆酵母浸膏琼脂(TSA-YE)均购置于北京陆桥技术有限责任公司。乙酸乙酯、甲醇、乙醇、PBS缓冲液、结晶紫染色液购于广州齐云生物技术有公司。
旋转蒸发仪N-1100D-WB,东京理化;生化培养箱 SPX-250B-Z,上海博迅医疗设备厂;立式压力蒸汽灭菌锅 LDZX-50KBS,上海申安医疗器械厂;超净工作台 SW-CJ-1F,苏州净化设备有限公司医疗设备厂;全自动酶标仪 Varioskan Flash,美国Thermo Scientific;智能型倒置荧光显微镜DMI4000B,德国leica。
1.2 方法
1.2.1 乳酸菌乙酸乙酯提取物的制备 将16株乳酸菌接种于MRS液体培养基活化,28℃ 140 rpm摇床培养48 h,4℃ 8 000 rpm离心10 min,0.45 μm滤膜过滤得乳酸菌发酵上清液,加等量乙酸乙酯萃取过夜,并于45℃ 120 rpm真空旋转蒸发,收集的乙酸乙酯粗提物再溶于纯水,配成浓度200 mg/mL的工作液备用。
1.2.2 乳酸菌乙酸乙酯提取物对L. mAI-2类信号分子活性的影响 将实验室4℃斜面保存的L. mATCC 19111与哈维氏弧菌BB170分别接种于100 mL TSB和LB培养基,37℃和28℃ 120 rpm摇床培养过夜,浓度调整为108CFU/mL的菌液。分别取200 μL乳酸菌乙酸乙酯提取物工作液及50 μL的L. m菌液加到10 mL TSB培养基中,37℃振荡培养12 h,4℃12 000 rpm离心10 min取上清与50 μL哈维氏弧菌BB170菌液加到100 mL LB培养基,28℃振荡培养6 h,取200 μL于黑色96孔板,用多功能酶标仪生物发光模式检测BB170发光情况。AI-2活性值为含乳酸菌乙酸乙酯提取物诱导BB170发光值与发光值的百分比值,并以无菌水代替抑制剂作为阴性对照的AI-2 活性值定为 100%[19-20]。
1.2.3 QSI对L. m的MIC值测定 采用牛津杯双层琼脂扩散法测定抗菌活性。以L. m为指示菌,分别向牛津杯孔中加入200 μL 浓度为125、250、500 μg/mL的QSI,超纯水为空白对照组,4℃静置扩散4 h,37℃培养24 h后,将能够L. m抑制出现明显增长的最低浓度定为最抑制浓度(MIC)[21]。
1.2.4 QSI对L. m生长的影响 取50 μL浓度为108CFU/mLL. m菌液接种到100 mL含QSI终浓度分别为 125、250、500、1 000 μg/mL的 TSB培养基中,以不含QSI组作为阴性对照组,TSB培养基作为调零组,37℃振荡培养24 h,每1 h于取样并在波长600 nm处测量吸光值,以培养时间为横坐标,绘制不同浓度的QSI作用下L. m的生长曲线[22]。
1.2.5 QSI对L. m动力的影响 将含有0.4 %琼脂的TSB培养基加入无菌试管,添加终浓度为125、250、500 μg/mL的QSI混匀,以不含QSI作空白对照组,凝固后用接种针将L. m垂直穿刺接种,28℃下培养48 h,观察QSI对L. m动力的影响[22]。1.2.6 QSI对L. m生物膜形成的抑制
1.2.6.1 生物膜形成的定量检测 将浓度为108CFU/mLL. m菌液 10 μL接种到 190 μL含 QSI终浓度分别为125、250、500 μg/mL的TSB培养基的96板孔中,以不含QSI为阴性对照组。37℃静置培养48 h,小心弃去上层菌液,以pH7.0的PBS洗去沉淀物附着的浮游菌,弃去后再加入1%结晶紫200 μL染色,室温放置15 min,弃去染液,蒸馏水洗孔多次后室温干燥,每孔加入200 μL的95%乙醇,以95%乙醇作为调零组,595 nm吸光度下测定生物膜生长情况及计算抑制率[23]。

1.2.6.2 生物膜的形貌观察 将无菌玻片置于6孔板中,并向孔中加入3 mL含QSI终浓度为125、250、500 μg/mL的 TSB培养基和 10 μLL. m菌液,以不含QSI作阴性对照组,37℃静置培养48 h后,取出玻片,用pH7.0的PBS反复洗去玻片表面的浮游菌,使用1%结晶紫染色20 min,蒸馏水冲洗玻片,室温下晾干,光学显微镜观察生物膜的形貌[24]。
1.2.7 统计学分析 每个实验作3个平行,取其平均值,实验数据用x-±s 表示。采用SPSS的单因素方差分析(ANOVA)样品的显著性差异,检验水准为 α=0.05。
2 结果
2.1 L. m AI-2类群体感应抑制剂的筛选
以不含乳酸菌乙酸乙酯提取物的L. m上清液诱导BB170发光值作为100%、LB培养基为空白对照。16株乳酸菌乙酸乙酯提取物对L. mAI-2信号分子的活性均表现出一定抑制效果(图1),抑制率从36%至98.5%,其中6株菌产生的代谢产物A-3、A-4、B-1、B-4、B-5、C-3能够有效地抑制L. mAI-2的活性,与阴性对照相比,抑制率均超过了75%,可作为潜在的L. m的QSIs,尤其菌株Pediococcus pentosaceuszy-B-1的代谢产物B-1对L. mAI-2活性几乎完全抑制,活性仅保留了1.5%,将其命名QSI-B-1,并进一步研究对L. m的抑制效果。

图1 乳酸菌乙酸乙酯提取物对L. m AI-2活性的影响
2.2 QSI-B-1对L. m作用的MIC值
采用双层牛津杯扩散法对QSI-B-1进行抗菌活性测定(图2),发现500 μg/mL的QSI-B-1较明显地抑制了L. m的生长,抑菌圈18 mm;250 μg/mL的QSI-B-1可观察到较小的透明圈约10 mm,125 μg/mL与空白对照组没有完全透明的抑菌圈,因此QSI-B-1对L. m作用的 MIC值为 250 μg/mL。125、250 μg/mL的QSI-B-1的孔能观察到较为稀疏的L. m的生长圈。
2.3 QSI-B-1对L. m生长曲线的影响

图2 QSI-B-1的MIC值测定
生长曲线实验(图3)可以表明不同浓度QSI-B-1对L. m生长的影响,1 000 μg/mL的QSI-B-1完全抑制了L. m的生长;≤500 μg/mL的QSI-B-1随着浓度增大抑制作用加强,最大OD值变小说明降低最终生长浓度,这与2.2的抑菌圈结果一致。同时QSI-B-1能推迟L. m进入对数生长期的时间,并均于11 h进入生长稳定期。
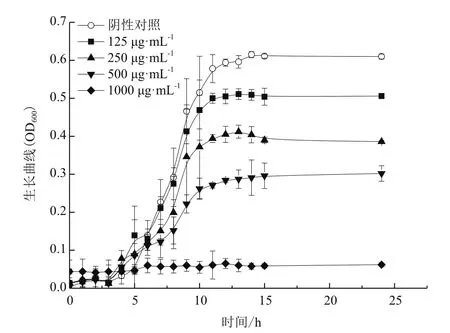
图3 不同浓度QSI-B-1作用下L. m生长曲线
2.4 QSI-B-1对L. m动力形成的影响
通过半固体穿刺培养实验发现(图4),空白对照组形成伞状生长线,边缘呈云雾状,表明L. m具有运动性;在125 μg/mL的QSI-B-1作用下L. m较空白对照组形成较细小的伞状生长线,在250 μg/mL的QSI-B-1作用下未观察到伞状生长,表明其抑制了L.m鞭毛的形成;浓度为500 μg/mL的QSI-B-1几乎有效的抑制L. m的生长。

图4 QSI-B-1对L. m动力的影响
2.5 QSI-B-1对L. m生物被膜形成的抑制
浓度为 125、250、500 μg/mL的 QSI-B-1作用L. m48 h后,生物被膜的形成量均低于阴性对照组(图5),且随着QSI-B-1浓度的增大,对生物被膜形成的抑制效果越明显,抑制率分别为89.94%、66.16%、40.85%。

图5 不同浓度QSI-B-1作用下L. m生物被膜的形成量
2.6 QSI-B-1对L. m生物被膜形貌的影响
荧光倒置显微镜观察QSI-B-1作用48 h后L. m的生物被膜的形貌发现(图6),未添加QSI-B-1的空白对照组的L. m在玻片上形成了特有的三维蘑菇状生物被膜,结构完整致密。实验组随着QSI-B-1浓度的增加,形成的生物膜结构愈加疏松,500 μg/mL组几乎不能成膜。
3 讨论

图6 不同浓度QSI-B-1对L. m生物被膜结构的影响
AI-2类群体感应抑制剂(QSIs)能够阻断细菌种间信息的交流,靶向抑制或干扰细菌QS功能的正常发挥,为开发新型食品病源菌控制剂提供了思路[25]。QSIs主要通过抑制信号分子的合成、促进信号分子的降解或阻断信号分子与受体蛋白结合3条途径来干扰细菌的QS系统[26],其中,通过抑制信号分子的活性来筛选QSIs成为研究热点。
QSIs可以通过人工合成,也可以从动植物及微生物中筛选获得[27]。乳酸菌是自然界中很重要的一类抑菌活性强且抑菌谱广的生防菌,乳酸菌在生长代谢过程中会产生很多种类的抑菌活性物质,抑制多种病原菌,是获得QSIs的重要来源,李博[28]、顾锐[29]和蔡针华[30]等从多株乳酸菌的上清液筛选QSIs,发现乳酸菌的代谢产物作为外源化合物能够明显地抑制致病菌L. m信号分子的活性,是靶向干扰 QS 正常功能的 QSI[31]。
本实验采用报告菌株哈氏弧菌BB170只对AI-2类分子发生反应并诱导其发光,且AI-2活性值的高低与发光度呈正相关[32-33],筛选得到低浓度的乳酸菌上清液的粗提物,并从生长曲线、动力、生物被膜三个方面探究其对致病菌L. m群体感应系统的抑制效果。对致病菌动力形成的抑制实质是对其鞭毛运动的抑制,是间接控制致病菌感染与致病能力的一个途径[34]。邢家溧等[35]发现溴化呋喃酮DF可以明显地抑制了荧光假单胞菌的群集运动能力,继而影响了其生物膜的形成;唐艺丹[34]等发现400 μg/mL的丝状真菌产生的丁内酯-I是铜绿假单胞菌的QSI,且能有效地抑制其运动能力,说明多种QSIs均对致病菌的动力有抑制效果。细菌生物被膜是由QS系统在信号分子的调控下菌体自发形成的菌体、胞外蛋白和多糖的混合物,其不仅使菌体易于附着在食品加工设备等固体材料的表面,使得通过清洗手段去除菌体变得困难,而且形成的保护性被膜增强了菌体对外界不良因素的抵抗性,使菌体容易逃逸药物的抑制作用,据统计超过60%的微生物感染是由细菌的生物被膜引起的[10],抑制致病菌L. m的生物膜的形成能减少其抗逆性。QSI靶向干扰目标菌的QS系统,但并不是完全杀死细菌,从而有效地抑制毒力因子的产生,避免了食品使用高剂量抑菌剂带来的耐药性[10]及人体副作用造成的危害。本研究结果表明,海洋源乳酸菌乙酸乙酯提取物作为QSIs有望成为控制L. m感染和致病性的有力武器,研究旨在通过靶向干扰QS系统的这一策略,抑制细菌生物被膜与毒力因子的形成,从而控制其致病性,为研发新型食源性致病菌抑制剂提供了理论依据。
4 结论
本研究筛选得到6株乳酸菌的乙酸乙酯提取物为良好L. mAI-2系统的QSIs,其中菌株Pediococcus pentosaceuszy-B-1乙酸乙酯提取物QSI-B-1抑制效果最好,推迟L. m进入生长期的时间并有效降低其最终生长浓度,并抑制鞭毛的运动,间接控制了L. m的感染力和致病能力。随着QSI-B-1浓度的增加,对L.m生物被膜形成量的抑制率越高,形成的生物被膜结构愈加疏松。
