组合临床国际预后指数、病理免疫分型及中期PET/CT建立的模型在弥漫大B细胞淋巴瘤预后评估中的应用
2019-05-09朱海燕李菲赵瑜王全顺王瑞民
朱海燕,李菲,赵瑜,王全顺,王瑞民
1.解放军总医院血液科,北京 100853;2.解放军总医院核医学科,北京 100853;*通讯作者 王瑞民 wrm@yeah.net
临床及病理对弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)的预后评估方法较多且相对完善、成熟,如临床上应用的国际预后指数(international prognostic index,IPI)、病理免疫组化分型及新型分子标志物,已在临床上得到认可和广泛使用[1-2]。PET/CT在DLBCL评估疗效及生存预测方面具有巨大的价值,尤其是中期PET/CT[3-4],PET/CT评估方法也逐步标准化、精细化、分级化及定量化[5-6]。如何将各种经典、新型指标整合并形成风险预测及预后评估模型尚有待探讨。本研究通过长时间随访,回顾性分析结合 IPI、免疫分型及 PET/CT预后与单一指标分析的差异,初步探讨组合式模型的应用。
1 资料与方法
1.1 研究对象 回顾性分析 2008年 9月—2014年10月解放军总医院诊治的270例DLBCL患者,年龄13~83岁,平均(51.6±16.1)岁。纳入标准:病理明确诊断为 DLBCL,且有病理免疫分型[生发中心(germinal center B-cell like,GCB)来源或非生发中心(Non-GCB)来源];患者具有IPI评分;化疗前及化疗后2个周期行18F-FDG PET/CT检查。排除标准:既往有其他肿瘤病史,化疗前PET/CT成像为阴性,随访中失访患者。本研究经医院伦理道德委员会批准,所有患者均签署知情同意书。
1.218F-FDG PET/CT成像 患者接受化疗前(初期)及化疗2个周期后(中期)行18F-FDG PET/CT检查。采用GE Discovery 710及Siemens Biograph 64 TruePoint PET/CT显像仪,患者初期显像两台设备随机扫描,复查时尽量选用与第一次同种机型。患者显像前空腹4~6 h。静脉注射18F-FDG,剂量4~5 MBq/kg,注射后60 min行躯干与脑显像,获得PET及CT图像。
1.3 病理免疫分型 基于免疫组织化学技术的细胞起源分析,根据Hans分型、免疫标志物CD10、MUM1和BCL6表达情况区分GCB及Non-GCB(图1)。
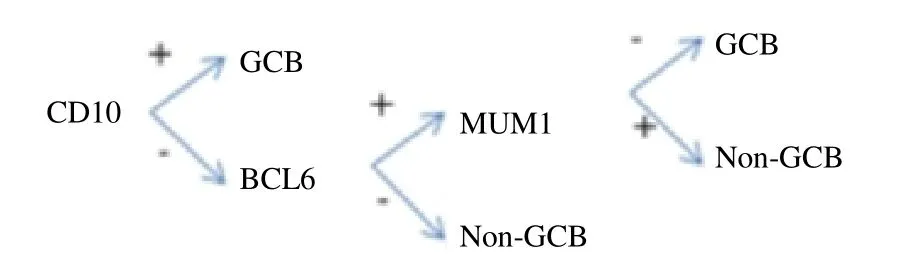
图1 DLBCL病理免疫分型(Hans法)
1.4 临床IPI评分方法 包括5项内容:年龄>60岁、乳酸脱氢酶升高、体能状态≥2分、疾病分期Ⅲ~Ⅳ期、结外浸润病变≥2个。每项1分,并根据得分分为4组,低危:0~1分;低中危:2分;中危:3分;高危:4~5分。
1.518F-FDG PET/CT图像分析 比较初期及中期2次PET/CT图像,采用5分评分法(five-point scale,5PS)及最大标准化摄取值减少率法(△SUVmax)评估2个周期化疗后效果。5PS评分标准:1分,病变无放射性摄取;2分,放射性摄取程度低于纵隔;3分,高于纵隔且低于肝脏;4分,高于肝脏;5分,显著高于肝脏和(或)出现新发病灶。
1.6 随访 采用电话和(或)住院、门诊随访,随访时间为2008年9月—2017年1月。以无进展生存率(progression free survival,PFS)及总体生存率(overall survival,OS)作为随访指标。
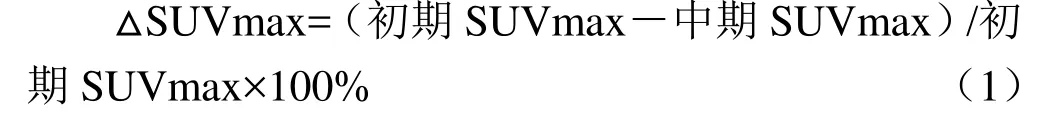
1.7 统计学方法 采用SPSS 20.0软件,采用Kaplan-Meier法和 Log-Rank检验各单一方法及组合模式与PFS、OS的关系,P<0.05表示差异有统计学意义。
2 结果
2.1 患者临床资料 270例DLBCL患者的基本资料见表1。中位随访时间46个月。随访结束时,62例死亡。

表1 270例DLBCL患者的基本资料
2.2 5PS评分与△SUVmax阈值的计算 化疗2个周期后,5PS评分1分51例,2分93例,3分38例,4分24例,5分64例。化疗结束后,以是否达到完全缓解为评估标准,△SUVmax的受试者工作特征曲线下面积为0.79(P=0.000),最佳阈值为71%(Youden指数为0.440),△SUVmax≤71%者102例,>71%者168例。
2.3 IPI、免疫分型、5PS与△SUVmax单一指标分析PFS、OS 各评估方法分别按两组进行生存分析,具体分组为:IPI评分0~2分组、3~5分组,病理GCB组、Non-GCB组,5PS法 1~3分组、4~5分组,△SUVmax>71%组、≤71%组。生存曲线PFS与OS显示各评估方法除病理GCB组与Non-GCB组PFS及OS差异无统计学意义(P>0.05)外,其余两组间差异均有统计学意义(P<0.05),见图2、3。

图2 各单一指标模型PFS生存曲线分析。A~D分别为IPI、免疫分型、5PS、△SUVmax
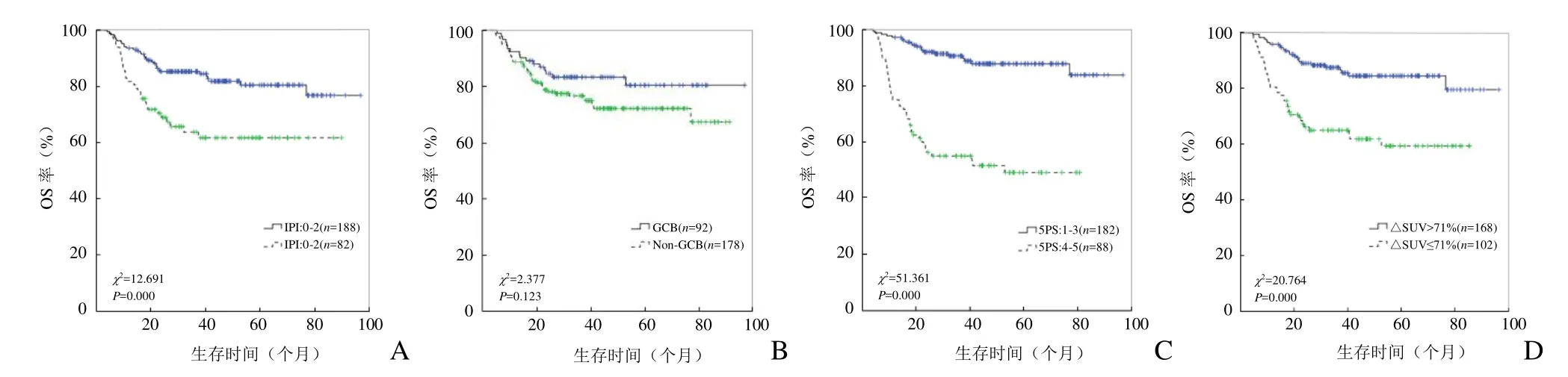
图3 各单一指标模型OS生存曲线分析。A~D分别为IPI、免疫分型、5PS、△SUVmax
2.4 组合模型分析PFS、OS 组合IPI、免疫分型、5PS与△SUVmax各指标结果建立新模型,将患者分为 3组:低风险组 32例(11.9%)为 IPI 0~2分+GCB+5PS 1~3分+△SUVmax>71%;高风险组14例(5.2%)为 IPI 3~5分+Non-GCB+5PS 4~5分+△SUVmax≤71%;中风险组224例(82.9%)为其他组合方式。生存曲线PFS与OS显示3组间差异均有统计学意义(P=0.000)。见图4。

图4 组合模型生存曲线分析。A、B分别为PFS、OS
3 讨论
DLBCL具有高度异质性,肿瘤的生物学特征、临床表现、治疗反应和预后均存在较大差异,随着高通量技术、新型检测和影像技术的发展,目前对DLBCL预后研究不断深入,越来越多的新型指标具有重要价值。关于淋巴瘤的多种评估标准均纳入PET/CT成像结果,建立了Deauville标准及后续的Lugano分类,使标准分级、定量化[7]。
PET/CT在中期评估的视觉分析方法已广泛应用于临床工作中,视觉5PS法(Deauville评分)在日常临床工作中已得到较好的应用。以肝血池放射性摄取程度为分界点,即5PS≥4分为阈值,中期PET/CT评估化疗后DLBCL及霍奇金淋巴瘤患者4~5分PFS与OS均较差,与既往研究结果一致[8]。△SUVmax法是一种半定量分析方法,可以为临床及科研提供数值定量指标进行统计分析。多数研究取SUV下降约2/3(即66%[3])为预后评估阈值,与本研究结果(71%)相近。视觉与半定量分析方法在中期预后评估中均具有重要作用,本研究结果显示,5PS及△SUVmax评估方法均对患者的PFS及OS具有显著意义,印证了两种方法的客观性及实用性。5PS较△SUVmax方法更具有临床实用性,由于DLBCL为高度亲和FDG的淋巴瘤类型,5PS方法评估可以不依赖治疗前的成像结果,而△SUVmax方法必须完成治疗前后两次成像检查。
IPI评分仍是判断非霍奇金淋巴瘤,尤其是DLBCL预后的公认临床指标。随着利妥昔单抗治疗时代的到来,IPI也得到不断完善,如改良版(R-IPI)、年龄相关版(aa-IPI)、NCCN 数据库版(NCCN-IPI),能更好地用于评估不同化疗方案的DLBCL患者的预后[9]。本研究中,IPI低分组(0~2分)与高分组(3~5分)PFS、OS均具有显著差异,与既往研究结论一致,提示IPI在预后评估中具有重要价值。GCB患者组的预后理论上优于Non-GCB组,但既往研究发现两组生存率无显著差异[10],与本研究结果相同,其原因可能与基于免疫组化技术的Hans分型的局限性有关,随着基因表达谱技术对细胞来源进行分类及新型基因检测、双(三)基因重排等,分子生物学指标也推动着诊疗及预后的不断细化[11]。
影像、临床及病理预后指标具有各自的优越性及局限性,多学科参数的整合应用是本研究探索的目的。选择各自专业中较有代表性的指标,按危险度分层分为高、中、低度,即3种专业中均为阳性预后差指标者为高度风险,均为阴性指标者为低度风险,其余为中度风险。研究结果显示,组合模型中高度与低度风险患者的PFS与OS曲线差异显著,利于检出风险度更高的患者群,以制订分层治疗计划,达到精准治疗的目的。既往临床分层治疗多根据免疫学、分子生物学的危险因素及对化疗的敏感性采用不同强度的化疗方案,随着 PET/CT技术标准的不断完善,PET/CT结果尤其是中期PET/CT评估也应作为分层治疗的参考因素之一[12],既往研究表明初期SUV与IPI结合可以指导患者的危险度分层[13]。PET/CT指标除SUV值外,糖酵解总量、肿瘤代谢体积等也是实用的定量指标[12],可以筛选出危险事件发生率较高的患者[14]。本研究组合模型中免疫分型指标统计学意义虽不明确,但DLBCL的异质性却与不同分子亚型及特殊分子表达密切相关,应用荧光原位杂交检测部分特殊基因,如MYC、Bcl-2及Bcl-6双(三)基因表达(打击)等代替免疫分型指标应用于组合模型中是未来研究的方向。
总之,基于临床+病理+影像的组合模型评估DLBCL患者的预后已成为临床工作者的研究方向,筛选各自专业中有价值的指标建立的预后模型将为临床个体化、精准化治疗提供依据,并为以基因、分子为靶点的新型治疗药物提供评价平台。
