胰腺病变18F-FDG PET/CT与MRI的对照研究
2019-05-09王瑞民何婷婷关志伟孙亚兵徐白萱
王瑞民,何婷婷,关志伟,孙亚兵,徐白萱
1.解放军总医院核医学科,北京 100853;2.解放军总医院海南分院核医学科,海南三亚 572000;*通讯作者 王瑞民wrm@yeah.net
随着正电子发射型计算机断层成像(PET/CT)在肿瘤中的广泛应用,胰腺PET/CT为临床医师尤其是外科医师提供了疾病的定性诊断、胰腺占位术前评估、术后监测等信息,为患者选择切实有效的治疗方案增加了保障[1]。目前研究报道的胰腺PET/CT应用研究的局限性包括:单中心样本量有限;主要与 CT成像进行对比研究;定性诊断部分病例通过随诊确认,无病理学依据[2]。本研究回顾性分析152例胰腺病变患者,均行PET/CT及MRI检查,且均通过手术或穿刺方式有明确的病理诊断,可为临床提供一定的胰腺PET/CT成像参考经验。
1 资料与方法
1.1 研究对象 收集2016年5月—2017年11月解放军总医院PET/CT中心检查的152例胰腺疾病患者,男84例,女68例;年龄15~81岁,平均(57.2±12.3)岁。手术切除病理130例,术中活检17例,超声引导下穿刺5例,病理诊断结果:恶性106例,其中导管腺癌89例、神经内分泌癌(G3)2例、平滑肌肉瘤1例、淋巴瘤1例、腺泡细胞癌2例、实性假乳头状肿瘤11例;良性46例,其中囊腺瘤15例、导管内乳头状黏液性肿瘤6例、神经内分泌肿瘤(G1、G2)9例、慢性胰腺炎13例、副脾1例、假性囊肿2例。正电子放射性药物使用经医院伦理道德委员会批准[(2007)临审第029号],所有患者均签署知情同意书。纳入标准:经手术切除或术中(或超声引导下)穿刺活检有明确的病理诊断结果;术前行PET/CT及MRI检查,且 2种检查时间间隔<1周。排除标准:PET/CT及MRI检查前行相关治疗或行经内镜逆行胰胆管造影术等有创检查。
1.2 PET/CT成像 采用 GE Discovery 710及Siemens Biograph 64 TruePoint PET/CT显像仪(患者随机两台设备扫描)。所有患者术前行氟18标记的脱氧葡萄糖(18F-FDG)PET/CT腹部(或躯干)显像检查。显像前空腹4~5 h。18F-FDG静脉注射剂量为4~5 MBq/kg,注射后60 min行PET/CT显像,扫描范围由膈顶至膀胱(个别应患者要求行躯干即颈部至股骨上段扫描)。CT扫描(管电压120 kV,管电流110 mA)进行衰减校正,PET发射扫描采集2 min/床位,图像重建后以冠状位、矢状位和轴位断面显示。
1.3 MRI检查 采用GE Signa HDxt 3.0T显像仪,用体部线圈,序列包括T2WI呼吸触发脂肪抑制FSE序列,屏气的双回波扰相梯度回波T1WI,单次激发自旋平面回波DWI序列(b值分别取0、800 s/mm2),以及多时相动态增强扫描(屏气脂肪抑制的肝脏快速容积采集),对比剂使用钆喷替酸葡甲胺注射液,采用高压注射器团注,剂量0.1 mmol/kg,注射速度1.5 ml/s。
1.4 PET/CT及 MRI图像分析 由高年资主治医师级别以上的核医学、放射学医师各2名对每例患者的图像进行分析。结合患者临床资料及医师经验,PET/CT鉴别恶性病变依据主要包括胰腺部位结节状放射性浓聚,浓聚程度高于正常胰腺组织;相应 CT图像可见低密度影;显示淋巴结或远隔部位转移病变。感兴趣区法勾画患者胰腺病变部位最大标准化摄取值(SUVmax),感兴趣区范围为直径约1~1.5 cm的圆形或椭圆形区域,如病变放射性浓聚不显著,选取CT所定位部位测量。测量病灶长径时应以CT所示范围为主,结合PET所示放射性浓聚范围测量。
MRI判别恶性病变依据主要包括胰腺内乏血供肿块;伴发胰、胆管扩张;周围结构受侵;淋巴结及远处转移。测量大小以T1WI增强序列为主。
1.5 统计学方法 采用SPSS 20.0软件,2种成像方法的敏感度、特异度、阳性预测值、阴性预测值及准确度比较采用χ2检验,与病理诊断的一致性采用Kappa检验。采用受试者工作特征(ROC)曲线计算SUVmax鉴别诊断良、恶性病变的最佳阈值。采用独立样本t检验分别比较病理与PET/CT、病理与MRI测量病变长径的均值差异,两种成像方法与病理的相关性采用Pearson相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 PET/CT与MRI鉴别诊断良、恶性病变的效能PET/CT的诊断敏感度、特异度、阳性预测值、阴性预测值及准确度分别为 92.5%(97/106)、63.0%(29/46)、85.1%(97/114)、76.3%(29/38)、82.9%(126/152),PET/CT鉴别良、恶性病变与病理结果具有较高的一致性(Kappa=0.574,P<0.001)。MRI的诊断敏感度、特异度、阳性预测值、阴性预测值及准确度分别为85.8%(91/106)、73.9%(34/46)、88.3%(91/103)、69.4%(34/49)、82.2%(125/152),MRI与病理结果具有较高的一致性(Kappa=0.587,P<0.001)。
2.2 SUVmax良、恶性病变的平均值及鉴别的最佳阈值 良性病变SUVmax为3.67±3.90(0.1~18.7),恶性病变为7.47±4.34(2.1~29.2),两者差异有统计学意义(t=5.109,P<0.001)(图1、2)。SUVmax鉴别诊断ROC曲线下面积为0.821(P<0.01),根据ROC曲线计算 SUVmax最佳阈值为 3.25,约登指数最大0.558(图3)。
2.3 PET/CT及MRI测量病变长径的准确性 PET/CT、MRI及病理(或手术)测量147例病变(5例为慢性炎性,无明确影像学或病理范围)长径的平均值分别为(3.98±2.49)cm、(4.15±2.79)cm和(4.33±2.86)cm,PET/CT与病理结果(t=-1.121,P=0.263)、MRI与病理结果(t=-0.526,P=0.599)比较,差异均无统计学意义。PET/CT测量所得病灶长径与手术病理结果(r=0.898,P=0.001)、MRI结果与病理结果(r=0.948,P=0.023)均呈正相关。
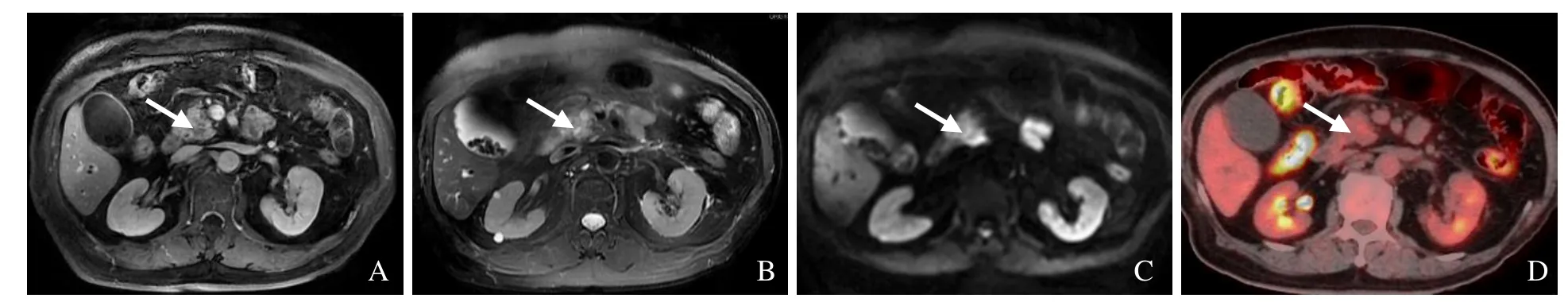
图1 男,74岁,胰腺中-低分化导管腺癌。胰头钩突区稍长T1信号,门静脉期及延迟期轻度进行性强化(A);胰头钩突区稍长T2信号(B);DWI呈晕环状高信号(C);胰头部结节,放射性摄取轻度增高,SUVmax为2.4(D),箭示病灶
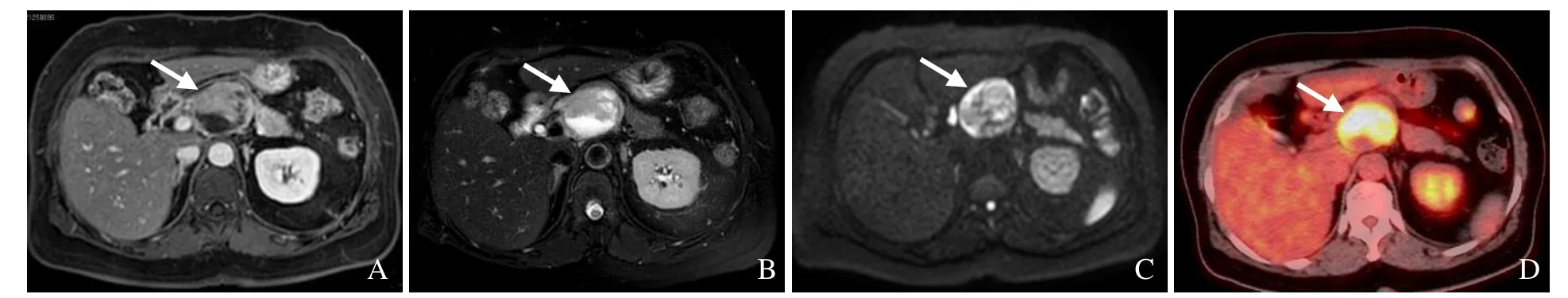
图2 女,54岁,胰腺神经内分泌肿瘤,G2级。胰颈体交界区稍短和稍长T1异常信号肿块,可见分层和假包膜,持续强化,病灶内部分区域未见强化(A);胰颈体交界区长和短T2异常信号(B);DWI病灶呈晕环、结节状高信号(C);胰颈体交界区前方见囊-实性软组织占位,放射性摄取环形浓聚,SUVmax为18.7(D),箭示病灶
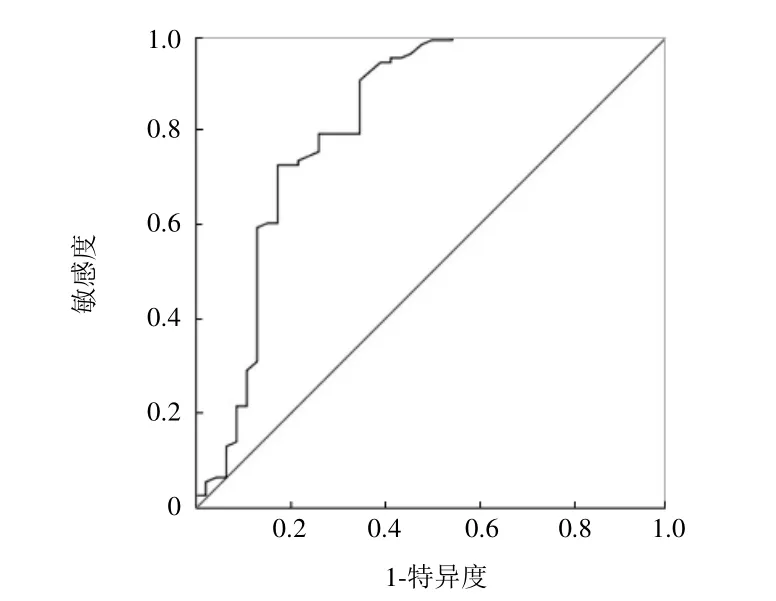
图3 SUVmax鉴别诊断胰腺良、恶性病变的ROC曲线
3 讨论
CT及MRI对胰腺良、恶性病变的鉴别诊断已在临床上广泛应用,尤其是 MRI在诊断少见病变中由于多参数多序列扫描具有更显著的优势。既往研究报道,FDG PET/CT成像作为功能代谢与解剖结构同机融合的分子影像学技术在胰腺肿瘤分期、手术可切除性及患者预后等方面具有重要的评估作用,而在良、恶性病变的鉴别诊断方面作用有限[3-4]。但FDG摄取与病变定性存在一定的联系[5],因此,本研究主要分析胰腺 SUVmax与病理明确的病变之间的关系及其诊断效能。
既往研究分析了PET/CT的诊断效能,数值差别范围较大,敏感度为72%~96%,特异度为33%~94%,阳性预测值为80%~98%,阴性预测值为25%~89%,准确度为64%~95%[6-8],本研究结果较其他多数研究报道的敏感度略高(92.5%)、特异度略低(63.0%),可能与纳入患者类别有关,因本研究患者入组基本标准为获得明确病理,而考虑手术治疗的患者多高度疑为肿瘤,故患者群体有一定的偏倚性。此外,既往文献多研究胰腺癌的诊断准确性,本研究针对胰腺病变种类较多,其中神经内分泌肿瘤(neuroendocrine neoplasm,NEN)、实性假乳头状肿瘤(solid pseudopapillary neoplasm,SPN)性质具有交界性,由其生物学行为判别良恶性,本研究根据2010年WHO分类[9]将NEN分为神经内分泌瘤(G1和G2)和神经内分泌癌(G3)。而纳入的实性假乳头状肿瘤尽管术前均未发现转移,但其病理上属于低度恶性肿瘤性病变。目前关于PET/CT与MRI的对比研究基本报道PET/CT较MRI具有更高的敏感度和特异度[10-11],即使在胰腺囊性病变良恶性鉴别中[12],PET/CT可以发现癌变新陈代谢过程的起始阶段。与其他肿瘤显像相似,FDG PET/CT不可避免地会出现由于炎症、肉芽肿等的假阳性[13],这也是造成PET/CT特异度较低的原因。MRI增强扫描的优势在于显示病变与正常胰腺组织之间的信号差别,特别是病变中含出血、囊变等及胰腺周围血管受侵情况。
PET/CT较MRI的优势之一是具有半定量测量指标SUV,尤其是SUVmax。既往部分文献报道恶性病变的SUVmax为5.1~8.6,良性为0.85~4.86[14-15]。良、恶性病变 SUVmax参考阈值也是多数研究重点关注的内容,显示良恶性阈值在2.5~3.6[8,12],本研究结果为 3.25,与上述结果相近。尽管良、恶性病变的SUVmax值差异无统计学意义,但仅凭数值判别易造成盲目性及不准确性。炎性、增生性及肉芽肿性等良性病变会出现 SUVmax较高而造成假阳性,而囊腺癌、部分高分化胰腺癌、微小肿瘤易出现假阴性。交界性肿瘤如NEN、SPN很难以SUVmax高低区分其良恶性,G1、2级的NEN及无明确转移的SPN均可以出现较高的SUVmax。因此,除肿块型炎症、肉芽肿等良性病变易出现高代谢征象外,NEN、SPN也是与胰腺癌需要鉴别诊断的肿瘤性病变,仅凭 PET/CT代谢征象鉴别诊断 NEN、SPN易造成误诊。临床上可以结合肿瘤标志物、免疫指标、酶学检查等实验室检查指标与炎症、肉芽肿鉴别。而NEN、SPN等少见肿瘤需要MRI或CT等协助诊断。与胰腺正常组织相比,NEN富血供是与胰腺癌鉴别的主要证据之一。SPN除年龄、性别具有一定的特征外,影像学上出血、坏死、囊变及边缘环形或不规则钙化等特征也可以协助PET/CT与胰腺癌鉴别。由于NEN、SPN的特殊性,无法明确界定其生物学良恶性,因此SUVmax阈值计算也会产生偏移。本研究中,如拟将 G1、2级NEN归为恶性,未发现明确转移的SPN归为良性,则ROC曲线重新计算SUVmax最佳阈值为4.95,约登指数最大(0.543)。因此,应客观认识半定量指标SUVmax在诊断中的作用。
有关病变大小的影像与病理对照研究既往报道较少,本研究拟为术前评估病变提供客观依据。PET图像分辨率不及CT及MRI,而运用PET/CT测量病变大小时综合了CT与PET图像的因素,提高了准确性。本研究表明,PET/CT、MRI及手术病理测量的病变长径平均值无显著差异,且两种影像与手术病理均具有较高的相关性,故两种影像学检查测量结果真实可靠。因平扫CT依靠密度差别确定病灶范围较难,而PET放射性浓聚范围受部分容积效应影响,同时高代谢区域除肿瘤组织外也包括炎症反应性区域部分,因而测量范围会大于肿瘤实体。本研究所得数值略小于手术病理结果,可能是由于医师测量过程未仅依据PET图像,而是同时参考CT图像所致。增强MRI测量结果更加接近真实数据,体现了结构影像学的优势,也与既往研究结论一致[16],且PET/CT对胰腺病变的术前侵犯范围及可切除性的评估同样具有重要作用[17]。
总之,PET/CT与MRI相比在鉴别诊断胰腺良、恶性病变中具有较好的敏感度、阴性预测值及准确度。不应单纯依据SUVmax值判别,应结合临床指标及增强影像学特征综合评估提高诊断准确性。PET/CT与MRI测量病变大小与手术病理结果的准确性及相关性较好,为术前评估提供客观依据。相信随着融合影像技术及放射性示踪剂的发展,PET/CT将为胰腺病变的诊断、分期、手术评估及疗效监测提供重要依据。
