国产聚乙二醇化干扰素α治疗HBeAg阳性慢性乙型肝炎患者疗效研究*
2019-05-08袁春晖李春雨李红丽赵红娜王文红孟庆旭张中学
袁春晖,李春雨,李红丽,赵红娜,王文红,孟庆旭,张中学
研究发现,CHB患者肝病进展程度往往与血清HBV DNA载量相关[1,2]。因此,治疗HBV感染时应以抑制HBV持续复制为主要目的[3]。聚乙二醇化干扰素α(peg-IFN-α)具有免疫调节和抗病毒作用,疗程肯定,病毒学应答率(SVR)较高,是被推荐的HBeAg阳性CHB患者的一线治疗方案[4,5]。目前,IFN-α可分为peg-IFN-α-2a/2b两类,研究结果显示,两种干扰素对慢性丙型肝炎(CHC)治疗效果基本一致,但有报道认为peg-IFN-α-2a更具有治疗优势[6,7]。因此,我们选择了500例HBeAg阳性CHB患者为研究对象,分别采用peg-IFN-α-2b和peg-IFN-α-2a治疗,通过随访观察比较了两种IFN-α的治疗效果,现将结果报道如下。
1 资料与方法
1.1 临床资料 2015年1月~2017年12月我院和保定市传染病医院肝病科收治的HBeAg阳性CHB患者500例,男362例,女138例;年龄18~39岁,平均年龄为(28.5±10.5)岁。均符合《慢性乙型肝炎防治指南》[8](2015版)的诊断标准,纳入患者治疗前均未接受过抗病毒或胸腺素等免疫调节药物治疗。排除标准:①合并HEV、HAV、HCV和HIV等多重病毒感染者;②合并自身免疫性肝病或药物性肝损伤患者;③妊娠或哺乳期妇女;④血清HBsAg和抗-HBs同时阳性或HBeAg和抗-HBe同时阳性者;⑤肝功能衰竭或患有失代偿期肝病者。本研究经医院医学伦理委员会批准,患者签署知情同意书。
1.2 治疗方法 将患者分成两组。在A组150例患者,给予peg-IFNα-2b(厦门特宝生物工程股份有限公司,国药准字:S20160001)1~1.5 μg·kg-1皮下注射,1次/w,治疗24~48 w;在B组350例患者,给予聚乙二醇干扰素α-2a(派罗欣,上海罗氏制药有限公司,国药准字:J20040038)180μg皮下注射,1次/w,治疗24~48 w。在治疗结束后,对两组患者随访24 w。
1.3 临床检测 使用日本OLYMPUS AU2700自动生化分析仪检测血生化指标(北京康思润业生物技术有限公司);采用ELISA法定量检测血清HBeAg、抗-HBe、HBsAg(美国雅培公司),血清HBeAg为0~1 s/co即为阴性,抗-HBe>1 s/co为阳性,血清HBsAg<0.05 IU/m L为阴性,血清抗-HBs>10 mIU/m L即为阳性;采用实时荧光定量PCR法检测血清HBV DNA(上海江莱生物科技有限公司),血清HBV DNA 定量<1×103拷贝 /毫升为阴性;采用直接测序法检测HBV基因型(北京康为世纪生物科技有限公司)。
1.4 疗效考核标准 参考《指南》[8],停止治疗后,希望获得持久的血清HBsAg消失,伴或不伴HBsAg血清学转换,或获得持续病毒学应答、血清ALT复常和出现HBeAg血清学转换为完全应答。
1.5 统计学方法 应用SPSS 22.0统计软件进行数据分析,计量资料以(±s)表示,采用 t检验,计数资料采用x2检验。P<0.05被认为差异具有统计学意义。
2 结果
2.1 两组基线资料比较 两组基线病毒学、血清学和生化学资料间差异无统计学意义(P>0.05,表1)。
2.2 两组感染HBV基因型比较 两组HBV基因型比较,差异无统计学意义(P>0.05,表2)。
表1 两组CHB患者基线资料(±s)比较
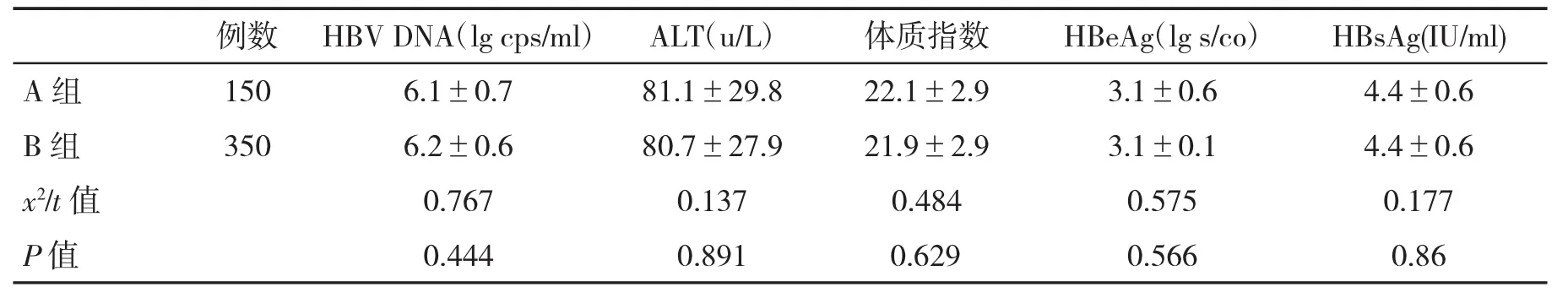
表1 两组CHB患者基线资料(±s)比较
例数 HBV DNA(lg cps/ml) ALT(u/L) 体质指数 HBeAg(lg s/co) HBsAg(IU/ml)A 组 150 6.1±0.7 81.1±29.8 22.1±2.9 3.1±0.6 4.4±0.6 B 组 350 6.2±0.6 80.7±27.9 21.9±2.9 3.1±0.1 4.4±0.6 x2/t值 0.767 0.137 0.484 0.575 0.177 P值 0.444 0.891 0.629 0.566 0.86
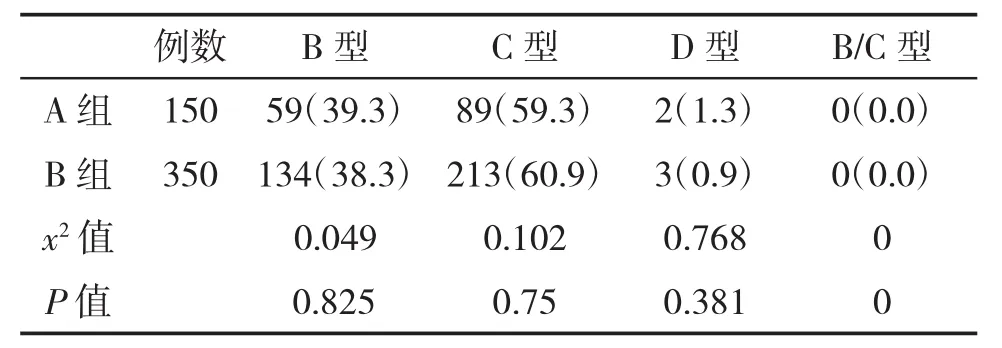
表2 两组HBV基因型分布(%)比较
2.3 两组治疗结束时和随访24周时疗效比较 在治疗结束和随访结束时,两组疗效无显著性差异(P>0.05,表3);在随访 24 周时,peg-IFN-α-2b 和peg-IFN-α-2a治疗组分别有12例(8.0%)和23例(6.6%)病情复发。
2.4 两组安全性分析 无论是注射进口还是国产干扰素后,主要的不良反应包括乏力、头痛、肌肉酸痛、脱发和血细胞减少等,但两组各种不良反应发生率并无显著差异(P>0.05,表4)。对于发生白细胞减少病例,给予粒细胞集落刺激因子注射后,完成治疗,而对个别血小板减少病例,则将干扰素剂量减半后,维持治疗至结束。

表3 两组疗效(%)比较

表4 两组主要不良反应(%)比较
3 讨论
CHB可发展为肝硬化甚至肝癌。Peg-IFN-α是目前抗病毒治疗CHB患者的一线药物。CHB患者经peg-IFN-α治疗后能获得较高的病毒学和血清免疫学应答率[9,10],对HBeAg阳性CHB患者也可获得较好的疗效。我国2015年版《慢性乙型肝炎防治指南》指出,在部分合适的CHB患者,可以选择Peg-IFN-α治疗,以尽可能地获得临床治愈的效果[8]。另外,国内[11,12]有研究表明,采用 Peg-IFN-α治疗CHB患者,可明显降低肝硬化和肝癌的发生率,起到预防肝癌的效果。目前,Peg-IFN-α可分为Peg-IFN-α-2a和 Peg-IFN-α-2b两种,其中,Peg-IFN-α-2a是聚乙二醇化干扰素,是一种长效干扰素,可与细胞表面的特异性α受体结合,即可在细胞内诱导信号传递,并激活基因的转录,起到抑制病毒复制,调节免疫功能的作用,是临床治疗CHB和慢性丙型肝炎(CHC)患者的常用药物[13]。Peg-IFN-α-2b是一种 IFN-α-2b与聚乙二醇(40kDY型)结合所得的长效干扰素,可用于治疗CHC和血清HBeAg阳性的CHB患者。国产干扰素α-2b与Peg-IFN-α-2a的抗病毒作用机制基本一致[6]。国内外在对 CHC患者的治疗研究[14,15]表明,Y型Peg-IFN-α-2b与peg-IFN-α-2a可达到相似的治疗效果,且安全性也相似。
由于peg-IFN-α治疗的疗效可能会受到多种因素的影响,如HBV DNA基因型的影响等。本研究结果显示,两组患者基线资料差异均无统计学意义(P>0.05),初步排除了其他因素对本研究治疗结果的干扰。国外研究[16,17]结果报道称,PEG-IFNα-2a和PEG-IFNα-2b治疗CHB患者,在获得SVR和不可检测的血清HBV DNA水平方面无显著性差异。本研究结果也表明,两组HBV DNA检测不到发生率间差异无统计学意义(P>0.05),验证了上述结果。有研究[18,19]报道称,Toll样受体可能参与了抑制HBV DNA复制的过程,而HBeAg可以阻止该受体的激活。因此,HBeAg的高表达可能会引起HBV DNA复制的活跃。同时,HBeAg又是HBV DNA的编码产物。因此,随着CHB患者体内HBV DNA高复制,其体内的HBeAg往往呈高表达状态。多数学者将HBeAg血清学转换作为提示CHB患者病情稳定的重要指标。本研究结果显示,peg-IFN-α-2b治疗组HBeAg血清学转换率与IFN-α-2a治疗组间差异无统计学意义(P>0.05)。国内相关研究[20]结果也表明,两种药物治疗的血清学转换率并无明显差异,与本研究结果一致。抗病毒治疗CHB患者过程中,通常是首先发生HBV DNA阴转,继而随着 HBeAg水平降低及发生血清学转换,最后才能实现血清HBsAg水平的降低和消失。应用进口Peg-IFNα持续治疗1年后,CHB患者HBsAg血清学转换率可达到11%。本研究结果显示,在随访24周末,peg-IFNα-2b治疗组HBsAg血清转换率为2.0%,而peg-IFNα-2a治疗组为1.4%,均低于既往研究结果,可能与治疗时间还不够长有关。本研究结果还显示,两组HBeAg血清学转换率均随治疗时间的延长而升高,表明Peg-IFNα类药物治疗后,其免疫学应答效应的持久性。本研究结果显示,两组不良事件主要包括乏力、头痛、肌肉酸痛和血细胞减少等,但两组不良事件发生率差异无统计学意义(P>0.05),提示两种药物治疗的安全性较为相似。
虽然Peg-IFNα治疗可提高CHB患者病毒学和生化学应答率,但迄今为止,还缺乏彻底治愈CHB患者的方法。越来越多的研究开始尝试研制新型药物治疗CHB患者,包括靶向HBV感染的特效药物及各种免疫调节剂等,并开始研究采用新型的治疗方案如Peg-IFNα与其他免疫调节剂(如HBV疫苗)联合的治疗方案,以期能够早日实现临床治愈CHB患者。
