一例猪附红细胞体病的实验室诊断
2019-05-07张喜懿温贵兰张升波李昌红
张喜懿,温贵兰,张升波,李昌红,徐 丽,田 浪,
杨佰启,陈 广,程振涛,王开功,周碧君,文 明
(贵州大学动物科学学院预防兽医学实验室,贵州 贵阳 520025)
附红细胞体病(Eperythrozoonosis)是由附红细胞体(Eperythrozoon)引起的以溶血性贫血、黄疸、发热为主要特征的人兽共患传染病,又称红皮病、黄疸性贫血、类边虫病、赤兽体病[1,2]。 1932 年,Doyle[3]首次报道了猪附红细胞体病,认为其病原体属于类立克氏体科,直到国际系统原核生物学委员会和2005年版《伯杰氏系统细菌学手册》将其从立克次体科划入支原体科,附红细胞体的生物学地位才确定下来[4]。在我国,附红细胞体病已经有了几十年的流行史,该病多发于夏秋季节,易造成流行,且寄主范围广,涉及猪、牛、羊等多种动物[5]。
贵州省长顺县某养殖场存栏生猪135头,平均日龄40 d,体重约30 kg,为长白猪与大约克猪的杂交品种。2018年12月5日开始发病,至12日病死猪达100头,死亡率高达74.07%。发病猪除消瘦和被毛粗乱外无其他明显症状,剖检病死猪未发现典型病理变化。场主曾使用兽用非处方药“日超三斤”治疗,未见疗效。本实验室随机无菌采集5头发病猪的血液进行检测诊断,以确定该场猪群发病死亡的原因,为预防和治疗提供参考依据。
1 材料与方法
1.1 检测病料无菌采集5头发病猪的血液。
1.2 主要试剂革兰氏染色液,购自杭州微生物试剂有限公司;姬姆萨染色液,购自北京索莱宝科技有限公司;基因组RNA快速抽提试剂盒,购自生工生物工程(上海)股份有限公司;DL 2 000 DNA Marker,购自宝生物工程(大连)有限公司;基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;HiFi-Script cDNA第一链合成试剂盒,购自康为世纪生物科技有限公司;猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、猪瘟病毒(CSFV)、乙型脑炎病毒(JEV)引物,来源于贵州大学预防兽医学实验室。
1.3 细菌分离培养在超净工作台中,用灭菌接种环蘸取适量血液样本,均匀涂布于普通琼脂培养基和鲜血营养琼脂培养基上,接种后的培养基于37℃培养箱中倒置培养16~24 h,观察菌落生长情况。
1.4 病毒核酸检测
1.4.1病毒核酸提取:按照生工生物工程(上海)股份有限公司生产的基因组RNA快速抽提试剂盒说明书进行总RNA的提取,按照天根生化科技有限公司生产的基因组DNA提取试剂盒说明书进行总DNA的提取。
1.4.2cDNA的合成:将提取的病毒总RNA根据北京康为世纪公司生产的HiFi-Script cDNA第一链合成试剂盒进行反转录,反应总体系设为 20 μL,其中:dNTP Mix、2.5 mmol/L Each 4 μL,Primer Mix 2 μL, RNA Template 2 μL, 5xRT.Buffer 4 μL,0.1 mmol/L DTT 2 μL, HiFiScript(200 U/μL)1 μL,RNase-Free water 5 μL。 加样完成后充分混匀,于42℃水浴锅中孵育50 min,85℃水浴锅中孵育5 min,再于小型离心机上4 000 r/min离心10 s,置于冰上冷却即反转录成cDNA,保存于4℃冰箱中备用。
1.4.3PCR扩增:将4对引物分为2组,分别对核酸样本进行PCR扩增,PCV2特异性引物为第1组,CSFV、JEV、PRRSV 3对特异性引物为第2组。反应总体系设为20 μL,其中:上游引物(Forward Primer,F)0.5 μL,下游引物(Reverse Primer,R)0.5 μL,cDNA 2.0 μL,Taq酶 10.0 μL,ddH2O 7.0 μL,加样完成后立即进行PCR扩增。第1组引物PCR扩增程序:94 ℃ 2 min;94 ℃ 30 s,57 ℃ 40 s,72 ℃ 80 s,共35次循环;72℃再延伸10 min,PCV2特异性引物的预期扩增片段大小为1 767 bp。第2组引物PCR扩增程序:95℃ 5 min;95℃ 1 min,54℃ 45 s,72℃ 2 min,共 35次循环;72℃再延伸 10 min,CSFV、JEV、PRRSV 3对特异性引物的预期扩增片段大小分别为 504、271、372 bp。
1.4.4PCR产物凝胶电泳:将所得的PCR产物于1.2%琼脂糖凝胶上电泳,电泳后的凝胶块放入凝胶成像仪中,分析结果并拍照保存。
1.5 血涂片检查
1.5.1革兰氏染色镜检:血涂片革兰氏染色,用显微镜进行检查。
1.5.2姬姆萨染色镜检:(1)常规方法制备血涂片,待血膜干后,用甲醇固定2~3 min。(2)将血涂片置于染色架上,滴加稀释好的姬姆萨染色液,使其覆盖整个血膜,室温染色15~30 min。(3)用蒸馏水缓慢从玻片一端冲洗,自然风干后镜检。
2 结果
2.1 细菌分离培养结果接种血液后的普通琼脂培养基和鲜血营养琼脂培养基经37℃培养16 h后,未发现菌落生长。
2.2 病毒核酸检测结果使用PCV2、CSFV、JEV、PRRSV特异引物对核酸样本进行PCR扩增,将所得PCR产物于1.2%琼脂糖凝胶上电泳,均未出现预期扩增条带,4种病毒检测均为阴性。见图1。

图1 4种病毒核酸PCR扩增检测结果
2.3 血涂片检查结果
2.3.1革兰氏染色镜检结果:血涂片革兰氏染色镜检未观察到细菌。
2.3.2姬姆萨染色镜检结果:5头发病猪血涂片姬姆萨染色镜检结果见图2~图6。可见视野中的大部分红细胞出现明显变形,失去其原有的双凹形和表面光滑的形态,边缘不整齐,呈星芒状、锯齿状、刺球状等不规则形状;附着在红细胞表面的病原体被染成具有折光性的蓝紫色不规则颗粒,油镜观察其中间明亮,外周不规则,鉴定为附红细胞体。
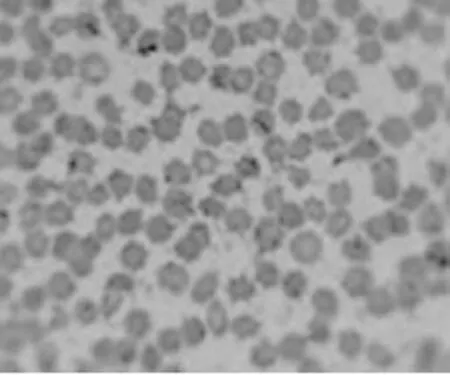
图2 1号血液样本姬姆萨染色镜检(10×100倍)
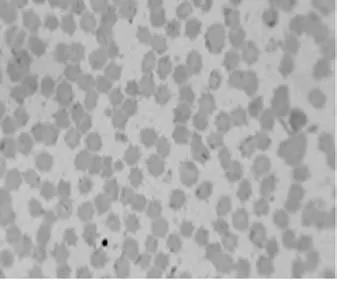
图3 2号血液样本姬母萨染色镜检(10×100倍)
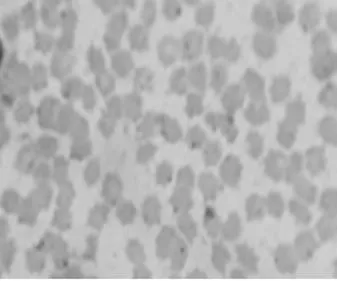
图4 3号血液样本姬姆萨染色镜检(10×100倍)

图5 4号血液样本姬姆萨染色镜检(10×100倍)
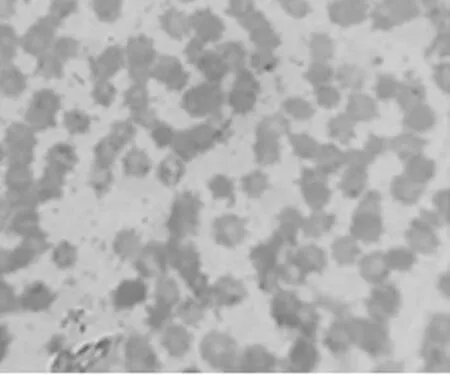
图6 5号血液样本姬姆萨染色镜检(10×100倍)
3 结论与讨论
3.1本试验对采集的5头发病猪血液样本进行细菌分离培养、病毒核酸检测和血涂片检查,确诊该场发病猪群为附红细胞体感染。
3.2附红细胞体是一类结构简单的单细胞类嗜红细胞性微生物,隶属于嗜血支原体科、支原体属[6]。该病一年四季均可发生,但多见于夏秋季节,可水平传播和垂直传播,主要通过吸血昆虫和节肢动物传播[2,7]。饲养管理条件不当、温度突然变化、猪群体质弱等因素也会加重病情,导致疫情蔓延,加剧经济损失[8]。本病例中的养殖场为半封闭建设,圈舍环境卫生差,给附红细胞体的滋生和传播创造了条件;此外,该场猪之间有相互撕咬的情况,也是造成附红细胞体在猪群之间传播和流行的因素。
3.3附红细胞体病的诊断方法较多,血液涂片检查是最常见的诊断方法,包括鲜血压片法和血涂片染色法,前者是最直接、最简单的诊断方法,但容易出现假阳性结果,导致误判,一般作为辅助方法[9];后者包括姬姆萨染色法、瑞氏染色法、瑞氏-姬姆萨混染法及吖啶橙染色法,瑞氏-姬姆萨混染法效果最好。此外还有补体结合试验、荧光抗体试验、间接血凝试验和酶联免疫吸附试验,其中酶联免疫吸附试验是最敏感且最快速的诊断方法,但该方法受检测抗原纯度的影响可能会出现假阴性结果,一般用于流行病学普查[11]。分子生物学诊断技术也是一种重要的诊断方法,临床上最常用的是PCR技术,具有较高的特异性和敏感性[12]。尽管目前附红细胞体病的诊断方法多种多样,然而因动物感染附红细胞体后常表现为一过性,给该病的诊断带来了一定的困难[13],至今仍没有一种集灵敏度高、特异性强、简单快捷于一体的诊断方法可供临床使用。
3.4治疗本病可用贝尼尔(血虫净)、大环内酯类抗生素,目前尚无疫苗可供使用。本病例中畜主曾使用非处方兽药“日超三斤”治疗,未见疗效,该药主要成分为抗菌肽素、乳酸菌、酵母菌等,主要起催肥促生长作用,对附红细胞体这类嗜血支原体疾病并无作用。由于畜主没有在第1时间咨询兽医人员确诊并使用正确的治疗药物,错过了最佳治疗时机,延误了病情,导致猪群的高发病率和死亡率,造成了严重的经济损失。
