猪场副猪嗜血杆菌的分离鉴定及药敏试验
2019-05-07史开志
张 静,史开志,王 婧,张 雄
(贵州省农业科学院畜牧兽医研究所,贵州 贵阳 550005)
副猪嗜血杆菌(Haemophilus parasuis,Hps)是1种革兰氏阴性、具有多种不同形态的条件性致病菌,会引起纤维素性多发性浆膜炎、关节炎、脑膜炎、心包炎为主要病理特征的疾病[1]。主要引起2周龄到4月龄的猪发病,严重时病死率可达50%[2]。近年来,贵州省生猪产业快速发展,养殖规模日益扩大,与此同时猪场内各种免疫抑制性疾病情况日趋复杂,猪场单独感染或继发感染副猪嗜血杆较为普遍,造成的经济损失也越发严重。副猪嗜血杆菌有15种血清型,各血清型之间的致病力存在极大的差异,其中血清1型、5型、10型、12型、13型和14型具有高致病性,通常在感染4天后发病或死亡。我国的猪群中广泛存在且流行的血清型主要是血清4型、5型、12型和13型为主[3]。鉴于副猪嗜血杆菌生长条件严苛,且传统方法无法完全区分副猪嗜血杆菌的血清型[4],Olvera A等[5]从细菌16S rRNA的种属特性出发,设计了副猪嗜血杆菌16S rRNA基因特异性引物,扩增得到822 bp特异片段,经过序列分析可针对性地鉴定副猪嗜血杆菌,且可通过酶切将不同血清型的副猪嗜血杆菌分为不同的基因型。综合传统培养特性和16S rRNA序列特性对副猪嗜血杆菌临床分离株进行鉴定和分型,能有效克服传统方法对副猪嗜血杆菌分型鉴定存在的困难。
2018年9月初,贵阳市花溪区麦坪镇某猪场陆续发生疫病,病猪临床表现为发热、呼吸困难、跛行等症状;剖检病理变化主要为肺实质性病变,心包内充满积液,胸腹腔有纤维素性渗出,胸腔积水,关节肿大,关节腔内积液。为确诊和控制疫情,本实验对送检的病料进行细菌分离培养,并对分离菌株进行鉴定和药敏试验,现报道如下。
1 材料与方法
1.1 材料
1.1.1病料来源:发病猪场送检的2头疑似感染副猪嗜血杆菌病猪。
1.1.2主要试剂:(1)营养琼脂、酵母粉、NaCl、蛋白胨、牛肉浸膏、新生牛血清、NAD、革兰氏染色试剂,购自北京索莱宝科技有限公司。(2)细菌生化鉴定管和药敏纸片,购自杭州滨和微生物试剂有限公司和杭州微生物试剂有限公司。(3)2×EsTaqMasterMix(Dye),购自北京康为世纪生物科技有限公司。(4)DNAiso plus、DL-2 000 DNA Marker,购自TaKaRa生物公司。
1.1.3培养基:(1)副猪嗜血杆菌固体培养基:营养琼脂3.3 g,酵母粉1 g,溶于超纯水 90 mL中,调节pH值至7.3~7.4,121℃灭菌 25 min,冷却至 50℃左右,加入NAD 1 mL和新牛血清10 mL,倒入平皿,凝固后倒置于37℃培养箱中过夜无杂菌生长,4℃保存备用。(2)副猪嗜血杆菌液体培养基:NaCl 1 g,蛋白胨 1 g,酵母粉 0.5 g,牛肉浸膏 1 g,加入蒸馏水90 mL,调节pH值至7.3~7.4,121℃灭菌25 min,冷却至室温,加入NAD 1 mL和新牛血清10 mL,4℃保存备用。
1.2 方法
1.2.1细菌分离培养及涂片镜检:无菌条件下,取发病猪的肺脏分别接种于液体培养基和固体培养基上,置于体积分数5%CO2培养箱,37℃培养24~48 h,观察菌落生长状况和形态,挑取菌落进行纯培养,革兰氏染色,显微镜下观察细菌形态。
1.2.2生化试验:将分离细菌纯培养物分别接种于添加1 μg/mL NAD的葡萄糖、蔗糖、半乳糖、麦芽糖、甘露醇等微量生化鉴定管,置体积分数5%CO2培养箱,37℃培养24 h,观察生化反应结果。
1.2.3PCR扩增及测序:提取菌液DNA为模板,应用Olvera A等[5]设计的16S rRNA序列引物(F:5’-GTGATGAGGAAGGGTGGTGT-3’,R:5’-GGCT TCGTCACCCTCTGT-3’)对目的基因进行 PCR扩增,预扩增片段大小为822 bp。(1)PCR扩增体系25 μL:2×EsTaqMasterMix(Dye)12.5 μL,1 μmol/L上游引物 1 μL,1 μmol/L 下游引物 1 μL,模板 DNA 2 μL,无菌水补齐至 25 μL。 (2)PCR 反应程序:94℃预变性2 min;94℃变性30 s,59℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸2 min,4℃冷却2 min。取PCR产物6 μL于1.5%琼脂糖凝胶电泳观察。PCR产物送至上海生工生物工程技术服务有限公司测序。
1.2.416S rRNA基因同源性比较与系统进化分析:运用DNAStar软件,将分离菌株与NCBI上15种血清型副猪嗜血杆菌参考株16S rRNA基因的核酸序列进行同源性分析,并构建系统进化树。
1.2.5药敏试验:无菌条件下,取处于对数增长期的菌液100 μL于固体培养基上,用无菌涂布器将菌液均匀涂满整个平皿,然后用灭菌镊子夹取13种药敏纸片放在适当的位置,轻轻按压固定。晾干后倒置于体积分数5%CO2培养箱,37℃培养24 h,观察结果,测定抑菌环的大小,判断药物敏感性。
2 结果与分析
2.1 分离细菌形态学特征分离菌在固体培养基上生长,肉眼可观察到针尖大小、无色透明的菌落(见图1)。挑取单个菌落涂片进行革兰氏染色,镜检为革兰氏阴性菌,呈短杆状、长线状等多种形态(见图2)。
2.2 生化试验结果对纯化细菌进行生化试验,结果显示该菌株各项生化鉴定结果符合副猪嗜血杆菌标准菌株的特征[6]。见表1。
图1 分离菌菌落形态
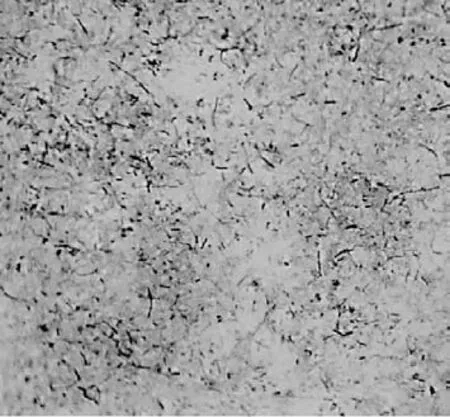
图2 分离菌革兰氏染色镜检(10×100)

表1 分离菌株生化鉴定结果
2.3PCR 扩增及测序结果为进一步确定该菌,以该分离菌株DNA为模板,利用副猪嗜血杆菌16S rRNA引物成功扩增出长度约为822 bp的基因片段,得到与预期目的片段大小相一致的扩增产物(见图3),确定为副猪嗜血杆菌(命名为:GZ_MP_HPS001)。PCR产物测序结果见图4。
2.4 16S rRNA基因同源性比较与系统进化分析结果
2.4.116S rRNA基因同源性比较分析:将GZ_MP_HPS001的16S rRNA基因核苷酸序列与其他参考菌株进行同源性比对,结果见图5。GZ_MP_H PS001与参考菌株的16S rRNA核苷酸序列同源,且相似性为97.4%~100%;与血清5型参考菌株的核苷酸序列相似性高达100%。
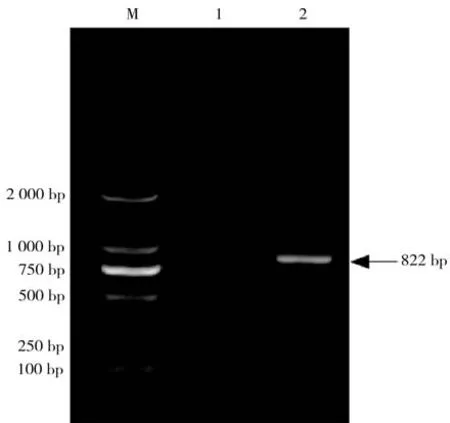
图3 分离菌16S rRNA基因PCR扩增结果

图4 分离菌(GZ_MP_HPS001)16S rRNA序列
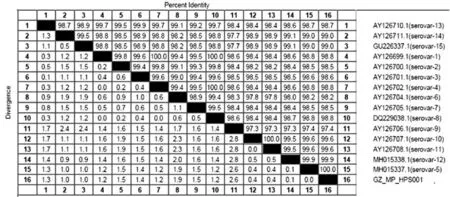
图5 GZ_MP_HPS001与参考菌株同源性比对结果
2.4.216S rRNA基因系统进化分析:应用DNAStar软件ClustaW算法对GZ_MP_HPS001分离株16S rRNA基因核苷酸序列及参考菌株绘制系统发育进化树,结果GZ_MP_HPS001与血清5型Hps参考株属于同一分支。见图6。
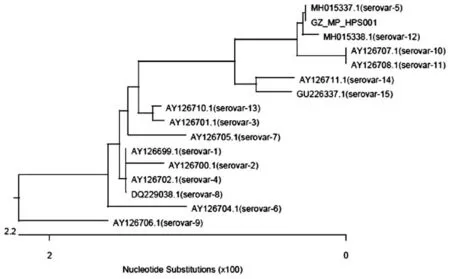
图6 基于Hps 16S rRNA基因核苷酸序列的系统进化树
2.5 药敏试验结果选择13种药敏纸片对该菌进行药敏试验,结果分离菌株对利福平、头孢氨苄、阿米卡星、环丙沙星、万古霉素敏感,对阿莫西林、林可霉素、链霉素、多西环素、红霉素、青霉素、庆大霉素耐药(见表2)。该猪场可选择利福平、头孢氨苄等5种敏感药物对病猪进行治疗。
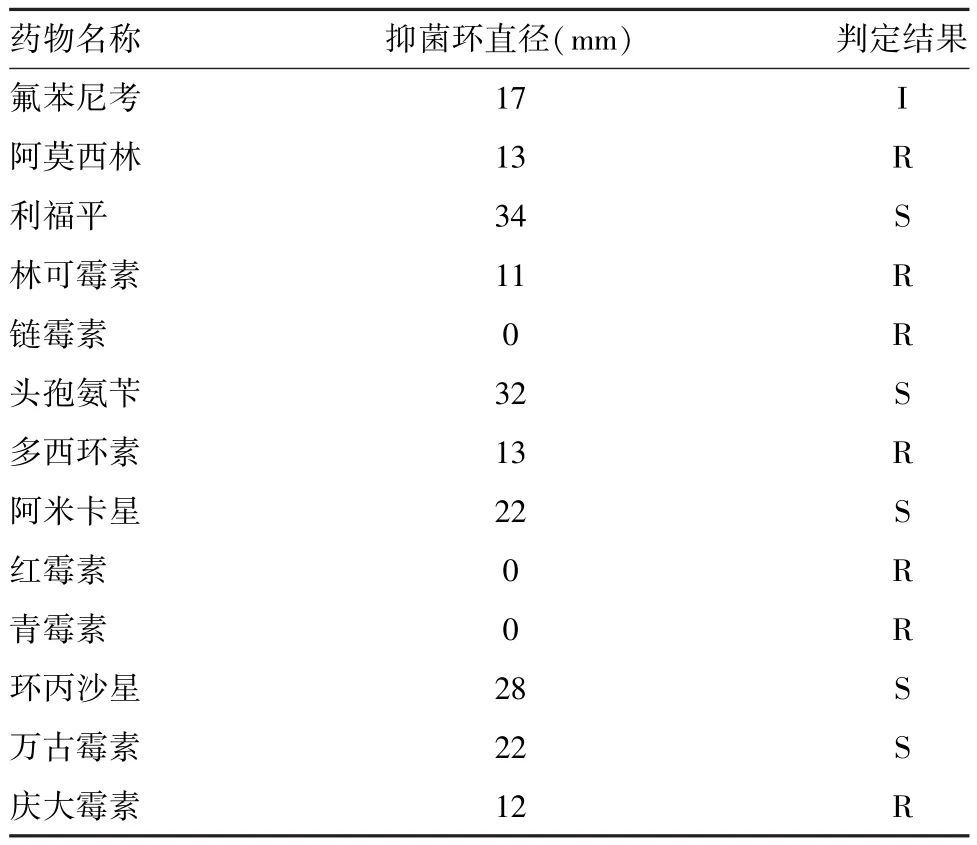
表2 副猪嗜血杆菌分离株药敏试验结果
3 结论与讨论
3.1根据对猪场送检病料进行细菌分离培养、染色镜检、生化试验、PCR扩增及测序,综合鉴定分离菌为副猪嗜血杆菌(命名为:GZ_MP_HPS001),确诊该猪场发病原因为副猪嗜血杆菌感染所致。分离菌株与1~15型参考菌株的核苷酸序列同源性为97.4%~100%,其中与血清5型副猪嗜血杆菌序列同源性高达100%;系统进化树分析显示,该菌株与血清5型副猪嗜血杆菌聚到1个分支上,说明该菌株与血清5型副猪嗜血杆菌的亲缘关系最近,表明从该场分离得到的菌株为血清5型副猪嗜血杆菌。这符合中国流行的副猪嗜血杆菌血清型为4型和5型的情况[7~9],也说明副猪嗜血杆菌的血清型与基因型存在一致性。
3.2副猪嗜血杆菌5型属于目前国内流行的血清型之一。临床上感染该血清型的猪在4天内发病或者死亡。相关感染试验表明,气管或腹腔感染副猪嗜血杆菌的猪常因急性败血症在接种1~2 d后出现死亡[10~13]。该猪场出现的疫情与感染血清5型副猪嗜血杆菌发病急、影响大的特点相一致。
3.3药敏试验结果显示,分离菌株对利福平、头孢氨苄、阿米卡星、环丙沙星、万古霉素高度敏感,发病猪场用上述敏感药物进行治疗和预防都有很好的效果。副猪嗜血杆菌不同的血清型之间的药物敏感性存在差异,即使是同一血清型,来自不同地区的不同菌株对同一种药物的敏感性也有很大差异,故临床用药要根据分离菌株药敏试验结果采取针对性的防治措施。从预防的角度来讲,疫苗免疫是预防副猪嗜血杆菌的有效方法之一,该场可利用分离的副猪嗜血杆菌制备自家疫苗对猪进行免疫接种。
