小鼠胚胎干细胞定向血管内皮和造血细胞分化体系的建立
2019-05-07郝俊凯周杰刘兵1
郝俊凯,周杰,刘兵1,
1.军事科学院 军事医学研究院,北京 100850;2.解放军总医院 第五医学中心,北京 100071;3.陆军第八十一集团军医院,河北 张家口 075000
血管内皮细胞(endothelial cell,EC)起源于胚胎发育早期的中胚层前体-血液血管母细胞[1]。然而成熟血管内皮体外扩增困难,极大地限制了其功能研究及临床应用。2012年Salven 等发现成体血管内皮中存在一群Kit+(也称CD117)的血管内皮干细胞(vascular endothelial stem cell,VESC),能在体外形成稳定克隆并产生子代内皮细胞,单克隆移植实验也证实Lin-CD31+CD105+Sca1+Kit+表型的VESC 可以在体内产生功能性血管[2]。2016年曾艺等在小鼠乳腺血管中也发现了CD201+(也称Procr、EPCR)的VESC,具有分化为原代内皮细胞和周细胞的双向潜能[3]。这些研究提示了内皮干细胞的存在及其分子特征。
造血细胞(hematopoietic cell,HC)的起源与血管内皮密不可分。目前认为胚胎早期造血细胞是由功能特化的生血内皮(hematopoietic endothelium,HE)通过内皮-造血转化(endothelial to hemato⁃poietic cell transition,EHT)分化而来[4]。小鼠胚胎期的造血细胞均表达内皮细胞标志CD31 和CD144(也称VE-cadherin,血管内皮钙黏蛋白)[5],也间接证实了造血细胞与内皮细胞有着共同起源。研究胚胎早期内皮和造血的发育过程,有助于揭示它们的起源、转归以及诸多调控因素的相互关系。
胚胎干细胞(embryonic stem cell,ESC)是早期胚胎(原肠胚期之前)或原始性腺中分离出来的一类细胞,无论在体外或体内环境,ESC 都能被诱导分化为机体几乎所有的细胞类型。与其他干细胞相比,ESC 具有更强的增殖能力、多能性及低免疫原性,是组织工程化研究的热门对象。但是,如何控制ESC 定向诱导分化、提高诱导效率,以及如何评价诱导细胞的质量和功能是研究的难点。Keller等发现在干细胞因子(stem cell factor,SCF)和血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的诱导下,小鼠ESC 能分化为具有典型内皮特点的贴壁型细胞和具有造血潜能的非贴壁型细胞[6-8]。2000年 Nishikawa 等证实,来自 ESC的Flk1+细胞可以作为血管祖细胞(vascular progenitor cell,VPC)分化成内皮细胞和壁细胞(周细胞和血管平滑肌),并可以再现血管组织过程[9]。2017年James等发现,白藜芦醇(resveratrol,RESV)作为Notch 信号通路激活剂,能促进人多能干细胞(human plu⁃ripotent stem cell,hPSC)向动脉内皮细胞分化[10]。2006年Kristian 等发现稳定过表达HOXB4基因可以促进人胚胎干细胞向造血细胞分化[11]。这些发现为体外诱导扩增可供使用的内皮和造血细胞的研究奠定了理论基础。然而,内皮细胞和造血细胞的体外诱导体系仍然不成熟。
根据胚胎期内皮、造血细胞的起源规律,本研究提出在无血清的StemPro 培养体系中加入骨形态发生蛋白4(bone morphogenetic protein 4,BMP4)、activin A(激活素A)、碱性成纤维细胞生长因子(fibroblast growth factor basic,FGF-Basic)和VEGF诱导小鼠胚胎干细胞系R1/E 形成拟胚体(embryoid body,EB),模拟中胚层发育过程,再用SCF、VEGF和SCF、FLt3 配体(FLt-3 ligand,FLt3)、白细胞介素3(interleukin-3,IL-3)分别定向诱导EB 分化为EC和HC,并同时验证是否有内皮干祖细胞(endothelial stem and progenitor cell,ESPC)和造血干祖细胞(hematopoietic stem and progenitor cell,HSPC)的存在,建立胚胎干细胞体外定向血管内皮和造血细胞分化系统。
1 材料和方法
1.1 材料
C57BL/6 小鼠购自北京维通利华公司(动物质量合格证号:SCXK(京)2016-0011),通常选取d12~d14的孕鼠处死后取胚胎,用于制备小鼠胚胎成纤维细胞(murine embryonic fibroblast,MEF)作为小鼠胚胎干细胞的饲养层细胞。小鼠均在军事医学研究院实验动物中心无特异性病原菌(SPF 级)实验动物房饲养[饲养设施合格证号:SYXK-(军)2012-0021]。
小鼠胚胎干细胞R1/E(ATCC SCRC-1036)、基质细胞OP9-DL1(ATCC CRL-2749)购自美国模式培养物集存库(American Type Culture Collection,ATCC);小鼠胚胎成纤维细胞(MEF)由自己制备。
鼠源SCF、FLt3、IL-3、BMP4、激活素A、FGFBasic 和VEGF均购自Peprotech公司;CD31-PE(MEC13.3)、CD45-FITC(30-F11)、CD144-PE-Cy7(eBioBV13)、CD201-APC(eBio1560)、Flk1-APC(Avas12a1)、Kit- Biotin(2B8)、APC- eFluor780(eB149/10H5)、7-氨基放线菌素 D(7-amino-acti⁃nomycin D,7-AAD)均购自eBioscience 公司;纯化的大鼠抗小鼠 CD31(MEC13.3)购自 BD 公司;α-MEM、IMDM 培养基均购自Gibco 公司;Ⅰ型胶原酶、牛血清白蛋白(BSA)、丝裂霉素C、二甲基亚砜(DMSO)、多聚甲醛(PFA)均购自Sigma 公司;山羊抗大鼠IgG 二抗、二氨基联苯胺(DAB)均购自北京中杉金桥生物技术有限公司。
恒温培养箱(Forma K3111)、细胞计数仪均购自Thermo Fisher 公司;台式高速离心机(5804R)、移液器均购自Eppendorf 公司;低温高速离心机(X-15R)购自Bechman 公司;显微镜(E200、DMIRB)分别购自Nikon 公司和Leica 公司;流式细胞仪(FACS Aria 2、Calibur)购自BD 公司;生物净化工作台购自北京亚太科隆仪器有限公司;解剖剪、解剖镊均购自Horotec 公司;Petri dish、细胞培养皿、培养板均购自Corning 公司,流式管、40 μm 细胞滤膜均购自Falcon公司。
1.2 液体配制
1.2.1 胚胎干细胞复苏传代培养基(30 mL 体系)24.5 mL DMEM(含葡萄糖),1.5 mL胎牛血清(FBS),4.5 mL KnockOut 血清替代品(KnockOut serum replacement,KSR),30 μL 三抗,300 μL 非必需氨基酸,90 μL β巯基乙醇,300 μL L-谷氨酰胺(以上试剂均购自Gibco 公司);30 μL 白血病抑制因子(leukemia inhibitory factor,LIF,购自 Invitrogen 公司)。
1.2.2 无血清StemPro 培养液(10 mL 体系) 10 mL StemPro-34 SFM,100 μL 三抗,250 μL 营养添加剂(以上试剂均购自Gibco 公司);1 μL BMP4,1 μL激活素A,0.5 μL FGF-basic,0.5 μL VEGF。
1.2.3 胰酶消化液 将Trypsin-EDTA(0.25%)与DMEM(含高糖)按1∶9 混合,用于将拟胚体消化成单细胞。
1.2.4 抗体稀释液 含0.1%或1% BSA的PBS。
1.2.5 中和液 含2% FBS的PBS。
1.3 饲养层细胞的制备
处死d12.5~d14.5的孕鼠,75%酒精消毒约1 min。以下步骤须无菌操作。将胎盘和羊膜与胚胎分离,去除内脏(所有深色部分)、胚胎头部、四肢和血(血长得快会对MEF造成很大影响),躯干部分(去除四肢后)转移至加有0.5 mL 胰酶(使用前须置于冰上)的1.5 mL EP 管内,置于冰上;将组织剪碎约100 次(不能过于碎烂),补加0.5 mL 胰酶,37℃孵育10~15 min,每5 min 振荡1 次(或37℃、600 r/min 振荡);将消化后的胚胎转移至15 mL 离心管,加5 mL DMEM 完全培养基终止消化,1000 r/min 离心 3~5 min,去除上清,加15 mL DMEM 完全培养基吹散,转移至25 cm 大培养皿,37℃细胞培养箱中培养过夜,次日更换新鲜培养基,可根据MEF 生长情况用泵吸去贴壁的大团组织;第3 d 用丝裂霉素C(10 μg/mL)处理MEF,消化分装冻存备用。
1.4 胚胎干细胞体外诱导流程
1.4.1 胚胎干细胞复苏及悬浮诱导拟胚体 将小鼠胚胎干细胞R1/E 和MEF 用ESC 复苏传代培养基共复苏于6 孔板中(1.7×105/孔),48 h 后换液;72 h 后用稀释好的胰酶消化液消化,改用无血清的 StemPro 培养基于 Petri dish(5×104~8×104/dish)中悬浮培养,培养基中添加BMP4、激活素A、FGF-Basic、VEGF(终浓度均为 5 ng/mL),第 3 d半量加液,第4 d 镜下观察拟胚体形状及数量,流式检测其表面标志表达情况。
1.4.2 拟胚体定向诱导内皮细胞和造血祖细胞 取诱导4 d 后的EB 消化为单细胞,与OP9-DL1 共孵育于24 孔板中(3.8×104/孔),分别加入内皮细胞诱导液(含SCF、VEGF,终浓度均为100 ng/mL)和造血细胞诱导液(含SCF、FLt3、IL-3,终浓度均为100 ng/mL)进行贴壁诱导,诱导第3 d 半量加液,第6 d 镜下观察诱导情况,寻找典型内皮簇、造血集落,流式检测EC、HPC 特征性表面标志表达情况,进而验证ESPC和HSPC 群体的存在(图1)。

图1 胚胎干细胞体外定向内皮细胞和造血细胞分化策略图
1.5 流式细胞仪分析内皮细胞和造血祖细胞
1.5.1 拟胚体细胞标记抗体 用胶原酶将拟胚体消化成单细胞悬液,用含 2% FBS的 PBS 洗涤 1~2 次,310 r/min 离心6 min,用100 μL 含0.1% BSA的PBS重悬,按照抗体说明书用量加入抗体PE-cy7 anti-CD31(1.5 μL)、APC anti-Flk1(2.5 μL)、PE anti-CD201(0.31 μL),4℃避光反应30 min,中和,用含2% FBS的 PBS 洗涤 1~2 次,用 500 μL 含 0.1% BSA的PBS 重悬,无菌细胞滤膜滤过,导入流式管,用AriaⅡ流式仪分析。
1.5.2 诱导后的内皮细胞、造血祖细胞标记抗体将诱导至第6 d的EC 和HPC 消化成单细胞悬液,用含2% FBS的 PBS 洗涤 1~2 次,310 r/min 离心 6 min,用100 μL含0.1% BSA的PBS重悬,先加Biotin anti-Kit(0.5 μL),4℃避光反应30 min,再按抗体说明书用量加入抗体PE anti-CD31(1.5 μL)、FITC anti-CD45(1 μL)、APC-eflour780 anti-Biotin(0.625 μL)、APC anti-CD201(1.25 μL)、PE-cy7 anti-CD144(0.625 μL),4℃避光反应30 min,中和,用含2%FBS的 PBS 洗涤 1~2 次,用 500 μL 含 0.1% BSA的PBS 重悬,无菌细胞滤膜滤过,导入流式管,用AriaⅡ流式仪分析。
1.6 免疫组化显色观察内皮诱导情况
取诱导至第6 d的24 孔板,用含2% PFA的PBS室温固定20 min,PBS 洗涤2 次,每次3 min;每孔加入anti-CD31 大鼠抗小鼠一抗(绿色)500 μL,4℃摇床过夜,次日取出,回收一抗,PBS 洗涤2 次,每次3 min;每孔加入400~500 μL 山羊抗大鼠的二抗(橙色),室温摇床30 min,回收二抗,PBS 洗涤2 次,每次3 min;每孔加入400 μL DAB 显色液,边显色边镜下观察内皮簇,感觉背景颜色较深时吸走DAB,每孔加400 μL PBS 终止显色,弃去后再换1 次新的PBS,用保鲜膜包裹孔板,以备日后拍照查看。
1.7 统计学分析
流式数据用Flowjo 10.0.7 软件分析;做图采用GraphPad Prism 5 软件;统计分析采用SPSS 12.0 软件。
2 结果
2.1 胚胎干细胞诱导的拟胚体含有中胚层表型、内皮表型及干祖细胞表型
将胚胎干细胞R1/E 复苏于6 孔板内2 d 后,转至 Petri dish 中悬浮诱导 ESC 向 EB 分化,模拟中胚层发育过程,加入无血清的StemPro 培养基,前2 d 不换液,拟胚体以肉眼可见的速度迅速增长。显微镜下观察可见细胞间黏附紧密,克隆边界清楚,胚体饱满(图2A)。流式分析其表面标志表达情况,1.14%的细胞表型为Flk1+,提示这部分细胞已具有中胚层特性(图2B);24.4%的细胞表型为CD31+,提示这部分细胞已带有内皮标记特性(图2C);同时发现约1.04%的细胞表型为CD201+(图2D)。
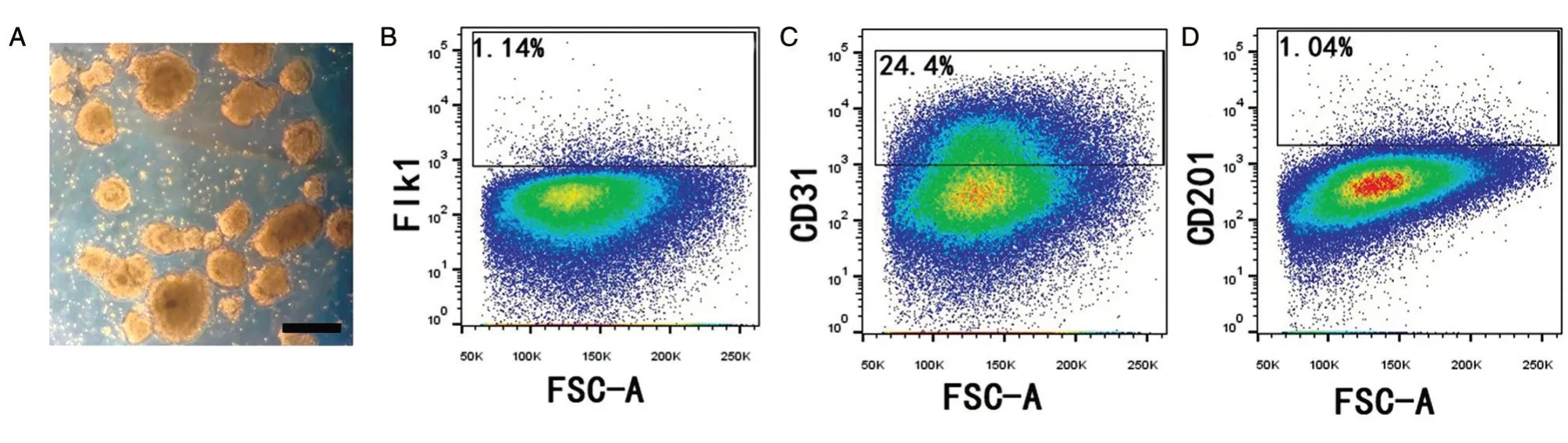
图2 体外诱导4d后拟胚体的形态和表面标记的表达

图3 OP9-DL1共培养6d后24孔板内皮细胞定向分化结果
2.2 内皮定向诱导分化结果
拟胚体向内皮细胞定向诱导6 d 后,流式分析其表面标志表达情况。在55.8%的CD45-细胞群体中,约1%的细胞表型为CD31+CD144+,提示这群细胞具有典型的内皮表型(图3A)。CD31 免疫组化染色后,在显微镜下可观察到多个被DAB染成棕色的典型单层扁平状的内皮细胞(图3B 红箭头所示),显示被anti-CD31 抗体标记上,细胞呈短梭型,形态饱满,聚集成管状结构,立体感增强。分析CD31+CD144+CD45-的内皮细胞群体,3.15%的细胞表型为Kit+CD201+,提示可能是处于内皮细胞分化上游、具有干祖细胞表型特性的ESPC 群体(图3C)。
2.3 造血定向诱导分化结果
拟胚体向造血细胞定向诱导6 d 后,流式分析其表面标志表达情况(图4)。34.7%的细胞表型为CD45+,诱导效率较内皮细胞有较大提升。在这群CD45+造血细胞中,有0.34%的细胞表达Kit+CD201+,表型接近于CD201+的Ⅱ型造血干细胞前体(pre-hematopoietic stem cell,pre-HSC,表型为CD31+CD45+Kit+CD201high),提示这群细胞可能是具有定向造血潜能的HSPC。综合内皮细胞诱导的结果,本研究建立的ESC 体外诱导体系可行,在诱导后的内皮、造血细胞里均发现了不同比例的Kit+CD201+干祖细胞分子特征的群体,提示内皮细胞和造血细胞在发育上游可能存在各自的前体细胞,并且可能有共同的中胚层祖细胞起源。

图4 流式细胞术分类图
3 讨论
胚胎干细胞是具有发育全能性的高度未分化细胞,想直接诱导获得特定细胞类型的研究策略通常会产生混合细胞群,如何通过诱导控制向内皮、造血细胞定向分化,提升诱导效率是研究中的难点。Luttun 等尝试将内皮细胞诱导剂直接加入ESC 培养基中进行诱导,但诱导效率却无明显提升,可能的原因是没有遵循内皮细胞在胚胎中正常的分化演变模式[12]。产生成血管细胞和造血细胞的血液血管母细胞起源于中胚层[1],而Chad 等发现 GSK3β抑制剂 CHIR99021 可以激活经典的 Wnt/β-catenin 信号通路,与 BMP4 二者结合能更好地将干细胞向中胚层诱导[13]。本研究抓住内皮、造血细胞在分化发育层级上共同来源于中胚层这一属性,先将胚胎干细胞悬浮诱导为拟胚体,加入 BMP4、激活素 A 激活 TGF-β 信号通路,诱导细胞标记中胚层特性。Zhou 等发现,成纤维细胞生长因子2(FGF2)单独不能诱导内皮细胞CD31和CD144的表达,但是在VEGF和BMP4的协同作用下,却可以增强其表达,诱导人多能干细胞(hPSC)向VPC 分化[14]。因此本研究诱导体系中还加入了FGF 和VEGF 促进细胞分化、增殖、迁移,成功地诱导出EC、HC 以及各自的Kit+CD201+干祖细胞表型群体,提示内皮和造血细胞在胚胎发育过程中可能来源于共同的中胚层祖细胞。不仅如此,使用完全无血清的培养基StemPro 培养ESC,在促进其诱导分化的同时,也可以评估培养基中单一组分的细胞因子对诱导效率的影响,变异性低。而本研究团队在2016年利用创新的单细胞孵育移植技术,结合单细胞转录组测序筛选出的CD201 分子的特异性高表达,实现了pre-HSC 高达30%的纯度富集[15],也提示可以利用先进的单细胞测序平台深度挖掘EC、HC 群体的其他特征分子,继而更好地优化体外诱导分化策略。
血管生长和重塑是一个贯穿于生命全程持续发生的生理事件,它伴随着所有组织器官的发育和自稳态维持,一旦发生动态失衡,就可能引起组织病变,甚至导致疾病发生。众多研究表明血管内皮细胞中的确存在一群有分化潜能的前体细胞,表型为Kit+或CD201+,通过其有限的自我更新和分化潜能,维持着血管系统的稳定[2-3],本研究也证实了这一点。在诱导出的内皮细胞中,存在一群CD31+CD144+CD45-Kit+CD201+细胞,表型与文献报道的内皮干细胞吻合,提示处于分化发育上游,数量非常有限。目前的体外实验证据证明,内皮干祖细胞在客观上是存在的,它们通过维持较高的干祖细胞特性和有限的数量来保持分化发育潜能。在今后的研究中或许能够发现更为特征性的表面标记,比我们目前认识的分子更能有效地识别和富集ESPC,使内皮干细胞的定义更加明确,也为大规模组织工程化研究提供更坚实的理论依据。
造血细胞起源一直是发育领域研究的核心问题之一。尽管已有大量证据证实造血细胞来源于生血内皮[16-18],但内皮-造血转化过程中的诸多细节仍然未知,并不能排除发育过程中的其他潜在途径。本研究表明,在细胞因子SCF、FLt3、IL-3的诱导下,与OP9-DL1 基质细胞共培养6 d这种诱导pre-HSC 转化为成熟HSC的实验方法,也能诱导胚胎干细胞产生具有造血干祖细胞样的细胞。这群细胞的表型为CD45+Kit+CD201+,比例约占总细胞群体的0.1%,与之前文献报道的Ⅱ型pre-HSC(CD31+CD45+Kit+CD201high)表型相似[15],体外诱导实验的结果能否与已知胚胎造血发育时间节点和位点存在对应关系,也为今后的研究提供了思路。
