miRNA-125a靶向调控SMURF1对结肠癌生物学行为的影响
2019-05-07邢旻琰何美文余佳泽张超
邢旻琰,何美文,余佳泽,张超
0 引言
结肠癌早期特异性症状不明显,而术后复发和转移影响了治疗效果。当前,阐明结肠癌发生发展的分子机制对寻找新的分子靶点具有重要意义。miRNA是一类非编码小分子RNA。通过与靶基因mRNA 3’-UTR完全或不完全互补配对结合,导致靶miRNA降解或翻译抑制来调控靶基因的表达。研究证实,在结肠癌细胞中存在多个miRNA表达异常,且与结肠癌患者的分化程度、远处转移等病理特征之间存在相关性,提示miRNA可能参与结肠癌的发生及发展[1-2]。SMURF1是HECT型E3泛素连接酶,参与多个生物学信号通路,近来研究发现,其在结肠癌组织中呈现高表达,并协同泛素蛋白酶系统降解抑癌蛋白,表现出促癌功能[3]。miRNA-125a在多种肿瘤的形成和转移中发挥重要作用[4]。本研究旨在分析miRNA-125a与结肠癌相关临床指标的相关性,并探寻其通过靶向调控SMURF1在结肠癌的病理过程中所发挥的作用,为结肠癌的诊断及治疗寻找新靶点。
1 资料与方法
1.1 研究对象
收集2017年6月至2018年1月在我院收治的50例结肠癌患者,其中男21例、女29例,平均年龄(59.72±5.36)岁。所有患者无化疗或放疗史。
1.2 外周血采集
纳入研究的结肠癌患者均于清晨空腹状况下进行外周静脉血抽取,具体操作如下:采用一次性血清分离胶管,抽取外周静脉血约3 ml;待血清析出后以1 000g离心10 min,取上层血清保存至-80℃冰箱待检测。
1.3 qRT-PCR检测外周血miRNA-125a和SMURF1的表达
取0.5 ml血清标本,采用TRIzol法提取血清总RNA,实验步骤按照TRIzol试剂盒说明书进行。将提取到的总RNA按照反转录试剂盒说明书进行RNA反转录,合成cDNA。按照qRT-PCR试剂盒说明书进行PCR反应。miRNA-125a的测序PCR引物为:上游5’-TGTGTCTCTTTCACAGTGGATC-3’和下游5’-CCATCG TGTGGGTCTCAAG-3’。
1.4 SW480细胞培养
使用含10%胎牛血清、100 u/ml青霉素、100 μg/ml链霉素的DMEM培养基在37℃、5%CO2饱和湿度培养条件下培养SW480细胞。
1.5 细胞转染
根据转染SW480细胞的转染物进行分组:miR-NC组(转染negative control miRNA mimics),miRNA-125a模拟物转染组(转染miRNA-125a模拟物),miRNA-125a模拟物+SMURF1转染组(转染miRNA-125a模拟物和SMURF1)。
1.6 荧光素酶报告基因法检测miRNA-125a与靶基因SMURF1的结合
利用microRNA靶基因数据库预测miRNA-125a与SMURF1可能的作用位点。构建SMURF1野生型3’-UTR荧光素酶质粒pMIR-WT和突变型质粒pMIR-Mut:根据GenBank中登录的human SMURF1基因序列,上游:5’-ACTCCTGGTACA GCGACTCCGAAATCCT-3’,下游:5’-GTCCCT GCACTGTTGTCCTTTGCTCATA-3’,采用Primer Premier5.0软件设计PCR引物,PCR扩增目的基因片段,并连接入野生型载体,转化及菌液PCR鉴定,送南京金斯瑞科技有限公司测序,测序鉴定正确的重组载体命名为pMIR-WT。突变载体的构建步骤与双荧光素酶载体的构建基本一致 ,利用PCR突变法在野生型载体基础上设计突变引物,引物由南京金斯瑞生物科技有限公司合成。以野生型载体为模板进行扩增,鉴定正确的重组载体命名为pMIR-Mut。将pMIR-WT、pMIR-Mut与miR-125a模拟物和negative control miRNA mimics共转染进SW480细胞,荧光素酶检测实验检测各组荧光素酶活性。
1.7 Western blot检测SMURF1蛋白表达
将miRNA-125a模拟物和negative control miRNA mimics分别转染SW480细胞中,36 h后用IP裂解液收集细胞。按照Western blot操作流程检测SMURF1蛋白的表达水平。
1.8 HE染色
将肿瘤组织经固定液固定,石蜡包埋,3~4 μm厚切片,45℃恒温箱中烘干后进行HE染色。
1.9 CCK-8检测细胞增殖
参照CCK-8试剂盒说明书步骤进行,各组转染24 h后,接种于96孔培养板,每孔加10 μl CCK-8,37℃培养2 h,酶标仪上480 nm波长处测定A值。
1.10 细胞划痕实验检测细胞迁移
各组转染48 h后,细胞经胰酶消化吹打为单细胞悬液,接种于12孔细胞培养板,恒温培养24 h。待细胞长成单层(铺满培养板底部)弃去培养液,在每孔中央划出一个划痕,洗去死亡细胞,显微镜下拍照。利用软件测量并计算24 h细胞迁移距离。
1.11 流式细胞法检测细胞周期
悬浮并收集不同时间点细胞,0.9%氯化钠溶液冲洗细胞两遍,70%乙醇固定。加入碘化丙啶DNA荧光染色(PI:50 mg/L, 1% Triton X-100),4℃冰箱避光染色30 min,铜网过滤,取合格的单细胞悬液,流式细胞仪检测细胞周期。
1.12 构建结肠癌肿瘤异种移植小鼠模型
取分别转染miRNA-125a模拟物和negative control miRNA mimics的结肠癌SW480细胞,调整细胞密度至2×108个/毫升。取0.1 ml细胞悬液注射于每只裸鼠左前肢腋窝皮下,将裸鼠随机分为两组,分别注射转染了miRNA-125a模拟物和转染了negative control miRNA mimics的SW480细胞。每日观察裸鼠皮下肿瘤生长情况,21天后将肿瘤从裸鼠身上分离,PCNA染色分析细胞增殖情况。
1.13 统计学方法
采用SPSS 22.0统计软件进行数据分析,计量资料用(±s)表示,两组样本均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-125a在结肠癌和癌旁正常组织的表达
qRT-PCR结果显示,相比癌旁正常组织,结肠癌组织中miRNA-125a的表达水平显著降低,差异有统计学意义(P<0.01),见图1A。同时,miRNA-125a在发生远端转移肿瘤组织中的表达水平显著低于未转移肿瘤组织,差异有统计学意义(P<0.01),见图1B。提示miRNA-125a可能与结肠癌的发生及发展有关。

图1 miRNA-125a在结肠癌和癌旁正常组织中的表达Figure1 miRNA-125a expression in colon cancer and adjacent normal tissues
2.2 miRNA-125a与结肠癌患者临床指标的相关性
分析结果表明,miRNA-125a的表达水平与肿瘤分化程度、淋巴结转移、远端转移、肿瘤浸润深度和肿瘤直径相关(均P<0.01),与性别和年龄无关,见表1。
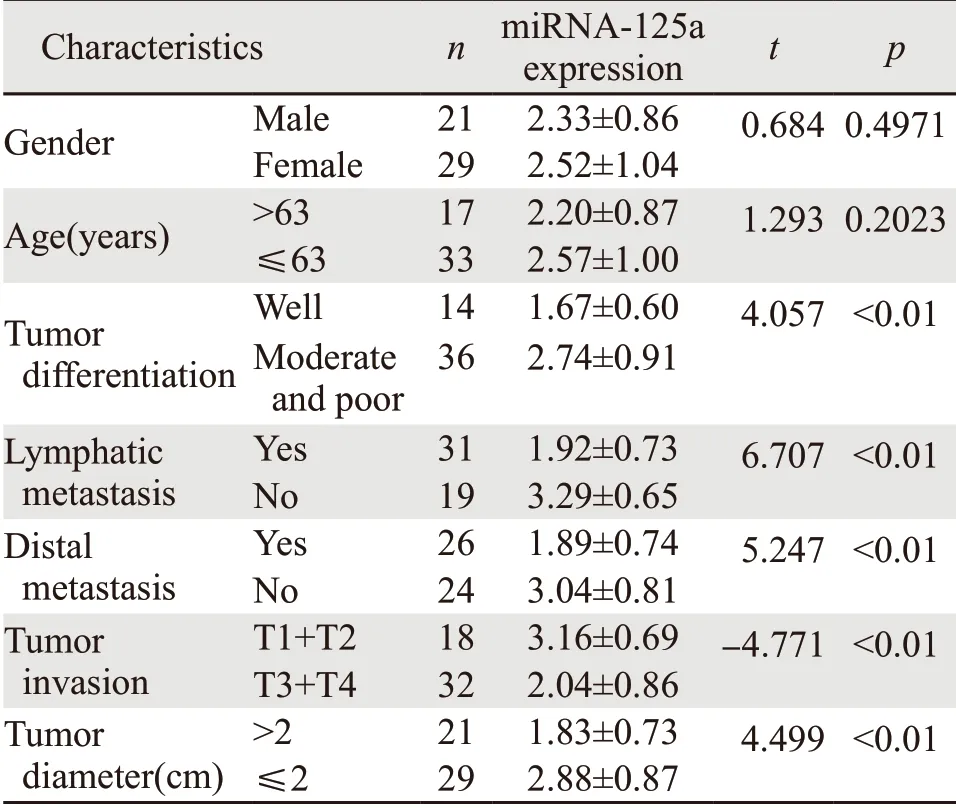
表1 miRNA-125a与结肠癌患者临床指标的关系Table1 Relationship between miRNA-125a and clinical indicators of patients with colon cancer
2.3 miRNA-125a通过结合SMURF1的3'-UTR来抑制SMURF1的表达
根据microRNA靶基因数据库预测潜在的miRNA-125a靶基因为SMURF1,见图2A。将miRNA-125a模拟物、negative control miRNA mimics(miR-NC)以及构建的pMIR-WT和pMIR-Mut质粒转染入SW480细胞,36 h后检测荧光素酶活性。结果显示,相比miR-NC组,miRNA-125a模拟物转染组pMIR-WT质粒荧光素酶活性显著降低(P<0.01),而pMIR-Mut质粒荧光素酶活性无明显变化,见图2B。结果显示miRNA-125a可以通过结合SMURF1的3’-UTR进而抑制SMURF1的表达。

图2 miRNA-125a结合SMURF1的3’-UTR抑制荧光素酶活性Figure2 miRNA-125a binded 3'-UTR of SMURF1 to inhibit luciferase activity
2.4 miRNA-125a抑制SMURF1 mRNA翻译及蛋白水平
qRT-PCR检测结果显示miRNA-125a模拟物转染组中SMURF1 mRNA表达水平明显低于miRNC组,差异有统计学意义(P<0.01),见图3A。Western blot检测结果显示,相比miR-NC组,miRNA-125a模拟物转染组中SMURF1蛋白表达量明显降低,差异有统计学意义(P<0.01),见图3B。
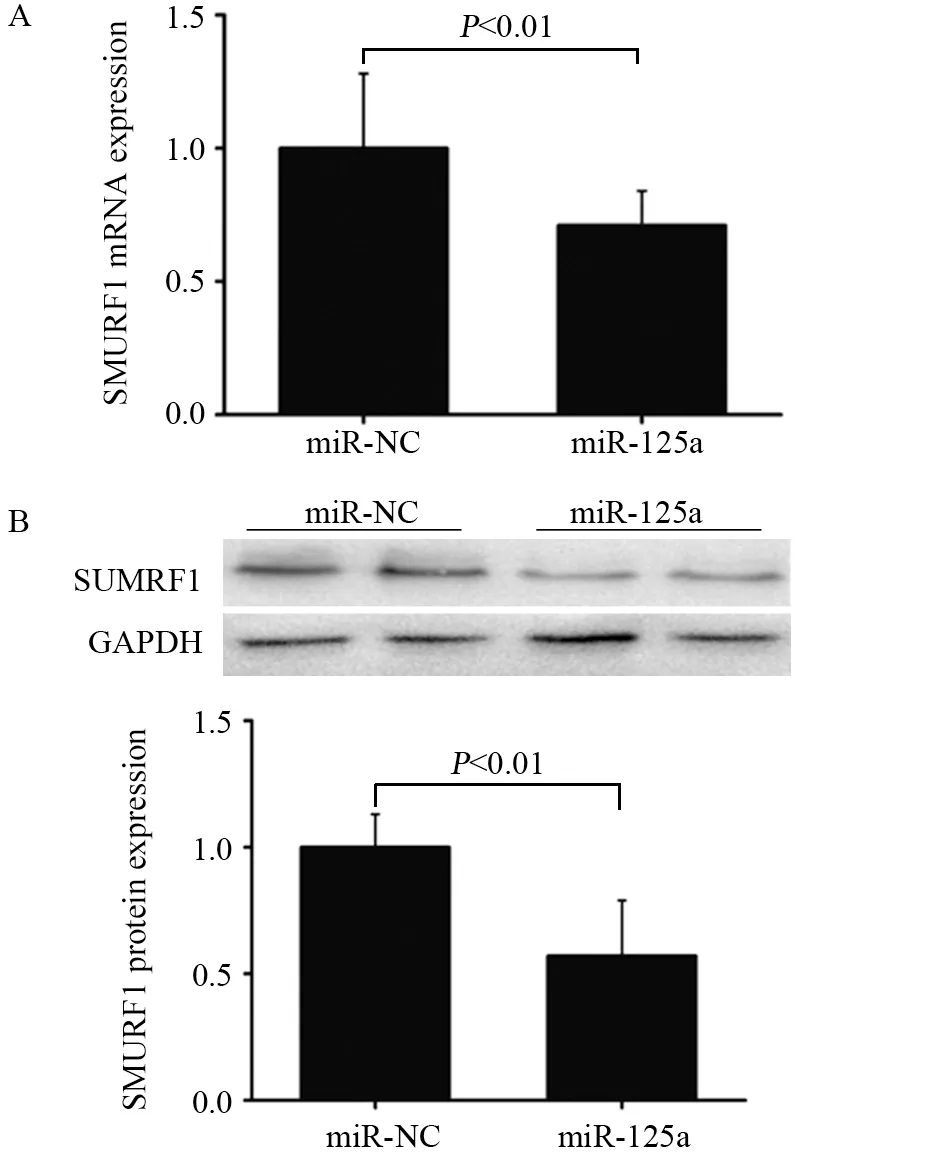
图3 miRNA-125a抑制SMURF1 mRNA和蛋白表达Figure3 miRNA-125a inhibited mRNA and protein expression of SMURF1
2.5 SMURF1与结肠癌患者临床指标的相关性
统计分析发现,SMURF1的表达水平与肿瘤分化程度、淋巴转移、远端转移、肿瘤浸润深度和肿瘤直径呈正相关(P<0.01),与性别和年龄无关,见表2。
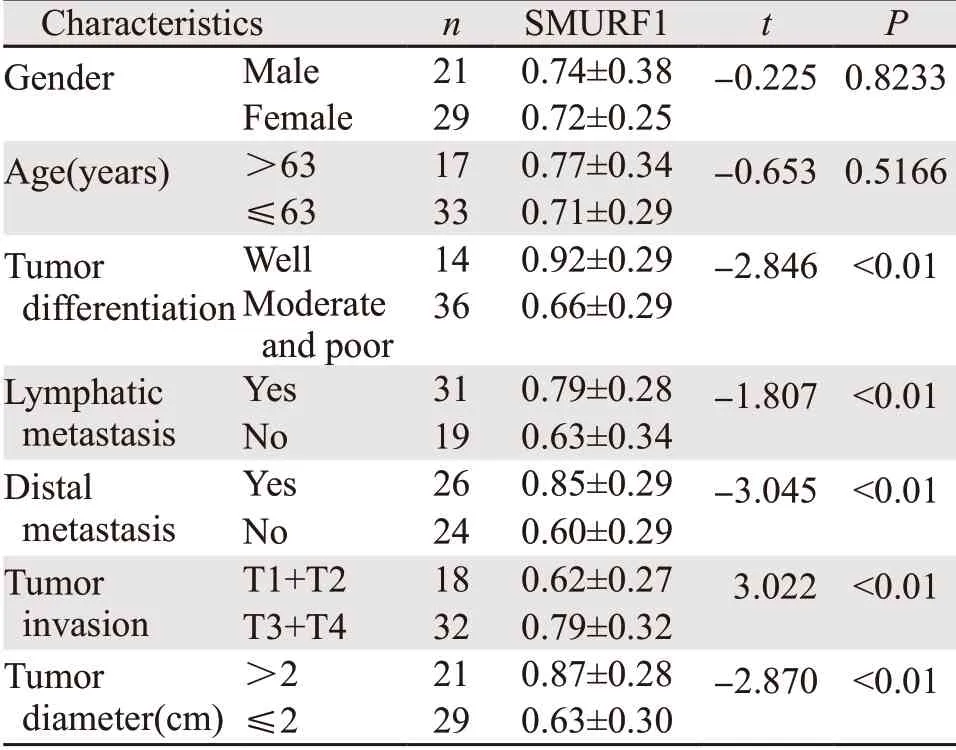
表2 SMURF1与结肠癌患者临床指标的关系Table2 Relationship between SMURF1 and clinical indicators of patients with colon cancer
2.6 SMURF1在结肠癌组织中的表达
HE染色结果显示,相比癌旁正常组织,结肠癌组织中SMURF1表达水平明显升高,见图4A。而结肠癌患者血清中miRNA-125a表达水平与SMURF1表达水平呈负相关性,见图4B。
2.7 miRNA-125a和SMURF1与细胞增殖、迁移及周期的相关性
CCK-8检测结果显示,miRNA-125a模拟物转染组A值明显低于miR-NC组,差异有统计学意义(P=0.029)。而miRNA-125a模拟物+SMURF1转染组A值明显高于miRNA-125a模拟物转染组,差异有统计学意义(P=0.006),见图5A。流式细胞术检测结果显示,miRNA-125a模拟物转染组的S期细胞比值明显低于miR-NC组,差异有统计学意义(P=0.048),而miRNA-125a模拟物+SMURF1转染组的S期细胞比值明显高于miRNA-125a模拟物转染组,差异有统计学意义(P=0.004),见图5B。细胞划痕实验检测结果显示,miRNA-125a模拟物转染组的细胞迁移距离明显低于miR-NC组,差异有统计学意义(P=0.031),而miRNA-125a模拟物+SMURF1转染组的细胞迁移距离明显高于miRNA-125a模拟物转染组,差异有统计学意义(P=0.002),见图5C。
2.8 miRNA-125a抑制小鼠体内肿瘤生长
采用SW480细胞构建结肠癌肿瘤异种移植小鼠模型,将negative control miRNA mimics(miRNC),miRNA-125a模拟物转染SW480细胞并注射到裸鼠皮下21 d后,切除肿瘤并称重,miRNA-125a模拟物转染组肿瘤重量明显低于miR-NC对照组,差异有统计学意义(P=0.003),见图6A。PCNA染色结果显示, 相比miR-NC对照组,miRNA-125a模拟物转染组的SW480细胞中SMURF1阳性信号明显减少,且细胞增殖明显降低,见图6B。
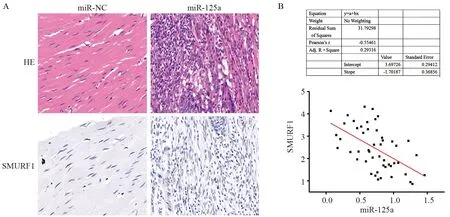
图4 SMURF1在肿瘤组织中的表达Figure4 Expression of SMURF1 in colon cancer tissues
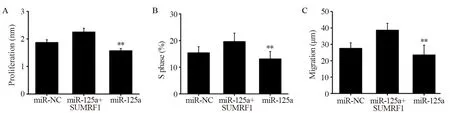
图5 miRNA-125a和SMURF1对细胞增殖、迁移及周期的影响Figure5 Effects of miRNA-125a and SMURF1 on cell proliferation, migration and cell cycle of colon cancer
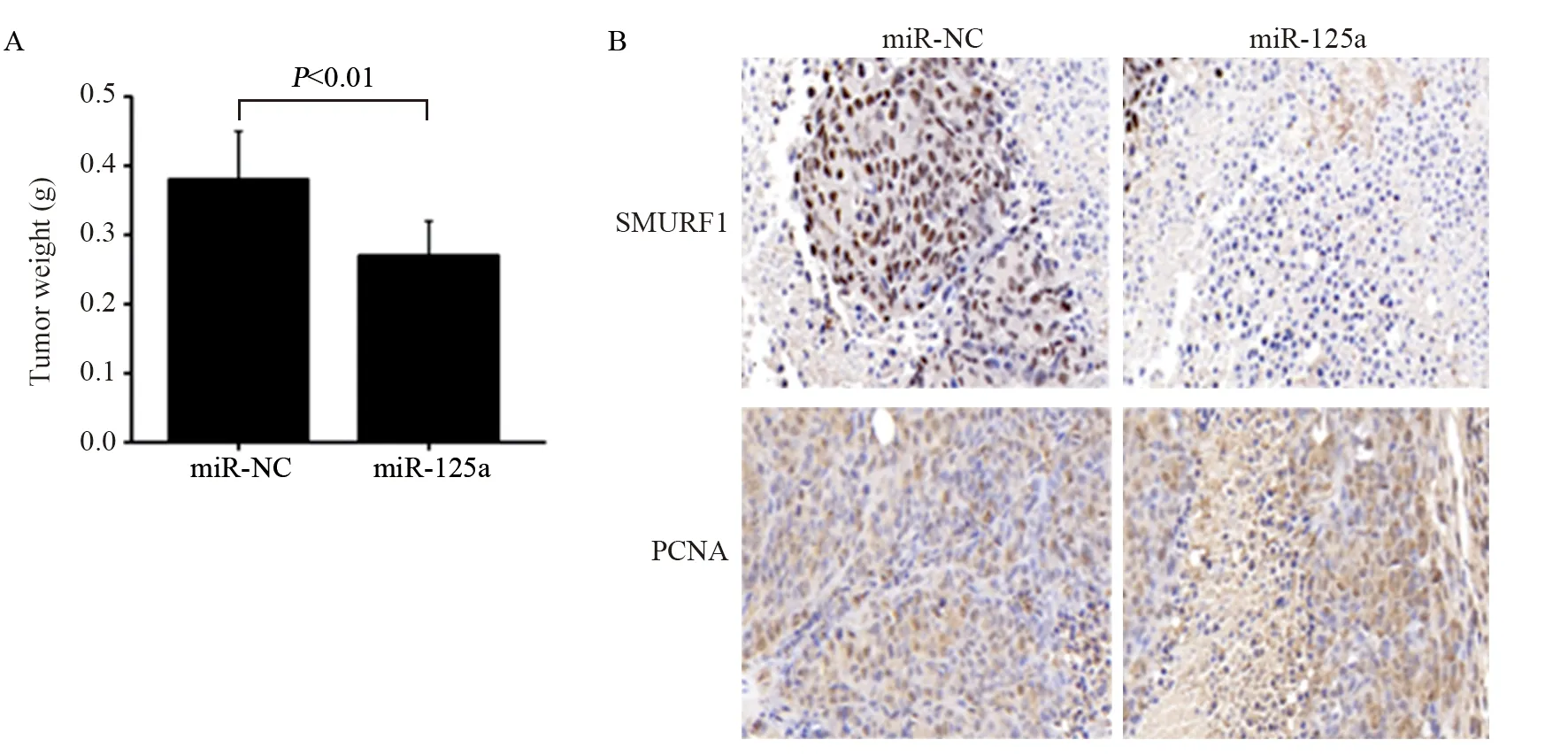
图6 miRNA-125a抑制小鼠体内肿瘤生长Figure6 miRNA-125a inhibited tumor growth in mice
3 讨论
结肠癌是常见的消化系统恶性肿瘤,具有疾病隐匿、症状不典型且易转移的生物学行为特征。目前虽然大量研究证实TGF-β/Smad[5]、RhoA[6]、PI3K/AKT[7]、Wnt[8]等信号通路的异常活化或失活与结肠癌的转移密切相关,但对结肠癌的临床治疗仍未有较为突出的贡献。因此,从新的生物学层面挖掘其发展机制具有重要意义。miRNA是一类长度为22~28个核苷酸的内源性非编码单链小分子RNA,与许多恶性肿瘤的发生发展存在密切关系,它参与调控细胞凋亡、增殖、侵袭和转移相关的生物学事件,起着癌基因或抑癌基因的作用。有报道证实miR-143、miR-145及miR-101在结肠癌中低表达[9-10],可能是潜在的抑癌因子。miR-106a、miR-181b、miR-203[11-13]等在结肠癌组织中高表达,提示miRNA在结肠癌的发生及发展过程中发挥重要作用。
Lyu等[14]发现miRNA-125a可通过抑制ERBB2和ERBB3的表达来抑制乳腺癌细胞的增殖和转移;miRNA-125a表达受EGFR调节,抑制肺癌细胞的转移;此外,miRNA-125a可以抑制ARID3B来负性调节卵巢癌EMT,从而抑制卵巢癌细胞的转移。然而,miRNA-125a在结肠癌中的作用尚未有相关报道。本研究发现miRNA-125a表达量随结肠癌发展程度的加深呈降低趋势,提示miRNA-125a与结肠癌的发生发展密切相关。
SMURF1属于HECT型E3泛素连接酶,参与TGF-β/Smad、Wnt、BMP、MAPK等多种生物学信号通路的调控。SMURF1高表达可以影响肿瘤组织的侵袭、转移,与肿瘤预后关系密切。研究发现SMURF1促进抑癌蛋白的快速降解,是促进结直肠癌发生发展的一个重要因子[15]。本研究检测到结肠癌患者肿瘤组织中miRNA-125a的表达水平显著降低,且结肠癌患者血清中SMURF1表达水平随结肠癌发展程度(肿瘤分化程度、淋巴转移、远端转移、肿瘤浸润深度和肿瘤直径)加深而呈升高趋势,而miRNA-125a表达水平与SMURF1表达水平呈负相关性。进一步HE染色发现,SMURF1在结肠癌组织中表达水平明显升高,提示SMURF1在结肠癌中发挥促癌作用,与以往研究结果相似[16]。本研究采用microRNA靶基因数据库预测获得SMURF1为miRNA-125a潜在靶基因,并验证了miRNA-125a可以通过结合SMURF1的3’-UTR进而抑制SMURF1的表达,同样miRNA-125a能够抑制SMURF1的mRNA翻译和SMURF1蛋白水平表达。这些结果提示miRNA-125a可能通过对SMURF1的靶向调控参与到结肠癌的病理过程中。本研究还发现miRNA-125a可通过抑制SMURF1的表达水平从而抑制结肠癌的发展。在本研究中,我们将miRNA-125a模拟物转染的SW480细胞注射到裸鼠皮下,观察到miRNA-125a能够抑制肿瘤生长及SMURF1的表达。这进一步验证了miRNA-125a对结肠癌发挥抑癌作用。
综上所述,mi RNA-125 a 通过结合靶基因SMURF1的3’-UTR,抑制结肠癌促癌因子SMURF1的表达,进而抑制癌细胞的增殖、迁移和S期细胞的聚集,在结肠癌的发展过程中发挥抑制作用。因此,miRNA-125a可能为结肠癌的诊断及治疗提供新的研究方向。
