基质辅助激光解析电离飞行时间质谱检测耐甲氧西林金黄色葡萄球菌δ-毒素的应用
2019-05-05郭庆昕杨滨强华
郭庆昕 杨滨 强华
(1 福建中医药大学附属泉州市正骨医院,泉州 362000;2 福建医科大学附属第一医院检验科,福州 350005;3 福建医科大学,福州 350122)
基质辅助激光解析电离飞行时间质谱(matrixassisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)技术可用于蛋白质、核酸、多糖等多种生物分子的分子量和结构分析,其基本原理是:在基质辅助激光解析的离子源部分,基质与样本形成共晶体后,从激光中吸收能量使样本解吸,基质与样本间发生电荷转移使得样本分子电离;在飞行时间质谱分析器部分,离子在电场作用下加速飞过管道,飞行时间与离子的质荷比成正比,根据到达检测器的飞行时间可测出质荷比,通过软件处理得到特征性的指纹图谱[1]。Holland等[2]应用MALDI-TOF MS在无前处理的前提下获得全菌的蛋白指纹图谱,与数据库中细菌质谱进行比较,鉴定细菌至属、种,乃至亚种的水平,使得细菌鉴定变得更加快速准确。蛋白质约占细菌干重的50%,其表达由遗传性状决定,受外界环境影响较小,具有多样性、丰富性、易于提取和分离且不需要扩增的特点,因此成为MALDI-TOF MS技术鉴定细菌的最主要生物标志[3]。
随着金黄色葡萄球菌MALDI-TOF MS图谱中不同的蛋白和多肽的本质逐渐被揭示,发现许多小分子多肽的实质为金黄色葡萄球菌产生的毒力因子,如酚可溶性调节肽(PSM)家族中的PSMa1、PSMa2、PSMa3[4]、PSMa4[5]和δ-毒素[6]等。其中δ-毒素是最早被认识的PSM家族成员,含26个氨基酸的多肽,最初被描述成一种蛋白质,但它实际上更倾向于寡聚化的多肽[7],由辅助基因调节子(agr)群体感应系统的调控分子RNAIII编码[8]。研究人员发现δ-毒素还有一个同基因变异体,是由于hld基因中的非同义突变(从甘氨酸密码子GGT到丝氨酸密码子AGT),导致在10位由丝氨酸取代甘氨酸的δ-毒素(HldG10S)[9]。Gagnaire等[6]使用MALDI-TOF MS检测δ-毒素,并证实(3005±5)m/z对应野生型的δ-毒素(分子量3005.3Th),(3035±5)m/z峰对应δ-毒素G10S变异体(分子量3035.8Th)。
本研究使用MALDI-TOF MS采集83株临床分离的耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)蛋白指纹图谱,使用仪器配套软件分析δ-毒素产生在MRSA的分型和毒力表达的作用。
1 材料与方法
1.1 实验材料
1.1.1 菌株来源
83株实验菌株来自于某综合三甲医院临床分离的非重复菌株,按美国疾病预防控制中心的社区获得性MRSA(CA-MRSA)定义:患者在门诊或入院48h内分离到MRSA菌株,1年内无住院或与医疗机构接触史,没有留置各种导管及其他穿透皮肤的医用装置,将实验菌株分成医院获得性MRSA(HA-MRSA)组与CA-MRSA组。SCCmec分型标准菌株为同济大学附属上海肺科医院余方友教授馈赠。
1.1.2 主要试剂
血琼脂平板、革兰阳性菌GP鉴定卡、革兰阳性菌GP67药敏卡(均购于法国Bio-Mérieux公司),甲酸、乙腈、α-氰基-4-羟基肉桂酸(均购于BrukerDaltonique),实验引物(上海生工生物工程有限公司合成),PCR反应试剂包(购于大连宝生TaKaRa有限公司)。
1.1.3 主要设备
Vitek-2全自动细菌检测系统(购于法国Bio Mérieux公司),microflex型基质辅助激光解析电离飞行时间质谱、MALDI Biotype2.0软件、clinProTools 3.0软件、flexAnalysis软件(均购于BrukerDaltonique),PCR扩增仪(购于Eppendorf有限公司)。
1.2 实验方法
1.2.1 δ-毒素(hld)基因
扩增引物和实验方法参照文献[10],选取部分扩增产物送上海生工生物工程有限公司进行测序确认。
1.2.2 基因分型
SCCmec分型扩增引物和实验方法参照文献[11],结果判读以Marker为基准,结合SCCmec标准菌株在相应位置出现荧光条带为阳性。spa分型扩增引物和实验方法参照官方网站推荐方案,将扩增产物送上海生工生物工程有限公司测序,登陆官方网站http://spa.ridom.de/spatypes,查询各菌株的spa分型。
1.2.3 MRSA 蛋白指纹图谱的采集
样本前处理按照仪器说明书进行,采用甲酸萃取法提取全菌蛋白,吸取1μL提取液于96孔靶板上,每个样品检测3孔,室温下干燥。每个样品用1μL用α-氰基-4-羟基肉桂酸-50%乙腈-2.5%三氟乙酸(HCCA)中的饱和溶液覆盖,并在室温下干燥。使用Bruker microflex MALDI-TOF仪器采集在2000~20000Da的质量范围内的正线性模式图谱,记录每一图谱的使用500个激光照射。从测量到鉴定的整个过程中保证仪器在没有任何外界因素干扰的情况下自动进行。
1.2.4 数据分析
使用仪器配套的MALDI Biotyper 2.0、flexAnalysis软件分析MRSA菌株的蛋白指纹图谱,ROC曲线使用clinProTools 3.0软件分析;χ2检验采用SPSS 19.0软件进行统计学分析,P<0.05为有显著性差异。
2 结果
2.1 MRSA基因检测结果
83株MRSA中HA-MRSA39株,CA-MRSA44株。SCCmec分型检出4个分型,SCCmecⅠ1株(1.2%)SCCmecⅡ 3株(3.6%)SCCmecⅢ 54株(65.1%)SCCmecⅣa 24株(28.9%);39株HA-MRSA中SCCmecⅠ 1株(2.6%)SCCmecⅡ 3株(2.7%)SCCmecⅢ 32株(82.1%)SCCmecⅣa 2株(5.1%)未知分型1株(2.6%);44株CA-MRSA中SCCmecⅢ 22株(50.0%)SCCmecⅣa 22株(50.0%)。spa分型中83株MRSA共检出15个型,主要分型为t437共33(39.8%)株,t062共18(21.7%)株,t015共9(10.8%)株;HA-MRSA的主要spa分型t437为11(28.2%)株,t062为9(23.1%)株,t015为4(10.3%)株,t030为4(10.3%)株;CA-MRSA中t437为22(50.0%)株,t062为9(20.5%)株,t015为5(11.4%)株。所有菌株均检出hld。
2.2 MRSA δ-毒素产生情况
本研究中共有39(47.0%)株MRSA检出(3005±5)m/z信号峰(图1),其中HA-MRSA 19(22.9%)株,CAMRSA 20(26.5%)株,P=0.766,两者之间无显著性差异;另外共有33(39.8%)株MRSA检出(3035±5)m/z信号峰(图2),其中HA-MRSA 9(10.8%)株,CA-MRSA 24(28.9%)株,P=0.003,两者之间有显著性差异;有11株MRSA即未检出(3005±5)m/z信号峰,也未检出(3035±5)m/z信号峰(图3),全部为HA-MRSA(表1)。
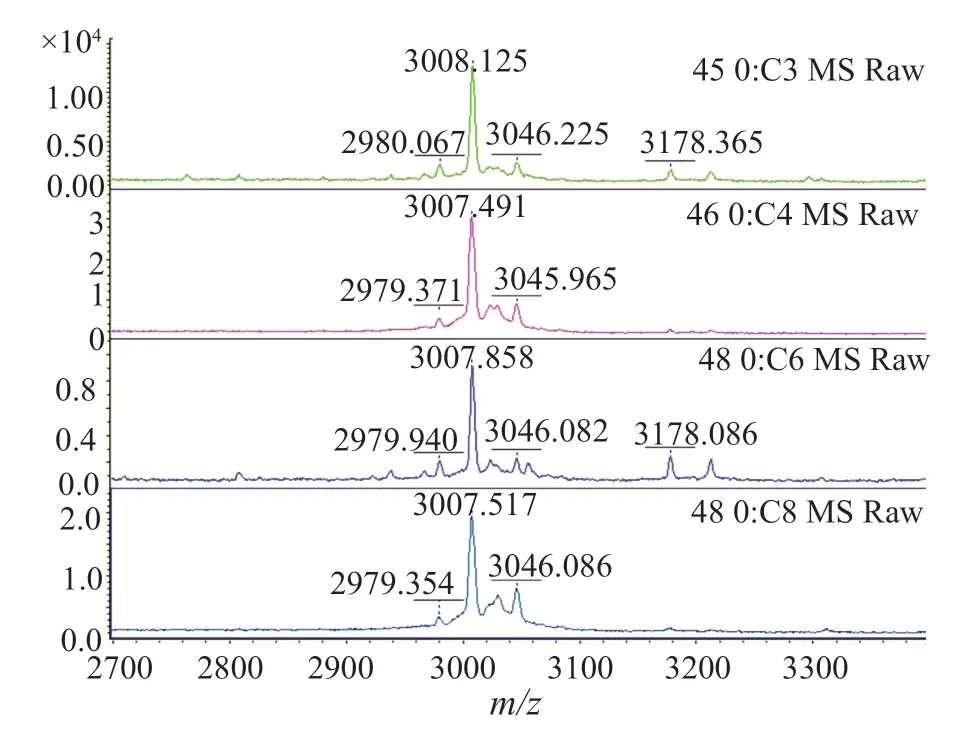
图1 δ-毒素野生型质谱峰(3005±5)m/zFig.1 The spectrum of the δ-toxin wild-type (3005±5m/z)
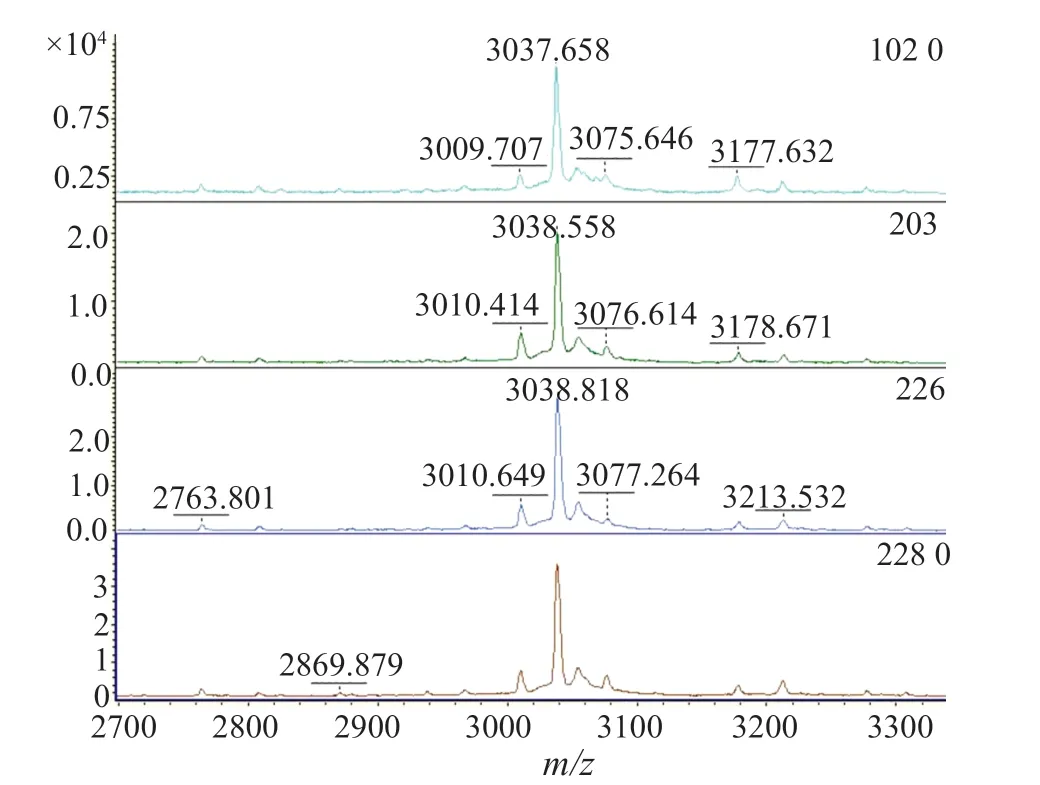
图2 δ-毒素G10S变异体质谱峰(3035±5)m/zFig.2 The spectrum of the δ-toxin G10S variant (3035±5)m/z
在spa分型中检出(3005±5)m/z信号峰的15(18.1%)株为t062型,8株为t015(9.6%)型,4株为t030(4.8%)株,2株为t071(2.4%)株,2株为t091(2.4%)株,另外8株其他spa分型;检出(3035±5)m/z信号峰的31(37.3%)株为t437型、2(2.4%)株t8660型(表2)。有11(113.%)株MRSA既未检出(3005±5)m/z信号峰也未检出(3035±5)m/z信号峰,spa分型中t062、t437、t899、t015、t071和t8660、未知分型分别为3株、2株、2株、其他各1株。
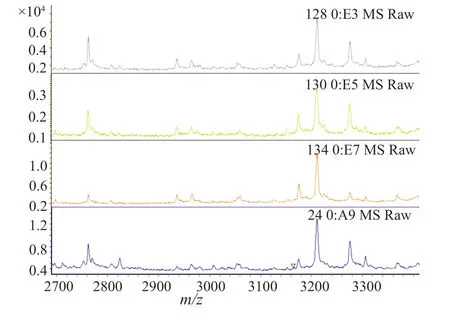
图3 未检出δ-毒素质谱图Fig.3 The spectrum of the δ-toxin negative
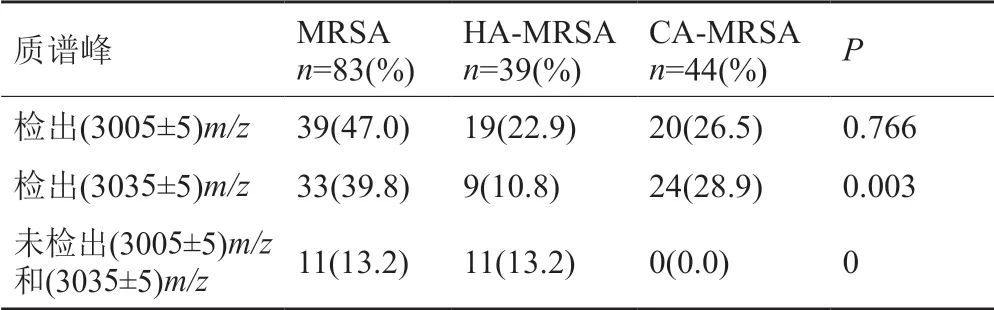
表1 HA-MRSA与CA-MRSA δ-毒素质谱峰差异Tab.1 Differences in mass spectrometry between HA-MRSA and CA-MRSA δ-toxin
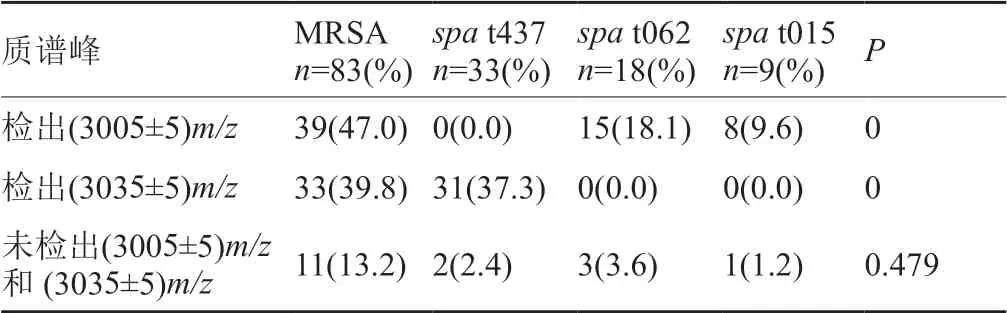
表2 主要spa分型δ-毒素质谱峰差异Tab.2 Differences in the mass spectrum of δ-toxin from the main spa type
2.3 (3035±5)m/z信号峰与spa t437型的关系
(3035±5)m/z为HldG10S的信号峰,本研究33株spat437型共31株检出(3035±5)m/z(图4),50株其他spa分型中,只有两株检出spat8660,检出(3035±5)m/z,使用仪器配套的做clinProTools 3.0软件做ROC曲线,曲线下面积0.89,P=0(图5)。
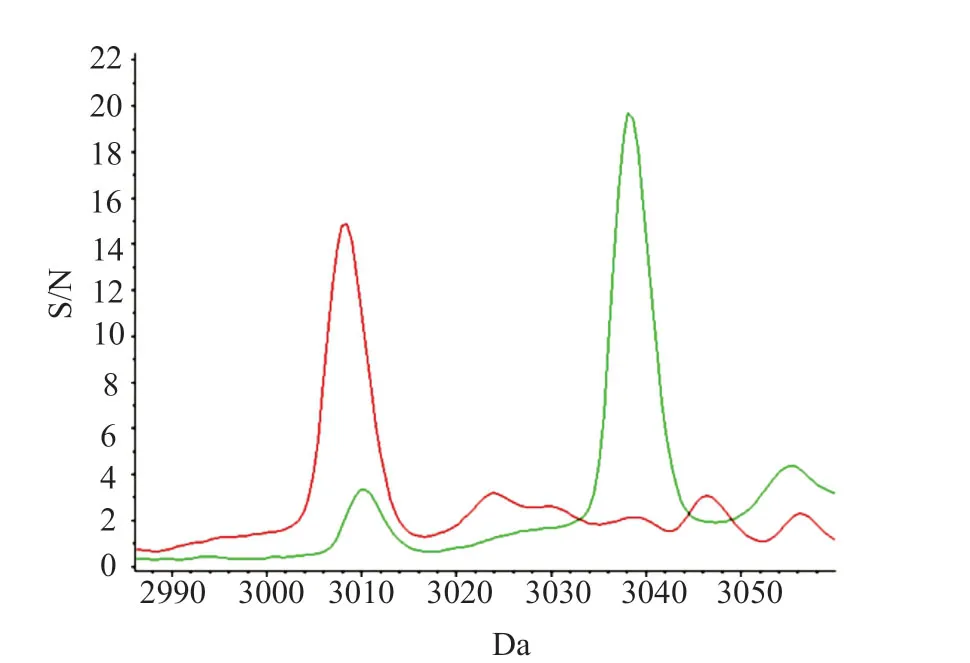
图4 spa t437与其他分型δ-毒素比较Fig.4 The differences in δ-toxin between spa t437 and other subtypes
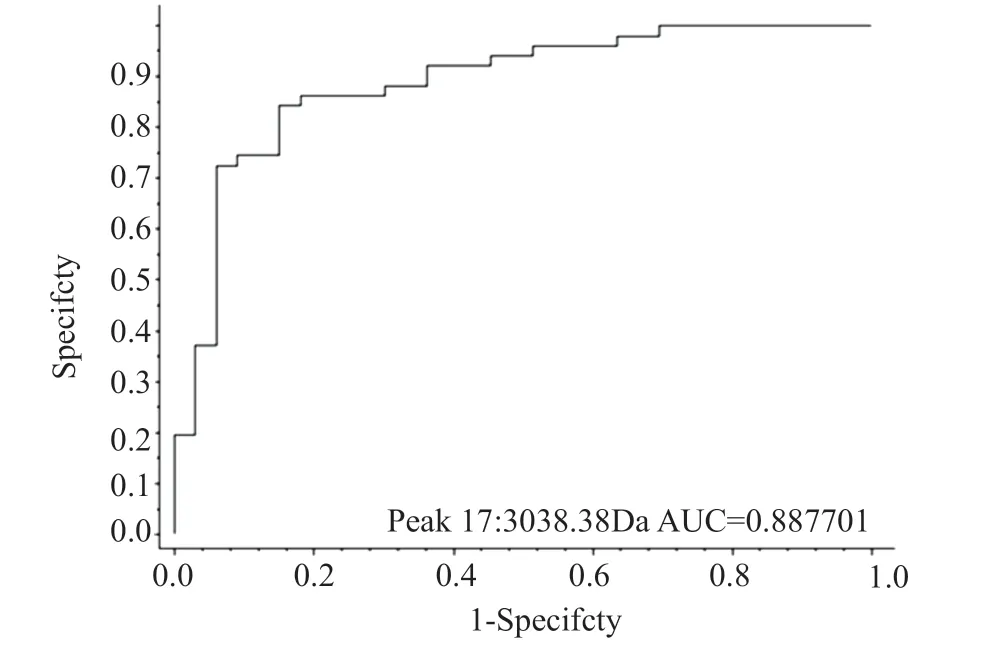
图5 spa t437特异性质谱峰(3035±5)m/z ROC曲线图Fig.5 The ROC curve of spa t437 specific MS peak (3035±5)m/z
2.4 未产生δ-毒素的菌株特征
MALDI-TOF MS检测共有11株MRSA未检出δ-毒素,均为HA-MRSA,SCCmec分型Ⅰ型1株,Ⅱ型2株,Ⅲ型8株;临床标本类型,有6株分离自骨关节标本,3株分离自呼吸道标本,1株分离自慢性溃疡的分泌物标本,1株分离自血液(表3)。
在血琼脂平板上生长特点,5株为正常的菌落形态及溶血特征,3株分离菌在血琼脂平板上为小菌落、溶血正常,2株分离菌在血琼脂平板上为小菌落且48h无明显溶血环,1株菌落大小正常但48h无明显溶血环。
3 讨论
MALDI-TOF MS技术通过分析待检菌蛋白质指纹图谱并与数据库中的质谱比较,对细菌进行分类鉴定,是目前为此最为有效的细菌鉴定方法[12],同时还能解决毒力因子测定、耐药标志物及菌种分型等临床相关问题[13]。
Gagnaire研究显示MALDI-TOF MS使用常规方法即可以快速检测金黄色葡萄球菌的δ-毒素,其质谱峰为(3005±5)m/z和(3035±5)m/z两种[6]。该毒力因子属于金黄色葡萄球菌核心基因组编码的毒力,对中性粒细胞和红细胞有溶解能力,但不如a-毒素和PSM-a3,动物感染实验显示其对疾病进展的作用比PSMα1-PSMα4低[14],但它可以触发肥大细胞脱颗粒,因些对皮肤感染和特应性皮炎的发展起显著作用[15]。而δ-毒素的同基因变异体(HldG10S)的致病性,表现为对细胞溶解作用和趋化作用下降,不引起肥大细胞脱颗粒。但是该变异体的出现有基因型特异性[9],本研究收集一家医院6个月分离的83株非重复MRSA,其中33株spat437型的MRSA中共31株检出HldG10S,ROC曲线下面积为0.89,而spat437型是我国健康人群中携带率最高的MRSA克隆[16],研究发现spat437型的克隆绝大部分属于ST59型[17-18], 该克隆是我国南方和邻近亚洲国家的CA-MRSA最常见的菌株。临床上CA-MRSA感染多见于无HAMRSA危险因素的患者,如健康儿童、运动员、监狱犯人等,常引起皮肤软组织感染、骨关节感染和败血症等;其更容易携带重要毒力杀白细胞素(PVL)[19], 同时也能促进核心基因组编码的毒力基因的表达,如PSMα、hla等[20],动物试验显示CA-MRSA具有相当大的逃避中性粒细胞吞噬的能力。近年来国内外相关研究发现有10%~80%的院内感染的患者感染的菌株具有CA-MRSA的分子特征[21-22],CA-MRSA的菌株已经播散到医院的环境中引起医院获得性相关感染。从流行病学角度HA-MRSA和CA-MRSA虽可采用美国疾病预防控制中心的CA-MRSA定义来初步区分,但在我国,患者的既往就医史往往不够完善,为了更精确地调查MRSA的流行特征,基于分子手段的基因分型法(如SCCmec分型、spa分型、MLST分型)使用更为普遍,但这些方法存在操作繁琐、成本昂贵等不足。本研究采用MALDI-TOF MS检测MRSA一次性获得蛋白指纹图谱,只要通过仪器配套软件查看是否检测出(3035±5)m/z这一信号峰,便可快速分辩出毒力更高的CA-MRSA,为及时有效的控制感染,改善患者预后提供病原学依据,这对以spat437型为主要CA-MRSA流行克隆的地区有重要的流行病学意义。
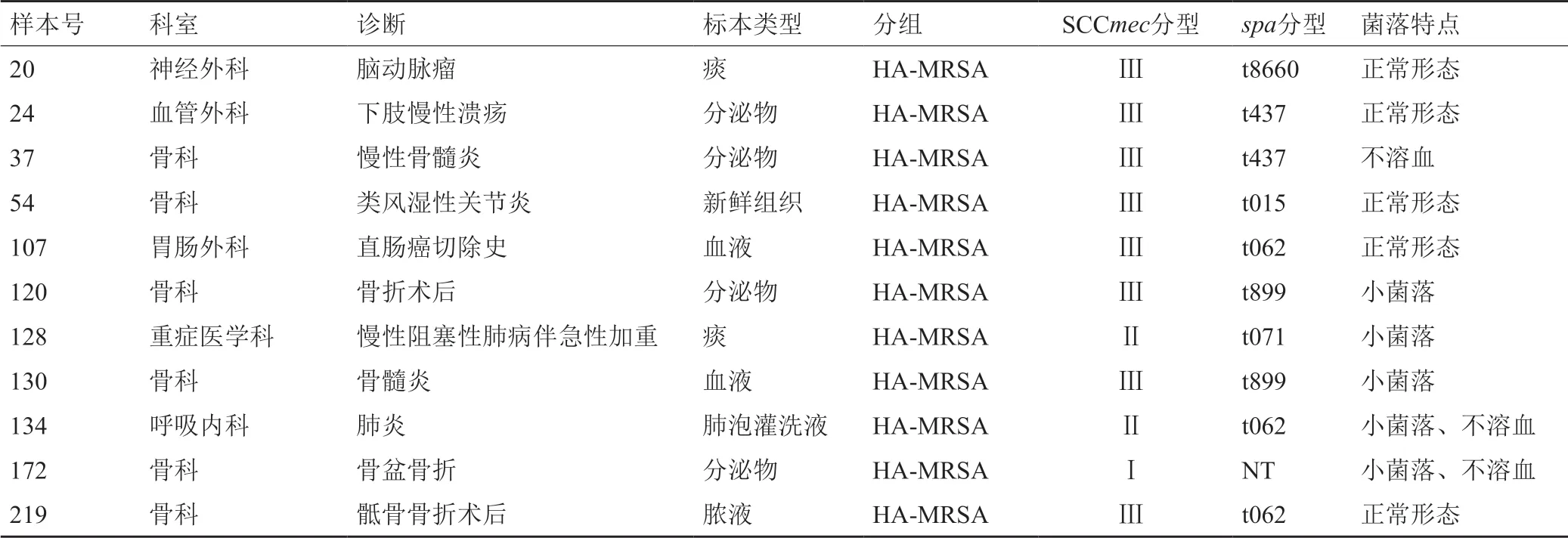
表3 MALDI-TOF未检出δ-毒素的菌株特征Tab.3 Characteristics of MALDI-TOF δ- toxin negative strains
agr调控系统是金黄色葡萄球菌最重要的调节系统,调控多种毒力因子的表达,RNAⅢ是agr调控系统的主要效应,同时也是δ-毒素的信使RNA。δ-毒素的产生可作为是金黄色葡萄球菌中agr调控系统在营养转运,氨基酸代谢和其他过程的功能替代标记[20]。通常认为在急性感染中需要的完整性的agr系统功能,而慢性感染agr功能障碍有关[21-22],使得部分毒力因子的表达量减少或消失。本研究共分析83株临床分离的MRSA,有11(13.3%)株δ-毒素阴性,而这些菌株均为HA-MRSA,SCCmec分型以Ⅲ型为主,主要为骨关节慢性感染分离菌。这些菌株在体内常形成生物被膜,且对多种抗生素耐药,在体外培养常表现为小菌落、β-溶血环变小或消失等特性。
综上所述,MALDI-TOF MS使用常规方法即可快速检测MRSA的δ-毒素,其质谱峰为(3005±5)m/z和(3035±5)m/z两种;(3035±5)m/z是δ-毒素的同基因变异体(HldG10S)的质谱峰,使用该信号峰可快速分辩出毒力更高的CA-MRSA,从而为及时有效的控制感染,改善患者预后提供病原学依据;未检出(3005±5)m/z和(3035±5)m/z两种质谱峰的菌株是agr调控系统失调的表现,这些菌株不表达δ-毒素,在临床上与慢性感染有关,体外培养可见小菌落形成、无明显β-溶血。
