核桃FLOWERING LOCUS T (JrFT)基因的克隆及表达分析
2019-05-05陈利娜夏小丛李好先曹尚银
王 企,陈利娜,夏小丛,敬 丹,李好先,骆 翔,曹尚银
(中国农业科学院 郑州果树研究所,河南 郑州 450009)
核桃(JuglansregiaL.)为胡桃科(Juglandaceae)胡桃属(Juglans)植物,是重要的木本油料树种,是世界著名的“四大干果”之一,因其较高的营养价值与经济效益,受到广大消费者的喜爱,在全球范围内广泛种植[1-2]。核桃原产于我国华北、西北地区,中南地区大部,华东地区北部以及四川和西藏东南等地区[3]。多数核桃品种具有雌雄异熟特性,先开雌花的称为“雌先型”;先开雄花的称为“雄先型”;雌雄同时开花的称为“雌雄同熟型”[4]。雌雄异熟的开花进程使得核桃的授粉率低,坐果率不高,质量和产量下降。要想解决这一问题,就要从研究核桃开花机制上着手。相关研究表明,FLOWERINGLOCUST(FT)基因能够在植物开花光周期反应过程中控制植物的开花时间,是调节植物成花的重要基因之一[5],属于PBEP家族基因的一员。FT基因编码约含175氨基酸残基的小分子量蛋白,称为成花素[6]。FT蛋白的序列及结构在不同植物种之间具有较高的保守性,其主要功能是调节植物成花[7]。对拟南芥(Arabidopsisthaliana)等模式植物开花的研究发现,拟南芥FT基因是一个决定开花时间的基因,由光周期诱导的CO(CONSTANS)直接转录激活表达,并在转录因子FLOWERINGLOCUSD(FD)的共同作用下激活开花特性基因AP1和LEAFY的表达,促进花的形成,在植物花发育中发挥着重要作用[8]。拟南芥中FT的超表达可使开花时间显著提前,其编码基因突变引起FT表达量降低则使开花时间推迟[9-10]。目前,已从多种植物如小麦[11]、雷竹[12]、荔枝[13]、山葡萄[14]、苹果[15]、小黑杨[16]、小叶杨[17]、桑树[18]、山核桃[19]、冬枣[20]、白桦[21]等中分离出FT的同源基因,并通过转基因证明FT基因过量表达可促进植物提早开花,其功能失活则会推迟开花[22]。但目前尚未有核桃FT基因的相关报道。本研究基于核桃花芽形态观察,以两个核桃品种(雌先型品种‘极早丰’、雄先型品种‘新早丰’)的3个时期(2月6日、3月21日、4月7日)的雌、雄花芽为试验材料,对核桃JrFT基因进行了克隆研究与表达分析,旨在进一步了解核桃雌雄异熟成花的分子机制,为研究核桃开花机制奠定理论基础。
1 材料与方法
1.1 试验材料
供试材料为中国农业科学院郑州果树研究所新乡实验基地干果实验田的两个核桃品种(雌先型品种‘极早丰’、雄先型品种‘新早丰’)7年生植株,进行常规管理栽培。从核桃参考基因组[23]下载核桃JrFT基因序列,设计引物,进行荧光定量RT-PCR,并扩增CDS序列。
1.2 试验方法
1.2.1 总RNA提取及反转录cDNA 根据外部形态观察,选择雌先型品种‘极早丰’与雄先型品种‘新早丰’2月6日、3月21日及4月7日的雌、雄花芽为试材,用CTAB法[24]分别提取两个核桃品种不同时期雌、雄花芽的总RNA,使用分光光度计检测浓度及跑电泳检测纯度。用全式金反转录试剂盒将提取的RNA反转录为cDNA。以核桃18SrRNA作为内参基因[25],设计引物(表1),进行PCR扩增,以检验cDNA的质量。

表1 引物设计及序列
注: N表示内参引物; F表示上游引物; R表示下游引物; Y表示荧光定量PCR引物; K表示基因克隆引物。下划线所标区域表示双酶切位点。
1.2.2 荧光定量PCR 对核桃雌先型品种‘极早丰’、雄先型品种‘新早丰’2月6日、3月21日及4月7日的雌、雄花芽JrFT基因的相对表达量进行分析。使用Roche荧光定量试剂盒进行荧光定量RT-PCR,分析3个不同时期核桃JrFT基因在两个核桃品种雌、雄花芽中的差异表达。荧光定量RT-PCR及基因扩增引物使用NCBI Primer Blast及Vector NTI软件设计,引物交由河南尚亚生物科技有限公司合成。计算方法采用2-ΔΔCT法[26]。使用SPSS软件分析差异显著性。
1.2.3 目的片段的扩增与检测 选择JrFT基因作为目的基因进行克隆。采用TransStart FastPfu Fly DNA Polymerase试剂盒及PCR扩增技术扩增JrFT基因, PCR反应体系和反应条件分别见表2和表3。使用2000 bp的DNA Marker与PCR产物同时进行跑电泳,检测是否扩增得到目的条带。
1.2.4 目的片段的回收与重组 使用天根普通琼脂糖凝胶回收试剂盒进行目的片段胶回收。回收后使用全式金pEASY-Blunt Zero Cloning Kit将产物与T载体连接,转化大肠杆菌感受态细胞。涂布在含有卡那霉素(kanamycin,10 μg/μL,50 μL/100 mL)的LB固体培养基平板上,涂板后放于37 ℃培养箱过夜培养。用10 μL枪头挑取10个白色单克隆菌落,接于装有750 μL含有卡那霉素的LB液体培养基的离心管中,放于37 ℃摇床上以225 r/min培养12 h;经菌液PCR扩增和电泳检测后,选择阳性克隆送河南尚亚生物技术有限公司进行测序。

表2 PCR反应体系

表3 PCR反应条件
1.2.5 目的片段测序分析及表达载体构建 测序委托河南尚亚生物技术有限公司完成。挑选测序正确的菌液提取质粒,将质粒与PBI121-GUS空载体同时进行双酶切(Xba-Ⅰ与Sma-Ⅰ双酶切);酶切后电泳验证条带,用T4连接酶连接,放于PCR仪中在25 ℃下连接10 min;转化大肠杆菌感受态细胞,在37 ℃培养箱过夜培养菌落;挑菌后摇菌,菌液经PCR后,选择阳性菌液测序。挑选测序正确的菌液提取质粒,电泳验证条带后,转化农杆菌GV3101,放于28 ℃培养箱中培养24~36 h。挑选单克隆菌落于含有卡那霉素的LB液体培养基中,在28 ℃摇床上过夜摇菌,菌液浑浊后,以35S为上游引物做菌液PCR,跑电泳验证表达载体构建成功与否。
1.2.6 目的片段的生物信息分析 利用NCBI BLAST对测序结果进行检索,使用DNAMAN 8.0进行序列分析和氨基酸翻译,在NCBI上下载21种植物的FT同源基因及其所编码的氨基酸序列,在Tair (http://www.arabidopsis.org)上下载拟南芥所有6个PEBP家族蛋白氨基酸序列,使用MEGA 7.0进行多序列比对以及构建系统进化树;利用ProtParam在线软件(http://web.expasy.org/protparam/)对21种植物的FT蛋白进行分析,同时通过Protscale在线软件(http://web.expasy.org/protscale/)分析核桃FT蛋白的亲水性。
2 结果与分析
2.1 目的基因的表达分析
由图2可知,JrFT基因在普通核桃雌先型‘极早丰’与雄先型‘新早丰’雌、雄花中均有表达,在本试验的3个取样时期,两个核桃品种JrFT基因在雌、雄花芽中的表达模式相同,JrFT基因在雌先型品种‘极早丰’和雄先型品种‘新早丰’雌、雄花芽中的表达量有所差异。
在2月6日(时期Ⅰ),雄先型品种‘新早丰’雌花芽中JrFT基因的表达量极显著(P<0.01)高于雌先型品种‘极早丰’的(图1A),是雌先型品种‘极早丰’雄花芽的23倍;同样JrFT基因在雄花芽的表达量与雌花芽中相似,雄先型品种‘新早丰’雄花芽中JrFT基因的表达量极显著(P<0.01)高于雌先型品种‘极早丰’的(图1B),是‘极早丰’雌花芽的60倍。
在3月21日(时期Ⅱ)与4月7日(时期Ⅲ),JrFT基因在两个品种核桃雌、雄花芽中的表达量差异不大(图1A~图1B)。在这两个时期,对雌花芽来说,JrFT基因在雌先型品种‘极早丰’雌花芽的表达量稍高于雄先型品种‘新早丰’,但并没有出现显著差异(图1A)。对雄花芽来说,JrFT基因在雄先型品种‘新早丰’雄花芽的表达量稍高于雌先型品种‘极早丰’,但未出现显著差异(图1B)。
2.2 JrFT基因的克隆与表达载体的构建
PCR产物经跑电泳后,将其放于紫外分光光度仪与2000 bp的marker对比,发现得到了500 bp左右的特异性谱带,且谱带很亮(图2A)。连接T载体转化后,挑取单克隆进行菌液PCR,跑电泳发现得到约500 bp的特异性谱带(图2B)。测序正确后提取质粒,与PBI121-GUS载体同时进行X-ba Ⅰ及S-ma Ⅰ双酶位点酶切,电泳验证得到500 bp左右的条带(图2C)。回收质粒后与PBI121-GUS载体连接,15000 bp的marker跑电泳得到明显的条带(图2D)。转化GV3101农杆菌,菌液PCR后电泳得到500 bp左右的条带(图2E)。

A、B分别为两个核桃品种的雌、雄花芽;时期Ⅰ、Ⅱ、Ⅲ分别代表取样日期为2月6日、3月20日及4月7日;“**”表示显著性差异(P<0.01)。
图1 两个核桃品种雌、雄花芽JrFT基因在3个时期的表达量
2.3 基因序列与同源性分析
2.3.1 序列分析 测序结果表明,从核桃花芽中克隆获得的片段长度为525 bp,编码174个氨基酸(图3)。在NCBI上进行BLAST,发现该片段与其他多种植物FT同源基因的相似性在80%以上(图4)。通过DNAMAN 8.0对多个物种的FT蛋白氨基酸序列进行比对,发现均含有1个高度保守的PEBP蛋白结构域(图5)。其中,克隆目的片段预测编码氨基酸序列与拟南芥FT蛋白氨基酸序列的相似性为75.74%,由此确认克隆所得片段为FT基因在核桃中的同源基因,并命名为JrFT基因。序列比对分析发现,核桃JrFT蛋白氨基酸序列与欧洲栓皮栎QsFT蛋白氨基酸序列的相似性为93.06%,与光皮桦BlFT蛋白和欧洲山毛榉FsFT蛋白氨基酸序列的相似性均为91.33%,与白桦BpFT蛋白氨基酸序列的相似性为90.75%,与黑杨PnFT蛋白氨基酸序列的相似性为88.44%,与胡杨PeFT蛋白氨基酸序列的相似性为84.39%,与拟南芥AtFT蛋白氨基酸序列的相似性为75.74%。
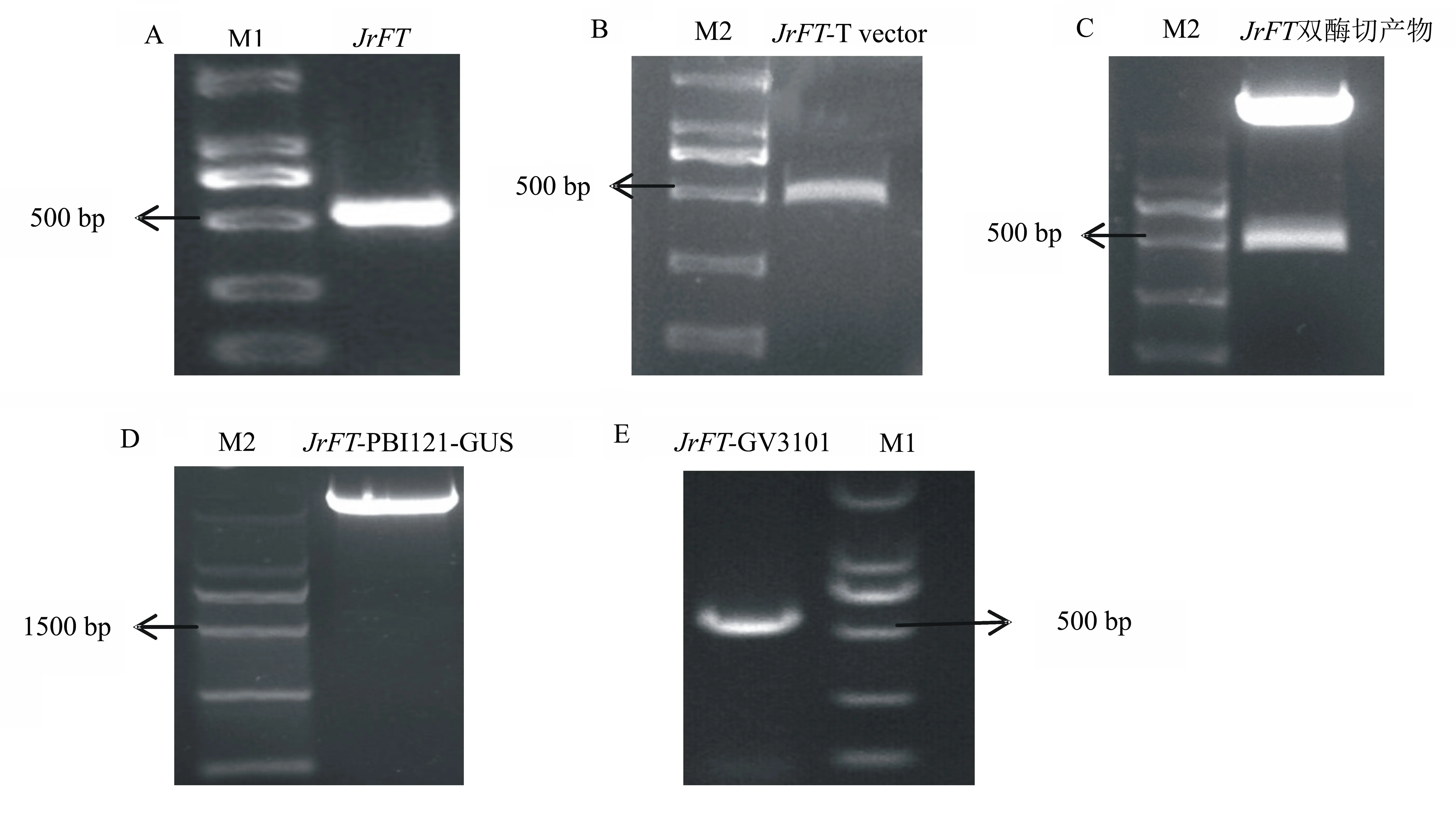
A为核桃花芽JrFT基因特异片段扩增产物电泳图;B为T载体转化菌液PCR电泳图;C为双酶切产物电泳图;D为表达PBI121-GUS载体电泳图;E为农杆菌转化菌液电泳图;M1为2000 bp DNA marker;M2为15000 bp DNA marker。
图2 构建表达载体的电泳图
2.3.2 基因系统进化分析 将核桃JrFT基因编码的氨基酸序列与拟南芥PEBP家族基因编码的氨基酸序列进行序列进化分析,结果发现核桃JrFT蛋白与拟南芥FT和TSF基因的亲缘性最近(图6)。同时与其他植物FT基因编码的氨基酸序列进行序列进化分析,结果发现核桃JrFT蛋白与欧洲栓皮栎QsFT蛋白的亲缘性最近,与枣ZjFT蛋白、哥伦比亚锦葵HuFT蛋白、光皮桦BlFT蛋白及白桦BpFT蛋白的亲缘关系较近(图7)。
2.4 FT蛋白结构及功能预测
核桃JrFT基因共编码174个氨基酸,如图8所示,缬氨酸(V)、精氨酸(R)和甘氨酸(L)在JrFT基因编码的氨基酸中所占比例居前3位,分别达10.9%、9.8%和8.6%。JrFT蛋白的等电点为6.73,分子量为19576.13,含有19个带负电荷的氨基酸残基数(Asp+Glu)、19个带正电荷的氨基酸残基数(Arg+Lys),其分子式为C872H1350N250O255S5,总原子数为2732。当全部Cys形成为胱氨酸时,其消光系数为1.101;当不能形成胱氨酸时其消光系数为1.095。其亲水性总平均值为-0.328。

图3 核桃JrFT的CDS全长以及所编码的氨基酸序列

图4 核桃JrFT与其它FT同源基因编码的氨基酸序列比对
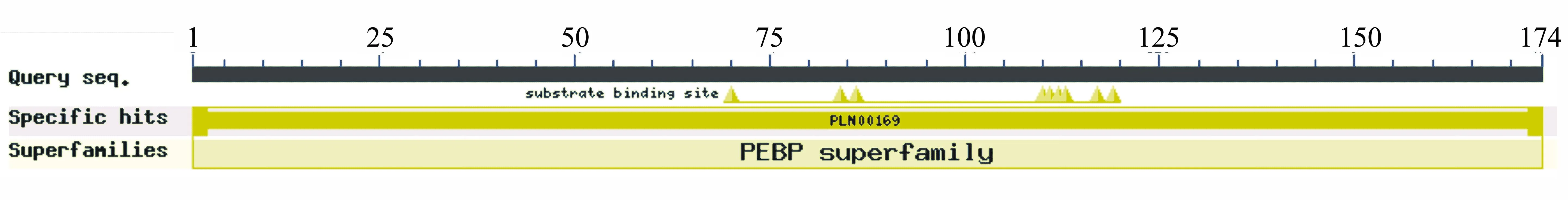
图5 核桃JrFT蛋白结构域预测
其余20种植物FT蛋白的不稳定指数、脂肪族氨基酸指数和亲水性总平均值如表4所示,其中龙眼的脂肪族氨基酸指数最低,为72.70;水稻的脂肪族氨基酸指数最高,为87.26;核桃的脂肪族氨基酸指数居中位。不稳定指数最低的是核桃,最高的是拟南芥,表明核桃与其他植物相比较为稳定。本研究中多种植物FT蛋白的亲水性总平均值为负值,其中菠萝的亲水性最低,而黑杨的亲水性最高,核桃位居中位。上述结果均表明植物FT蛋白为亲水性的脂溶性蛋白质。
通过Hphob./Kyte&Doolittle方法对核桃JrFT基因编码蛋白序列的疏水性进行分析,结果如图9所示,该蛋白为亲水性蛋白,与理化性质中的预测结果一致。第156个氨基酸(V)的得分最高,为1.884;第141个氨基酸(F)的得分最低,为-2.422;大多数氨基酸的得分为负值。上述结果表明核桃JrFT基因编码的多肽链为亲水性蛋白。

图6 核桃JrFT与拟南芥PEBP家族蛋白氨基酸序列进化分析

图7 核桃JrFT与其它植物FT蛋白氨基酸序列进化分析

图8 核桃JrFT基因编码蛋白氨基酸的组成成分
3 讨论
现有的研究结果表明FT基因在植物开花过程中起着重要作用。FT基因作为高等植物开花信号调控中一个重要的整合因子,它通过调控花原基特异性基因的表达来启动花原基的分化。目前,对于核桃属植物雌雄异熟开花机制的研究不够深入,仅进行了核桃或山核桃一些开花基因同源基因如MADs-box[27-28]、LEAFY[29-32]、AP1[33]、FLC[34-35]等的初步研究。本研究利用实时荧光定量PCR技术研究了核桃JrFT基因在2个普通核桃品种不同时期雌、雄花中的差异表达,结果表明,核桃JrFT基因在普通核桃雄先型与雌先型品种3个时期的雌、雄花中均有表达,且表达量有明显的差异。此研究结果与温腾健等[36]在新疆核桃上的研究结果一致。

表4 不同植物FT蛋白的信息
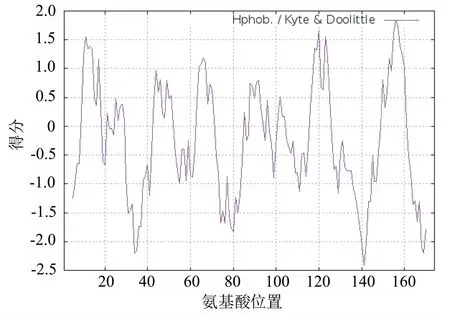
图9 核桃JrFT蛋白的疏/亲水性分析结果
JrFT基因在核桃雌先型品种‘极早丰’与雄先型品种‘新早丰’的雌、雄花中都有表达,且表达量有所差异,表明JrFT基因在核桃开花过程中起到关键作用。这与徐维华等[37]研究山葡萄得出的结果“VvFT基因在山葡萄雌花和雄花中都有表达”一致。在本研究中,在2月6日,JrFT基因在雄先型品种‘新早丰’雌、雄花芽中的表达量均高于雌先型品种‘极早丰’,鉴于雌先型品种‘极早丰’的雌花先于雄先型品种‘新早丰’开放,而雄先型品种‘新早丰’的雄花先于雌先型品种‘极早丰’开放,可能JrFT基因在开始阶段对核桃雌花开放具有一定的抑制作用,可能在核桃花发育过程中对雄花具有更明显的促进作用。陈芳芳等在山核桃CcFT基因的研究中指出该基因可能在诱导雄花芽的形成中起关键作用;山核桃于4月上旬开始展叶后,叶片接受光信号可能引起CO的表达,并促进FT的表达,从而启动雄花芽的分化[19]。本研究发现,在3月21日与4月7日,JrFT基因在雄先型品种‘新早丰’雌花芽中的表达量远远小于2月6日在雌花芽中的表达量,这可能说明JrFT基因在雌花芽后续开放过程中的抑制作用逐渐减小。相较于雄先型品种‘新早丰’,雌先型品种‘极早丰’在3个时期的JrFT表达量均很低,可能其雌花芽受到JrFT基因的抑制作用小,因此雌花先于雄先型‘新早丰’开放。而对于3月21日与4月7日的雄花芽,雌先型品种‘极早丰’JrFT的表达量稍高于雄先型‘新早丰’,可能JrFT逐渐开始表达,从而促进了雄花芽的开放。
克隆所获得的核桃JrFT基因序列经过测序及生物信息学分析发现,与其他植物的FT同源基因具有极高的相似性,与多种木本植物FT同源基因的相似性达到80%以上,说明该基因的保守性较高,即可通过较高同源性的基因推导该基因的功能。同时核桃JrFT蛋白和其他植物FT蛋白在氨基酸序列和蛋白结构上具有高度的相似性,其中与几个木本植物FT蛋白的同源性高达90%以上。这一结果与陈芳芳等[19]在对山核桃CcFT基因的克隆与分析中得出的结论一致。
用NCBI Conserved domains CD-Search对核桃JrFT蛋白氨基酸序列的结构域进行预测,发现其含有高度保守的PEBP蛋白结构域。与拟南芥6个PEBP家族蛋白氨基酸序列进行系统进化分析发现,核桃JrFT蛋白与拟南芥FT与TSF蛋白的亲缘关系最近。多物种FT蛋白氨基酸序列系统发育树结果表明,核桃JrFT蛋白与欧洲栓皮栎QsFT蛋白的亲缘关系最近,与枣ZjFT蛋白的亲缘关系较近,与拟南芥FT等蛋白的亲缘关系较远。通过观察核桃JrFT转化模式植物拟南芥的表型能初步验证JrFT基因的功能。朱燕宇[17]通过将小叶杨PsFT基因转化拟南芥和烟草,发现PsFT基因能使拟南芥和烟草提早开花。丁峰[13]通过将荔枝LcFT基因转化烟草,发现转基因烟草显著提早开花。
FT基因在整个植物开花调控路径中起着至关重要的作用,同时也密切影响着其他开花基因。但到目前为止,核桃JrFT基因在核桃开花进程中对于雌、雄花芽具体如何行使功能,还未能有一个准确的定论,仍需进一步的探究。
4 结论
本研究克隆获得的核桃JrFT基因的CDS序列长度为525 bp,编码174个氨基酸,含有高度保守的PEBP蛋白结构域,其编码产物为一种亲水性的脂溶性蛋白质,且与其他植物FT同源蛋白相似性高。JrFT基因在核桃雌先型与雄先型雌、雄花芽中都有表达,但表达模式不同。在同一时期JrFT基因在核桃雌先型与雄先型雌、雄花芽中的表达量有所差异。在研究的3个时期(2月6日、3月21日及4月7日),JrFT基因在雌花芽中的表达模式是雄先型品种先高于雌先型品种,然后低于雌先型品种;在雄花芽中的表达模式是雄先型品种一直高于雌先型品种。因此JrFT基因可能在核桃开花进程中起到关键作用,且可能对雄花开放有一定的促进作用。
