“鲜人参膏”对APAP致小鼠肝损伤的保护作用
2019-04-28沙纪越李健豪林向辉刘喜峰林晓熙
沙纪越 ,李健豪 ,林向辉 ,刘喜峰 ,林晓熙 ,刘 伟 ,李 伟
(1.吉林农业大学中药材学院,长春130118 2.辽宁熙峰药业集团有限公司,桓仁117000)
对乙酰氨基酚(APAP)又称扑热息痛,在临床上广泛应用于解热和镇痛[1~2],在治疗剂量范围内相对安全,但在大量临床数据监测表明过量的APAP会导致严重的副作用,最常见的会导致不可逆肝毒性[3]。APAP在数百种处方药和非处方药中的广泛应用,导致了大量患者因此而受到伤害[4~5]。
人参为五加科人参属植物人参(Panax ginseng C.A.Meyer)的干燥根及根茎,是历史悠久的特色中草药,始载于《神农本草经》,可安神益智,生精养血,复脉固脱,久服轻身延年,享有“百草之王”的美誉[6~8]。人参的主要活性成分为人参皂苷,具有抗肿瘤、降低化疗药物的心脏毒性和肝毒性、保护中枢神经系统和心血管系统、抗疲劳、降血糖、修复创面等广泛药理作用[9~11]。随着人参的多重功效被证实,为了更好地开发利用人参的药用价值,人们开始对人参进行深加工,并开发了一系列的人参加工制品[12]。
膏剂,属于中医传统剂型之一[13]。膏剂一般由多味中药组成,将药物用水或植物油煎熬浓缩而成的膏状剂型[14],常采用通补兼施,动静结合的方法,更易于人体吸收,兼具治疗和滋补的特点。鲜人参膏(Fresh Ginseng Paste,FGP)精选自然生长于林间的5年生优质新鲜林下参,配以优质红枣精华,采用世界先进的冷链工艺技术,鲜人参原浆提取,经专利配方及多道杀菌工序秘制而成,可充分保留了人参活性成分和营养物质。利用独有的专利技术[15],全成分使用新鲜人参,在最大限度保留天然原生皂苷的同时,创造性的生成以R-Rg3为代表的16种稀有人参皂苷组分群和氨基酸、人参多糖、人参蛋白等18种活性物质。同时,通过酶促反应增加美拉德反应产物精氨酸双糖苷AFG的生成。
人参加工产品由于其富含人参皂苷并具有显著的生理活性,更易于消化吸收,一直是国内外学者研究的热点,研究发现人参皂苷还具有抗高脂血症及清除氧自由基的作用[16~17],本文首次利用人参加工品“鲜人参膏”探讨其对APAP诱导小鼠肝损伤的保护作用及其可能机制,为深度开发人参类加工产品及对肝损伤保护治疗剂提供理论依据和物质参考。
1 材料与方法
1.1 HPLC检测FGP中人参皂苷分析
精密称取人参总皂苷标准品5 mg,加甲醇配置成人参皂苷的质量浓度分别为1.00 mg/mL的对照品溶液,经0.22 μm滤膜滤过。精密称取FGP 5 g,加入50 ml甲醇,超声30 min,浓缩后加甲醇定容至10 ml经0.22 μm滤膜滤过作为待测品溶液,取部分样品进行HPLC分析,色谱柱为C18柱 (250 mm×4.6 mm,5 μm);柱温 30 ℃,检测波长 203 nm,流动相乙腈(A)-水(B)梯度洗脱(0~20 min,18.5%~20.5%A;20~30 min,20.5%~25.5%A;30~40 min,25.5%~35%A;40~60 min,35%~45%A;60~70 min,45%~60%A;70~80 min,60% ~70%A;80 ~90 min,70% ~80%A;90 ~91 min,80%~18.5%A;91~95 min,18.5%A), 流速 1.0 mL/min,进样量 20 μL。
1.2 实验动物
SPF级雄性ICR小鼠32只,体质量22~25g,由长春市亿斯实验动物技术有限责任公司提供,合格证号:SCXK(吉)2016-0003。动物饲养条件符合实验动物福利伦理委员会的要求,小鼠自由进食和饮水,室温23.0±2.0℃,湿度55%~65%,明暗交替12h的环境中适应性饲养,饲养1周后开始实验。
1.3 药品和试剂
鲜人参膏(Fresh Ginseng Paste,FGP),辽宁熙峰药业集团有限公司生产,合格证号:SC10721052200667;APAP(质量分数>98%,批号:D1513003,阿拉丁试剂有限公司);苏木素-伊红染液(H&E),丙氨酸转移酶 (ALT)、天冬氨酸转移酶(AST)、丙二醛(MDA)及谷胱甘肽(GSH)试剂盒,购于南京建成生物工程有限公司;乙腈,TEDIA公司;色谱纯甲醇(MEOH)、乙醇(ETOH),北京化工厂,分析纯;水为超纯水,所有其他试剂均为分析级。
1.4 仪器
PL303电子天平,上海梅特勒托利多仪器有限公司;HC-2517高速离心机,安徽中科中佳科学仪器有限公司;拓宇衡器电子天平,沈阳拓宇衡器有限公司;T10高速组织匀浆机,德国IKA;SPECTRO star Nano全波长扫描式酶标仪,德国BMG LABTECH公司;显微镜Leica DM 500和Leica DM 2500荧光显微镜,德国徕卡。
1.5 动物分组和给药
将ICR小鼠进行适应性饲养1周后,随机分为4组(n=8);FGP 药品置于羧甲基纤维素钠(CMC-Na)溶液中分别配置成低剂量组(400 mg/ml)和高剂量组(800 mg/ml),正常对照组和模型组给予同样剂量的生理盐水。各组在给药前均称量小鼠体重,以调整给药剂量。所有小鼠连续给药7天。其中第7天给药1h后,模型组、FGP低、高剂量组一次性腹腔注射APAP 250 mg/kg-1,24 h后眼球取血,血液室温凝结 1 h后4℃离心 (3 500 r/min,10 min),取上清供血清指标ALT和AST检测。取肝脏组织溶于生理盐水中制成肝匀浆用于检测GSH和MDA水平,取相同部位的肝组织固定于10%甲醛中,用于肝组织切片观察病理变化。
1.6 体质量变化和脏器系数的测定
计算实验结束前与给药前小鼠体质量的差值,记为体质量变化值。小鼠处死后立即取新鲜肝组织称重,并计算肝指数=(肝质量/体质量)×100。
1.7 H&E染色
将肝组织固定于 10%甲醛中,石蜡包埋切片,将切片放入二甲苯中脱蜡30 min,再放入无水乙醇中30 min,依次放入 95%、70%、50%乙醇中 3 min水化,最后放入蒸馏水中 5 min,加入苏木素,1 min后流水冲洗返蓝,返蓝后依次放入50%、70%、95%乙醇中各3 min,滴加伊红,1 min后放入无水乙醇,5 min后放入二甲苯中保持 30 min,滴加树脂,盖玻片封片,光镜下观察肝组织切片的病理变化。
1.8 统计学方法
2 结果
2.1 HPLC法检测FGP中化学成分分析
经HPLC法在FGP中检测到22种人参皂苷类成分:Rg1,Re,Rb1,Rc,Rb2,Rd,(S)-Rg2,(R)-Rg2,(S)-Rh1,(R)-Rh1,Rg6,F4,Rk3,Rh4,(S)-Rg3,(R)-Rg3,Rk1,Rg5,(S)-Rh2,(R)-Rh2,原人参二醇(PPD),原人参三醇(PPT).等(图1),其中稀有人参皂苷总含量大于620 mg/100g。

图1 HPLC色谱图:人参总皂苷标品(A)和FGP(B)。1:Rg1 2:Re 3:(S)-Rg2 4:(R)-Rg2 5:(S)-Rh1 6:(R)-Rh1 7:Rb1 8:Rc 9:Rb2 10:Rd 11:Rg6 12:F4 13:Rk3 14:Rh4 15:(S)-Rg3 16:(R)-Rg3 17:Rk1 18:Rg5 19:(S)-Rh2 20:(R)-Rh2 21:PPT 22:PPD
2.2 FGP对APAP致肝损伤小鼠体重及脏器系数的影响
正常对照组小鼠生长情况良好,毛顺色亮,体质量增加。与正常对照组相比,APAP组毛色成缕,毛发无光,体质量有明显减轻,并无小鼠死亡,脾脏系数有显著降低(P<0.01),肝脏系数有显著升高(P<0.05),充分表明小鼠的肝受到损伤。与APAP组相比,FGP低剂量组(400mg·kg-1)和高剂量组(800mg·kg-1)小鼠毛色明显好转,体质量下降得到缓解,低剂量组(400 mg·kg-1)脾系数降低以及高剂量组(800mg·kg-1)肝系数升高的幅度都得到明显改善(P<0.05)。

表1 .FGP对APAP诱导的急性肝损伤小鼠器官指数的影响
2.3 FGP对小鼠血清指标的影响
ALT和AST是肝损伤的主要酶标记物,当肝细胞受到损伤时,这些标记物会从肝脏渗漏到血液中,从而导致二者血清浓度急剧升高。如图2所示,与对照组比较,模型组小鼠血清中ALT和AST的水平显著升高(P<0.05),GFA低、高剂量组能够明显抑制血清中 ALT和 AST水平的升高(P<0.05),且存在一定的剂量效应关系。初步说明FGP对APAP所致的肝损伤具有一定的保护作用。

图2 .FGP对APAP诱导的急性肝损伤小鼠血清ALT和AST水平的影响。所有数据均表示为平均值±S.D.,n=8.**P﹠0.01,相对于正常组;与顺铂组相比,#P﹠0.05,##P﹠0.01
2.4 FGP对小鼠肝脏中GSH和MDA的影响
为进一步说明FGP的药理作用,我们对小鼠肝脏内的GSH和MDA水平进行检测,如图3所示,模型组中小鼠肝组织匀浆中的GSH水平明显低于对照组(P﹠0.05,P﹠0.01),而低、高剂量的FGP显著地抑制了GSH水平的降低。另外,MDA水平能充分说明组织的脂质过氧化产物的多少,直接说明细胞受损程度[18]。结合本实验可知,与对照组比较,模型组的MDA量明显升高(P﹠0.05,P﹠0.01),FGP低、高剂量组则明显抑制了肝组织中MDA水平的升高。以上数据说明FGP能够提高肝组织抗氧化能力以及减缓APAP对肝细胞产生的脂质过氧化作用。


图3 .FGP对APAP诱导的急性肝损伤小鼠肝脏GSH和MDA水平的影响。所有数据均表示为平均值±S.D.,n=8.**P﹠0.01,相对于正常组;与顺铂组相比,#P﹠0.05,##P﹠0.01
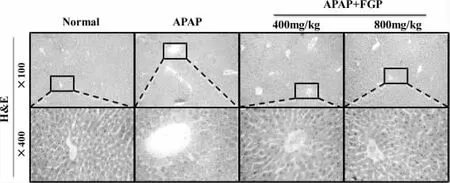
图4 .FGP对APAP诱导的急性肝损伤小鼠肝组织病理变化的影响
2.5 FGP对小鼠肝组织病理变化影响
如图4所示,对照组小鼠肝组织细胞排列整齐且形态正常。模型组肝组织中央静脉附近细胞大面积坏死,坏死处可见无核肝细胞残体,肝窦扩张充血,伴有部分细胞变性肿胀和细胞炎性浸润,部分凋亡细胞有明显的点状和灶状坏死。FGP低、高剂量组细胞坏死程度减轻,炎性细胞浸润减轻,FGP高剂量组细胞坏死显著减轻,肝细胞排列比较规律。
3 讨论
研究结果显示,APAP诱导小鼠血清中 AST和ALT水平显著升高、肝组织中GSH水平降低和 MDA水平升高,使肝细胞肿胀,排列疏松,细胞核部分消失或坏死,说明造模成功;FGP低、高剂量组与模型组相比,血清中 AST、ALT水平降低,肝组织中 GSH升高和MDA水平降低,显示FGP可以缓解APAP造成的肝损伤。 研究表明,当肝组织损伤时,细胞中产生大量 N-乙酸-对苯醌亚胺(NAPQI),与 GSH 结合,导致GSH量下降,细胞中超氧负离子歧化作用导致大量活性氧生成,对细胞产生氧化应激作用[19]。本研究结果显示,FGP低、高剂量组中 GSH量升高,MDA量降低,说明 FGP具有明显的抗氧化作用。由H&E染色结果可知,模型组肝细胞坏死、肿胀,部分细胞发生炎性浸润,FGP低、高剂量组细胞坏死程度减轻,炎性细胞浸润减轻,进一步说明FGP能显著抑制细胞凋亡。本研究采用新型的人参加工品“鲜人参膏”,通过APAP所致的肝损伤,对FGP的药效学研究进行探索,初步揭示FGP对APAP诱导肝损伤具有保护作用,其可能的机制与抑制氧化应激和细胞凋亡,减少炎症反应有关。本研究进一步拓宽药食同源药材的使用范围,为人参及相关产品的深度开发提供物质参考,并结合药效学研究为FGP临床应用提供理论依据。
