沉默信息调节因子3在丹酚酸A抗紫外线诱导视网膜色素上皮细胞氧化应激性损伤中的作用及机制
2019-04-28李霞王彦方陈战巧俞颂平
李霞,王彦方,陈战巧,俞颂平
(温州医科大学附属第五医院 眼科,浙江 丽水 323000)
老年性黄斑变性(age-related macular degeneration,AMD)是一种以布鲁赫膜和视网膜色素上皮(retinal pigment epithelium,RPE)之间玻璃膜疣堆积为特征、以视力不可逆性下降为表现的老年性眼部疾病[1]。研究认为AMD的发生与新生血管形成、炎症反应、氧化应激性损伤、自身免疫反应等有关[1]。过度紫外线照射已被认为是AMD发生的外在因素,能够诱发RPE细胞内活性氧(reactive oxygen species,ROS)增加,激发细胞内氧化应激性损伤,且清除细胞内ROS,能够有效降低紫外线诱导的RPE损伤[2-3]。我们前期研究证实丹酚酸A(salvianolic acid A,Sal A)作为一种氧化清除剂[4-5],对紫外线诱导RPE氧化应激性损伤具有保护作用[3],但其具体分子机制仍未完全明确。沉默信息调节因子3(silent information regulator 3,SIRT3)是一种NAD+依赖的 III型组蛋白去乙酰化酶(histone deacetylase,HDAC),在人类RPE细胞中呈高表达,参与RPE的多种生物学功能,尤其与RPE氧化应激损伤密切相关[6]。本研究进一步探讨SIRT3在Sal A抗紫外线诱导的ARPE-19细胞损伤的分子机制,为应用Sal A预防和治疗AMD提供科学根据。
1 材料和方法
1.1 主要试剂 Sal A(货号:96574-01-5)购自上海阿拉丁公司,DMEM培养基、青霉素-链霉素双抗、FBS、胰蛋白酶购自英国Gibco公司,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐、二甲基亚砜购自美国Sigma公司;SIRT3、超氧化物歧化酶2(superoxide dismutase 2,SOD2)、Bax、bcl-2、cleaved-Caspase3、Cyt c和β-actin单克隆抗体购自美国Cell Signaling Technology公司。ROS检测试剂盒购自北京Solarbio公司,CuZn/Mn-SOD活性检测试剂盒(WST-8法)和Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术公司,si-SIRT3、si-RNA购买于美国Santa Cruz公司。
1.2 细胞培养与分组 将人ARPE-19细胞(购自中国科学院细胞库)培养种植于含10% FBS、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养基,取对数生长细胞进行实验。取1×105接种于96孔板或1×106个细胞接种于6孔板中,将ARPE-19细胞按照不同处理条件分组:对照(Sal A)组、UV(30 mJ/cm2紫外线照射)组、5 μmol/L Sal A(5 μmol/L Sal A预处理30 min后30 mJ/cm2紫外线照射)组、25 μmol/L Sal A(25 μmol/L Sal A预处理30 min后30 mJ/cm2紫外线照射)组、50 μmol/L Sal A(50 μmol/L Sal A预处理30 min后30 mJ/cm2紫外线照射)组。
1.3 细胞转染 按细胞密度为5×105个/孔接种于6孔板,待细胞融合至80%左右时,将5 μL阴性si-RNA和si-SIRT3质粒与5 μL Lipofectamine 2000试剂(美国Invitrogen公司)混合于200 μL无FBS、无双抗培养基,加入ARPE-19细胞,置于37 ℃培养箱中过夜,次日更换含有10% FBS、双抗的新鲜培养基,继续培养48 h。按照转染情况将细胞分为对照(Sal A)组、UV(30 mJ/cm2紫外线照射)组、Sal A+UV(50 μmol/L Sal A预处理30 min后30 mJ/cm2紫外线照射)组、Sal A+UV+阴性si-RNA(经si-RNA质粒转染细胞,用50 μmol/L Sal A预处理30 min后,30 mJ/cm2紫外线照射)组、Sal A+UV+si-SIRT3(经si-SIRT3质粒转染,用50 μmol/L Sal A预处理30 min后30 mJ/cm2紫外线照射)组。
1.4 细胞活性检测 将1×105个ARPE-19细胞接种于96孔板中,按照分组方法处理,并继续培养48 h后,每孔加入20 μL 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,37 ℃恒温箱孵育4 h,弃去上清液,加入二甲基亚砜120 μL终止反应。酶标仪中检测各孔的吸光光度(A)值,计算细胞存活率。细胞存活率=实验组A/对照组A×100%。
1.5 细胞凋亡检测 取1×106个细胞接种至6孔板中,经处理48 h后,收集细胞悬液,以1 500 r/min离心,弃上清,再次重悬、离心、弃上清后,加入500 μL缓冲液,吹散细胞。将5 μL Annexin V-FITC、5 μL PI依次加入、混匀,室温下避光孵育15 min,上机检测。
1.6 ROS水平检测 采用DCFH-CA方法检测细胞内ROS水平。将细胞密度为1×106个/孔的ARPE-19接种于6孔板,经处理48 h后,按照ROS检测试剂盒说明书进行操作。用终浓度为10 μmol/L的DCFH-CA重悬细胞,置入37 ℃细胞培养箱内孵育20 min,以无血清细胞培养液洗涤3次后,转至流式细胞仪检测平均荧光强度。
1.7 SOD2活性检测 采用WST-8法检测细胞内SOD2活性。将细胞密度为1×106个/孔的ARPE-19接种于6孔板,经处理后,预冷的PBS洗涤2次。收集细胞,加入预冷的PBS匀浆,取匀浆液4 ℃离心,收集上清液。经BCA法进行蛋白定量后备用。按照CuZn/Mn-SOD活性检测试剂盒(WST-8法)说明书配制WST-8/酶液和反应启动液。取20 μL样品,依次加入160 μL WST-8/酶液和20 μL反应启动液,37 ℃孵育30 min。在波长为450 nm时,测定吸光度。
1.8 Western blot检测 各组细胞用预冷PBS漂洗3次后,加入150 μL RIPA细胞裂解液,冰上裂解15 min,EP管收集细胞裂解液,置于4 ℃离心机,12 000 r/min离心15 min,取上清。按照BCA蛋白定量试剂盒说明书进行蛋白定量,取20 μg总蛋白用聚丙烯酰胺梯度凝胶电泳分离,电转至PVDF膜上;经3%脱脂奶粉封闭1 h,加入适量比例的SIRT3、SOD2一抗,置于4 ℃冰箱过夜。用 PBST缓冲液洗膜后,按1:20 000加入HRP标记的二抗室温孵育2 h。再次洗膜后,用ECL试剂显影。
1.9 RT-qPCR检测 总RNA用Trizol试剂(美国Invitrogen公司)抽提,即加入1 mL Trizol试剂吹下细胞,加入200 μL氯仿,EP管内静置15 min后,置于4 ℃离心机,12 000 r/min离心15 min。取上清,用1 mL 75%乙醇洗涤,再次离心,弃上清、干燥后,取RNA沉淀物。mRNA反转录反应,按照PrimeScript RT Master Mix(大连Takara公司)说明书合成cDNA。进行PCR检测,将反转录物用SYBR Premix Ex TaqTM II试剂盒(大连Takara公司)在ABI500 PCR仪上进行RT-qPCR扩增、检测。SIRT3引物:上游5’-CGCTAAACTTCTCCCGGGTT-3’,下游5’-ACACTAGTCCT CGCCAAACG-3’;SOD2引物:上游5’-GCCTCCCTGACCTG CCTTAC-3’;下游: 5’-GTGATTGATATGGCCCCCG-3’;GAPDH引物:上游5’-GAAGGTGAAGGTCGGAGTC-3’,下游5’-GAAGATGGTGATGGGATTTC-3’;使用2-△△CT法分析SIRT3、SOD2 mRNA表达情况。
1.10 统计学处理方法 采用SPSS 23.0软件进行统计学分析。数据以s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Sal A抑制紫外线诱导SIRT3表达 与对照组比,UV组SIRT3表达量明显降低(P<0.05);与UV组比,5、25、50 μmol/L Sal A处理后,细胞内SIRT3表达量明显增加(P<0.05)。见图1。
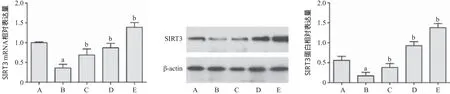
图1 Sal A抗UV抑制SIRT3蛋白和mRNA的表达
2.2 SIRT3在Sal A抗紫外线诱导RPE细胞损伤的作用 与对照组相比,UV组细胞存活率明显下降(P<0.05);与UV组相比,Sal A+UV组细胞存活率明显增加(P<0.05);与Sal A+UV组相比,Sal A+阴性si-RNA+UV组细胞存活率差异无统计学意义(P>0.05),Sal A+UV+si-SIRT3组细胞存活率明显降低(P<0.05);与Sal A+阴性si-RNA+UV组相比,Sal A+UV+si-SIRT3组细胞存活率明显降低(P<0.05)。见图2。
2.3 SIRT3在Sal A抗紫外线诱导ARPE-19细胞凋亡的作用 与对照组相比,UV组细胞凋亡率,Bax、cleaved-Caspase3、Cyt c表达量增加,Bcl-2表达量下降(P<0.05);与UV组相比,Sal A+UV组细胞凋亡率,Bax、cleaved-Caspase3、Cyt c表达量降低,Bcl-2表达量增加(P<0.05);与Sal A+UV组相比,Sal A+阴性si-RNA+UV组细胞凋亡率,Bax、cleaved-Caspase3、Cyt c表达量降低(P<0.05),Bcl-2表达量差异无统计学意义(P>0.05),Sal A+UV+si-SIRT3组细胞凋亡率,Bax、cleaved-Caspase3、Cyt c表达量降低,Bcl-2表达量明显增加(P<0.05);与Sal A+阴性si-RNA+UV组相比,Sal A+UV+si-SIRT3组细胞凋亡率,Bax、cleaved-Caspase3、Cyt c表达量明显增加,Bcl-2表达量下降(P<0.05)。见图3。
2.4 SIRT3在Sal A抗紫外线诱导ARPE-19细胞氧化应激的作用 与对照组相比,UV组ROS水平升高,SOD2活性、蛋白和mRNA表达下降(P<0.05);与UV组相比,Sal A+UV组ROS水平降低,SOD2活性、蛋白和mRNA表达量增加(P<0.05);与Sal A+UV组相比,Sal A+阴性si-RNA+UV组ROS水平、SOD2活性、蛋白和mRNA表达量无明显差异(P>0.05),Sal A+UV+si-SIRT3组ROS水平升高,SOD2活性、蛋白和mRNA表达量下降(P<0.05);与Sal A+阴性si-RNA+UV组相比,Sal A+UV+si-SIRT3组ROS水平增加,SOD2活性、蛋白和mRNA表达降低(P<0.05)。见图4。

图2 SIRT3在Sal A抗UV抑制细胞存活的作用
3 讨论
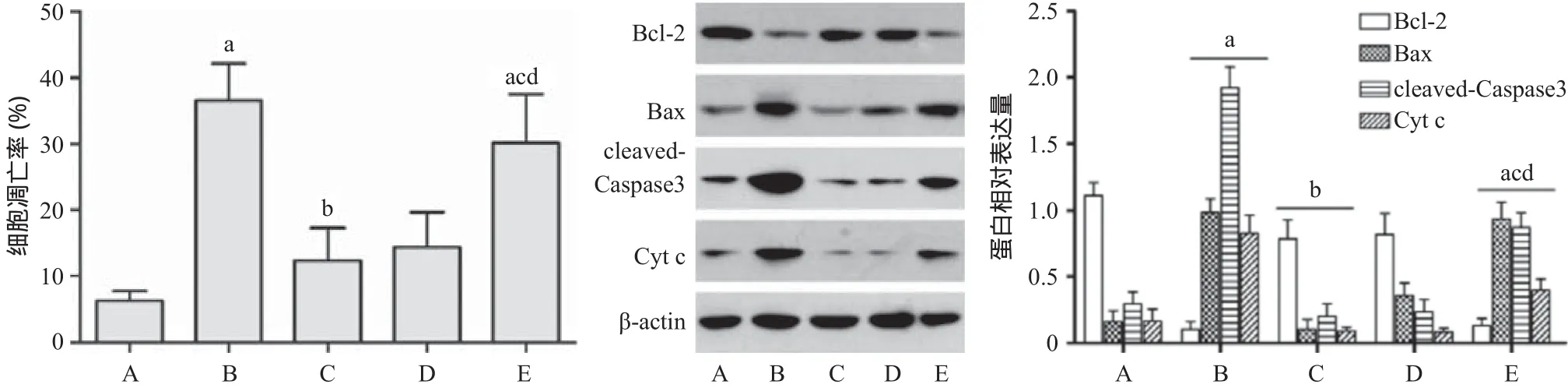
图3 SIRT3在Sal A抗UV诱导细胞凋亡的作用

图4 SIRT3在Sal A抗UV诱导氧化应激的作用
SIRT3定位于线粒体基质,能促使多种抗氧化物酶去乙酰化,调节细胞内氧化应激,维持细胞正常生理功能[7]。SIRT3高表达于视网膜组织,主要分布于内外丛状层和视网膜色素上皮细胞[6,8],参与抵抗细胞氧化应激损伤和视网膜血管新生的调控[9-10]。研究发现胰高血糖素样肽I类似物能够增加SIRT3的表达,抑制过氧化氢诱导的R28细胞损伤作用[11]。本研究发现UV照射后,细胞存活率下降,细胞凋亡,Bax、cleaved-Caspase3、cyt c表达量增加,而SIRT3、Bcl-2表达量显著下降;经Sal A预处理后,细胞存活率增加,细胞凋亡,cleaved-Caspase3、Cyt c表达量下降,SIRT3、Bcl-2表达量显著增加;用si-SIRT3干扰后,Sal A抗UV诱导细胞损伤的作用明显减弱,表现为:与Sal A+UV组相比,Sal A+si-SIRT3+UV组细胞存活率下降,细胞凋亡率,Bax、cleaved-Caspase3、cyt c表达量增加,Bcl-2表达量下降;提示Sal A的抗UV诱导的细胞损伤与其增加SIRT3表达有关。
SOD2作为位于线粒体的抗氧化物酶,能够将超氧离子转化成过氧化氢和水,维持细胞内ROS平衡[12]。SIRT3能直接与SOD2的乙酰化位点结合,使SOD2去乙酰化,增加SOD2活性,形成SIRT3-SOD2通路,是重要的抗氧化通路[13-15]。QIU等[14]发现SIRT3使SOD2去乙酰化,增加细胞对氧化应激性的耐受性。CHEN等[15]表明木褪黑素能够激活SIRT3介导的SOD2活性,降低细胞内ROS水平。LIU等[16]证实外源性增加SIRT3表达,SOD2的赖氨酸68位点乙酰化,抵抗糖尿病氧化应激性损伤。本研究中,与UV组相比,Sal A+UV组SIRT3表达量明显增加,SOD2活性、蛋白和mRNA表达量也明显增加,提示Sal A增加SOD2活性及表达可能与其诱导SIRT3表达有关。经si-SIRT干扰后,与Sal A+UV组相比,Sal A+si-SIRT3+UV组的SOD2活性、蛋白和mRNA表达量均明显下降,说明SIRT3可能是Sal A增加SOD2表达量和活性的关键靶点。
综上所述,紫外线照射下,ARPE-19细胞内SIRT3表达量下降,SOD2的表达、活性降低,细胞氧化应激性损伤被激发,Sal A能够增加细胞内SIRT3的表达量,进而增加SOD2的活性和表达量,抵抗UV诱导的氧化应激性损伤。
