蒺藜TTS-12对须癣毛癣菌的体内外抗菌活性研究
2019-04-27陈彦洁柳传毅吕满霞方琼彤吴新荣
陈彦洁,柳传毅,吕满霞,方琼彤,吴新荣*
1华南理工大学食品科学与工程学院,广州510641;2中国人民解放军南部战区总医院药学部;3广州市老年慢病患者合理用药重点实验室,广州 510010
体癣是最为常见的皮肤浅部真菌病,是除了头部、手部、脚部和甲部外,发生在身体皮肤上的皮肤真菌感染。目前,约有40个不同种类的的皮肤癣菌,而根据其消化角质能力的不同分为三大属:毛癣菌属(Trichophyton)、小孢子菌属(Microsporum)和表皮菌属(Epidermophyton)[1,2]。随着广谱抗生素的长期使用,真菌耐药菌株的出现,开发天然无副作用的抗菌药物有着重要的意义。蒺藜为蒺藜科蒺藜属植物蒺藜(TribulustermtrisL.)的干燥成熟果[3]。甾体皂苷(Steroidalsaponins)为蒺藜的主要成分之一,现代研究表明,蒺藜皂苷类具有抗衰老、抗菌、抗癌等作用[4]。甾体皂苷通常都为很好的抗菌物质[5],甾体皂苷TTS-12是从蒺藜全草中分离纯化得到的单体产物,属于螺甾烷醇型甾体皂苷,其化学名为替告皂苷元3-O-β-D-吡喃木糖(1→2)-[β-D-吡哺木糖(1→3)]-β-D-吡喃葡萄糖(1→4)-[α-L-吡喃鼠李糖(1→2)]-β-D-吡喃半乳糖苷[6],其结构如图1所示。前期研究表明,甾体皂苷TTS-12对常见的四种皮肤癣菌,红色毛癣菌(Trichophytonrubrum)、须癣毛癣菌(T.mentagrophytes)、石膏样小孢子菌(Microsporumgypseum)和犬小孢子菌(Microsporumcanis)均有较强的抗菌活性[7]。体外抗皮肤癣菌的效果决定了TTS-12是否具有成药的潜质,除了用CLSI的M38-A2方案对皮肤癣菌进行最小抑菌浓度和最小杀菌浓度的检测外[8],本实验还选了多种指标考察TTS-12对皮肤癣菌的抑菌作用,以此来充分证明TTS-12的抗皮肤癣菌效果。随后采用自制的蒺藜TTS-12凝胶剂观察其对感染须癣毛癣菌的豚鼠体癣治疗效果,进一步研究在动物水平上,蒺藜TTS-12的抗菌效果,为蒺藜TTS-12开发成新的抗真菌药物提供科学理论依据。

图1 蒺藜TTS-12化学结构Fig.1 The chemical structures of compounds TTS-12
1 实验仪器与材料
1.1 仪器
LRH-70生化培养箱(上海一恒科学仪器有限公司)、BHC-IIB2生物安全柜(广州苏净医疗设备有限公司)、YXQ-LS-18SI压力蒸汽灭菌器(上海博讯实业有限公司)、OLYMPUS生物显微镜(奥利巴斯有限公司)、BP210S型电子天平(德国赛多利斯) LRH-70生化培养箱(上海一恒科学仪器有限公司);SW-CJ-IF净化工作台(上海博讯实业有限公司);移液枪(美国Thermo公司)。
1.2 材料
TTS-12对照品(纯度:99.6%)由第二军医大学药学院天然药化教研室提供、酮康唑(纯度>98.0%,MACKLIN);氟康唑(纯度>98.0%,aladdin);酵母粉(OXOID,批号:1338303-02)、YEAST EXTRACT(OXOID);马铃薯葡萄糖琼脂粉(广东环凯微生物科技有限公司,批号:3104890)、RPMI-1640 Medium(SIGMA公司);二甲基亚砜分析纯(天津大茂化学试剂厂);3799-96孔板(COSTAR);自制0.5%、0.8%、1%蒺藜TTS-12凝胶;盐酸特比萘芬乳膏(中美天津史克制药有限公司,批号:L07060A);脱毛膏(薇婷,批号:20150321)。
1.3 菌株和动物
须癣毛癣菌[Trichophytonmentagrophyton,CMCC(F)T5e]、近平滑菌念珠菌(Candidaparapsilosis,ATCC22019)购于中国医学科学院皮肤病研究所,21株须癣毛癣菌临床分离菌株由广州军区广州总医院医院检验科惠赠;普通级豚鼠,每只体重约200~250 g,雌雄各半,共56只。试验动物许可证号:SCXK(粤)2016-0002,NO.44007200002096。于广州军区广州总医院动物中心普通环境饲养。
2 实验方法
2.1 真菌的培养及菌液的配置
须癣毛癣菌的标准菌株接种在PDA培养基上,于28 ℃的培养箱中活化7~14天。选取生长状态良好,无污染的菌落作为受试菌株,于菌落上滴加适量0.85%无菌生理盐水,用无菌棉棒轻轻反复刮擦菌落表面,使孢子充分与生理盐水充分混合。用两层纱布过滤菌悬液至离心管中,再放置于涡旋振荡器震荡15 s左右。用血细胞计数板进行计数,用无菌生理盐水调整菌液浓度至2~6×105CFU,最后用不含氮源RPMI-1640培养基稀释10倍,备用。
2.2 TTS-12对皮肤癣菌标准菌株及临床菌株最小抑菌浓度(MIC)
采用CLSI M38-2方案对MIC,MIC的测定方法如下:将适量TTS-12溶于DMSO中,使浓度为6.4 mg/mL,吹打均匀后用RPMI-1640液体培养基稀释100倍。取96孔板,1~10孔加入100 μL RPMI-1640培养基,将100 μL药液培养基加至第10孔中,用移液枪吹打均匀后转移10 μL至第9孔,以此类推直至第1孔,舍弃最后100 μL。TTS-12的浓度范围在0.062 5~32 μg/mL。1~10孔加入100 μL菌液。第11孔加入200 μL无菌培养基作为空白对照,第12个孔加入100 μL无菌培养基和100 μL菌液作为阴性对照。每组平行3次,置于28 ℃恒温培养箱中培养,4天后判读结果,无菌生长孔所对应的最低药物浓度为MIC。
2.3 TTS-12对皮肤癣菌标株及临床菌株的最小杀菌浓度(MFC)
从以上的药敏板中转移完全抑制真菌生长的携药培养基至PDA平板培养基中,28 ℃培养5天,肉眼观察有无真菌生长,无真菌生长菌液所对应的的最小浓度为MFC。质控实验在与上述实验平行操作的条件下进行,近平滑念珠菌(ATCC 22019)作为质控菌株,酮康唑作为质控药,按照以上的步骤步骤对质控菌株进行MIC测定,当MIC落在0.062 5~0.5 μg/mL时数据可信有效。
2.4 TTS-12对菌丝生长的抑制作用
配制TTS-12浓度为2、4、6、8、10 μg/mL的PDA平板培养基。用0.7 cm打孔器取生长良好的菌块作为菌饼,接种于载药培养基上,于28 ℃的环境中培养15天,每24 h观察一次,平行5次。
菌落直径(cm)=测量菌落直径﹣0.7
菌丝生长抑制率=[(对照组菌落直径-处理组菌落直径)/ 对照组菌落直径]×100%
2.5 TTS-12对孢子萌发动力学的影响
TTS-12用DMSO溶解后,再用100倍生理盐水溶解,使终浓度为1、2、4、8 μg/mL。接种10 μL 1~4×108spores/mL菌液,斡旋震荡后,分别置于室温处理30、60、90、120、150、180 min,10 000 rpm离心5 min,用无菌生理盐水冲洗孢子,重悬于100 μL无菌水中,取10 μL置于含PDA的凹玻片中,置于湿盒中于28 ℃恒温箱培养24 h,显微镜观察孢子萌发情况,平行5次。
孢子萌发率=(发芽孢子数/孢子总数)×100%
2.6 豚鼠体癣模型制备
取豚鼠56只,每只豚鼠后背部用剃毛刀剃毛(2.5 cm×2.5 cm),然后轻涂适量脱毛膏,5 min后用灭菌水清理干净背部的毛并擦干,用手术刀刮伤皮肤至有针状血出现为止,随机取8只(雌雄各半)作为空白组,其余48只豚鼠用制备好的菌悬液(浓度调节为1×107CFU/mL)涂抹于创面上0.4 mL/d,空白组用无菌生理盐水涂抹于创面上0.4 mL/d,每天观察并且重复染菌至第5天,取背部接种处皮屑用 10% 氢氧化钾进行镜检,以镜检阳性为造模成功。
2.7 分组给药及评价方法
成功造模后,将豚鼠随机分为模型组、阴性对照组、阳性对照组及低剂量组、中剂量组、高剂量组,每组10只。空白组、模型组给予无菌生理盐水,阴性对照组给予空白凝胶基质、阳性对照组给予盐酸特比萘芬乳膏、低中高剂量组组分别给予0.5%、0.8%、1%的蒺藜TTS-12凝胶。48小时内开始给药,每只豚鼠背部给于0.4 mL/天,每天一次,连续给药7天。开始给药后每天观察并对背部病变程度进行评分[9],具体评分见表1。

表1 豚鼠背部病变程度评分标准
给药7天后,第8天将豚鼠处死,用无菌生理盐水清洗背部皮肤,取病灶部位皮肤,每只豚鼠病灶皮肤处取5块5×5 mm组织,2块皮肤放置于10%甲醛溶液中,做HE染色切片,用显微镜观察病灶皮肤炎性发生情况。剩余3块放入70%乙醇中浸泡2~3 min,杀灭杂菌,经无菌生理盐水清洗后接种到含青霉素和放线菌酮的PDA培养基中,培养在28 ℃恒温培养箱中,7天后观察须癣毛癣菌生长情况,计算病灶皮肤真菌培养的阴性率。
2.8 统计方法及数据处理
数据使用软件SPSS20.0 进行统计学分析,各组豚鼠背部病变程度评分比较采用单因素方差分析,各组病灶皮肤真菌培养阴性率比较采用χ2检验,设P<0.05为有统计学意义,P<0.01为有显著统计学差异。
3 结果
3.1 最小抑菌浓度(MIC)的测定
用肉眼观察,与生长对照组孔相比,约抑制80%真菌生长的孔所对应的的最低浓度为最小抑菌浓度。TTS-12对须癣毛癣菌及其临床菌株均有较好的抑菌活性,对须癣毛癣菌的MIC值为1 μg/mL,对两者种的临床菌株MIC范围为1~8 μg/mL和0.5~8 μg/mL。其抑菌活性高于抗真菌常用药物氟康唑,与酮康唑相似。实验中质控菌株的MIC落在有效范围内,实验可信有效(表2,3)。

表2 TTS-12及3种药物对21株须癣毛癣菌临床菌株的MIC(μg/mL)
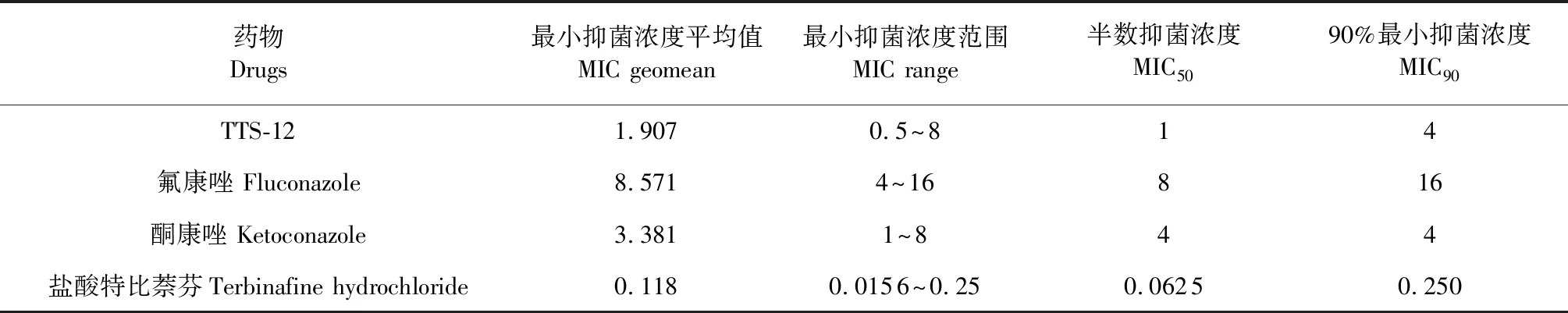
表3 TTS-12及3种药物对21株须癣毛癣菌临床菌株的MIC(μg/mL)
3.2 最小杀菌浓度(MFC)的测定
TTS-12对须癣毛癣菌的MFC为8 μg/mL,对临床菌株的的MFC在4~32 μg/mL。结果表明,TTS-12对须癣毛癣菌标准菌株和临床菌株均有较好的杀菌作用(表4,5)。
3.3 TTS-12对菌丝生长的抑制作用
TTS-12对皮肤癣菌的菌丝抑制程度随浓度递增,如图2所示,在第15天时,浓度4 μg/mL的TTS-12对须癣毛癣菌的菌丝生长抑制率已经高于60%,蒺藜TTS-12对须癣毛癣菌菌丝生长有良好的抑制效果。
表4蒺藜TTS-12及常用药物对须癣毛癣菌标准菌株的MFC值(μg/mL)
Table 4 MFC of TTS-12 and common antifungal drug against two standard strains ofT.mentagrophytes(μg/mL)

药物Drugs须癣毛癣菌T.mentagrophytesTTS-128氟康唑Fluconazole64酮康唑Ketoconazole8盐酸特比萘芬Terbinafine hydrochloride0.25

表5 TTS-12及3种药物对21株须癣毛癣菌临床菌株的MFC(μg/mL)
3.4 TTS-12对孢子萌发动力学的影响
TTS-12 对须癣毛癣菌的孢子萌发动力学如图3所示,用不同浓度的TTS-12(1~8 μg/mL)处理须癣毛癣菌,其可以抑制皮肤癣菌的孢子萌发,其抑制孢子萌发的效果与TTS-12的浓度和时间呈正相关。
3.5 豚鼠背部病变程度评分
体内实验中,在接种菌液的第5天后,各组均出现有红斑及白色或淡黄色的鳞屑,并伴有出血的病变情况,在给药的期间,除了模型组和阴性对照组外,其余各组均显著降低豚鼠背部病变程度评分,对背部体癣症状有一定的改善,红斑减少,厚皮脱落皮肤变光滑,各组一般背部病变情况可见图4。给药第1天,和空白对照组比较,模型组及各给药组豚鼠背部病变程度评分显著增加且皮屑镜检为阳性,表明造模成功并且各给药组评分无差异说明各组豚鼠分配均匀;和模型组相比,给药的第1、4、8天,阴性对照组豚鼠背部病变程度评分差异无统计学意义,说明阴性对照组的空白凝胶剂基质对体癣模型背部病变情况没有明显改善。给药第4天,和模型组相比,低剂量组能降低豚鼠背部病变程度评分并具有统计学差异(P<0.05),中剂量组、高剂量组能显著性降低豚鼠背部病变程度评分(P<0.01),阳性对照组未见显著降低豚鼠背部病变程度评分,在给药第8天中剂量组、高剂量组与阳性对照组相比效果相当,没有统计学差异(P<0.05)(图5)。
图2 不同浓度的TTS-12分别对须癣毛癣菌丝生长的影响(n=5,x±s)Fig.2 Effect of different concentrations of TTS-12 for T.mentagrophytes(n=5,x±s)

图3 TTS-12对须癣毛癣菌的孢子萌发动力学影响(n=5,x±s)Fig.3 Effect of kinetics of T.mentagrophytes spores by TTS-12(n=5,x±s)
3.6 豚鼠病灶皮肤病理变化
病灶皮肤HE染色切片结果表明,模型组和阴性对照组病灶真皮层中可以见到有大量的中性粒细胞浸润,棘层肥厚,有明显的炎性,角质层可见有菌丝,低中高剂量组有一定程度的棘层肥厚,但厚度小于模型组,炎性细胞浸润较模型组轻,但比阳性对照组严重,其中高剂量组的角质层正常,炎症情况比较轻。各组HE染色病理结果见图6。
3.7 豚鼠病灶皮肤真菌培养阴性率
造模成功后,病灶背部皮肤皮屑镜检下可以观察到有大量的菌丝,给药处理后取病灶皮肤进行真菌培养,其阴性率能一定程度反映药物的杀菌效果。病灶皮肤真菌培养结果显示各组真菌培养阴性率分别为:空白组100%、模型组20.83%、阴性对照组25%、阳性对照组75%、低剂量组41.67%、中剂量组54.17%、高剂量组66.67%,其中空白组背部皮肤的真菌培养未见有须癣毛癣菌的生长,模型组大多数病灶皮肤的真菌培养可见有须癣毛癣菌的生长。结果表明,与模型组相比,中剂量组皮肤真菌培养阴性率有统计学差异(P<0.05),阳性对照组、高剂量组皮肤真菌培养阴性率有明显的差异(P<0.01),且两者皮肤真菌培养阴性率相当,说明高剂量组表现出一个比较好的杀菌作用,具体结果见表6。
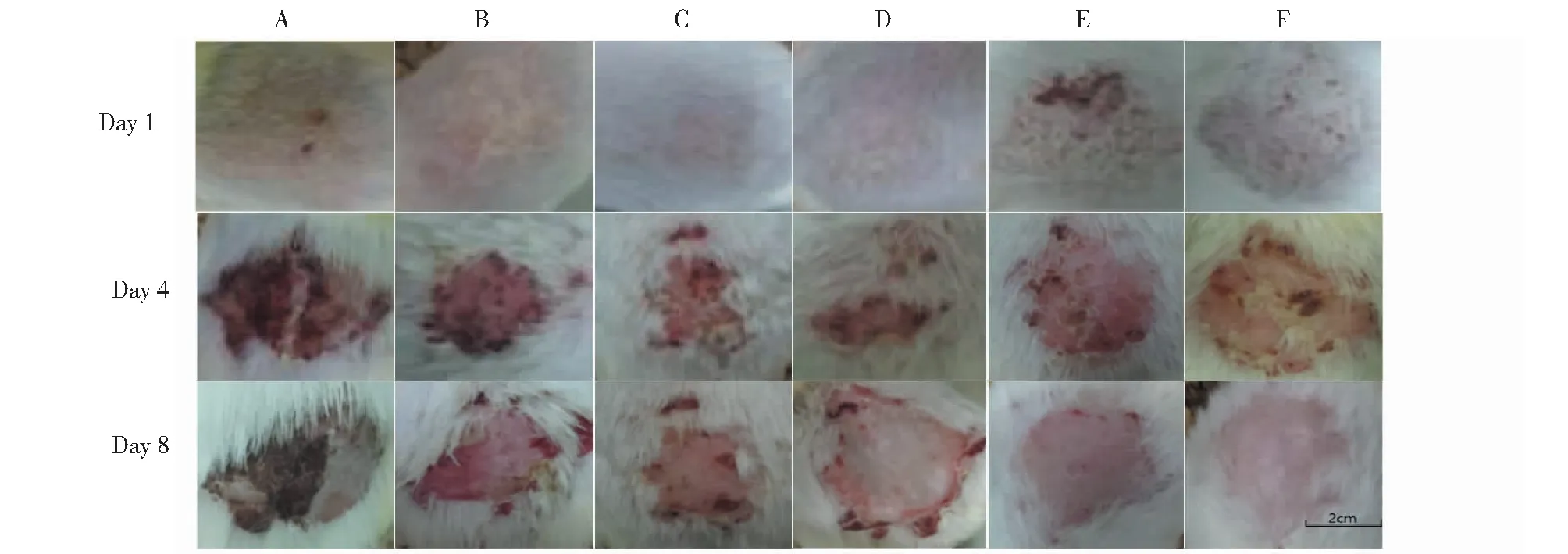
图4 各组豚鼠背部病变情况(n=10)Fig.4 Groups of guinea pig lesions(n=10)注:A模型组,B阴性对照组,C低剂量组,D中剂量组,E高剂量组,F阳性对照组。Note:A:Model group,B:Negative group,C:Low-dose group,D:Middle-dose group,E:High-dose group,F:Positive group.
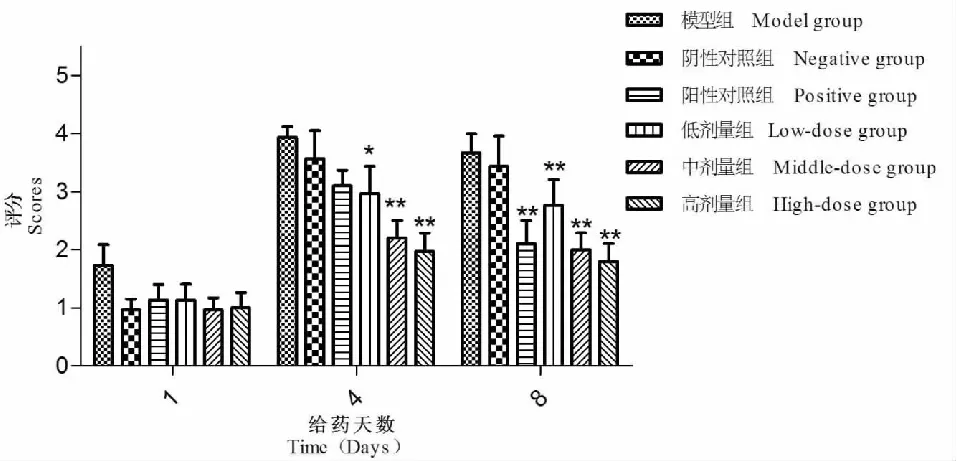
图5 给药后各组豚鼠背部症状评分图(n=10,x±s)Fig.5 Lesion score of guinea pig after treatment(n=10,x±s)注:与模型组相比,*表示P<0.05,** P<0.01。Note:Compare with control,*P < 0.05;** P < 0.01.
4 讨论
蒺藜被分离鉴定出含有载体皂苷、黄酮、糖苷、植物甾醇、单宁酸等化合物。皂苷和黄酮作为蒺藜中的主要代谢产物,因其具有多种生物活性,成为蒺藜研究的主要对象。学者发现其甾体皂苷种类丰富,多达108种[10],蒺藜TTS作为一种螺甾烷醇型甾体皂苷具有良好的抗菌活性。
随着越来越多的研究从中药或植物中寻找有效抗真菌成分,这些新型抗真菌成分药效的评价和检测方法也随之发展和系统化。对活性成分进行体外抗真菌和毒性评价是筛选的第一步,随后进行体内动物模型试验来进一步验证。
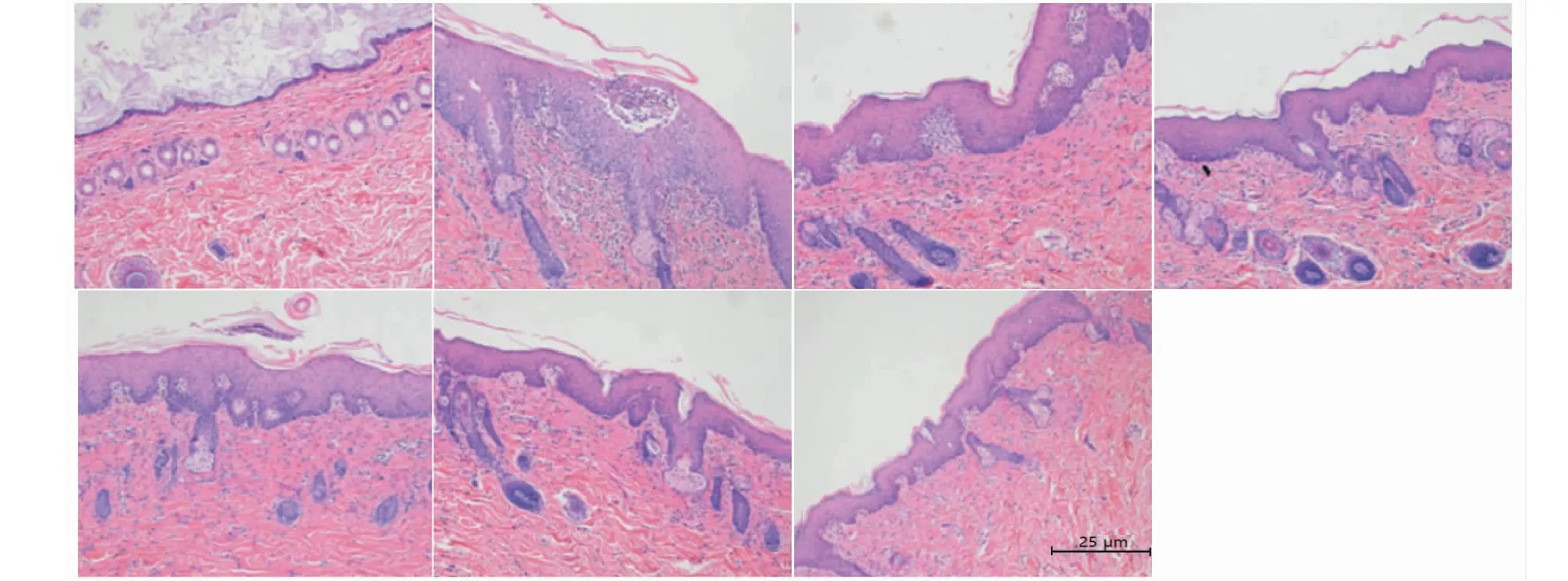
图6 各组HE染色病理切片(×400)Fig.6 HE pathological section(×400)注:A空白组,B模型组,C阴性对照组,D阳性对照组,E低剂量组,F中剂量组,G高剂量组。Note:A:Blank group,B:Model group,C:Negative group,D:Positive group,E:Low-dose group,F:Middle-dose group,G:High-dose group.

表6 病灶皮肤真菌培养阴性率
注:与模型组相比,*表示P<0.05;**P<0.01;与阳性对照组相比,#表示P<0.05。
Note:Compare with control,*P< 0.05;**P< 0.01;Compare with positive,#P<0.05.
在标准化的体外抗菌药敏实验方案中,美国临床实验室标准化委员会(CLinical and Standards Institute,CLSI)制定的M27-A3、M38-A2就为我们提供了一个快速、简单、可靠的测量方法,方案提出后众多学者都采取此方法进行抗菌药物筛选[11]。体外实验中测得TTS-12对须癣毛癣菌的标株菌株的MIC≤4 μg/mL,MFC≤32 μg/mL,且TTS-12能够显著抑制须癣毛癣菌的菌丝生长,孢子萌发,说明蒺藜TTS-12有较强的体外抗菌活性。本次实验中同时选取了标准菌株和临床分离菌株测定其抗菌作用,使数据具有一定的代表性和可信服性。
而对于动物感染体癣模型的研究从很早就已见报道,最早可见1908年Bloch建立体癣动物模型的报道,随后越来越多的学者对动物体癣模型进行探讨,包括对动物的选择,感染菌株的选择,预处理和处理方法的比较及接种范围等[12]。动物体癣模型的造模在感染菌株的选取上,可选用红色毛癣菌、须癣毛癣菌或犬小孢子菌,但由于犬小孢子菌产孢较少,菌悬液浓度达不到高浓度,红色毛癣菌为亲人性菌株,它在自然环境下极少感染动物,因此需要使用免疫抑制剂干预才能造模成功,须癣毛癣菌同时具有亲人和亲动物的特点,使其成为造模更理想的选择。
此外,豚鼠感染皮肤癣菌病理进程也是可预测的:豚鼠在接种菌株之后的4到6天会有短暂的红斑或丘疹出现,并在7到8天之间反应达到高峰期,随后红斑或丘疹就会逐渐增加并融合在一起。在接种的4周内,这些病变情况逐渐发生后,大多数豚鼠会自愈,所以试验中建议在豚鼠感染后3~5天给药,观察时间控制在2周内[13]。
本试验从豚鼠背部病变程度评分、病灶皮肤真菌培养阴性率及病灶皮肤病理变化来综合评价低中高剂量的蒺藜TTS-12凝胶对豚鼠感染须癣毛癣菌体癣模型的作用,从试验结果来看,相对于模型组,低中高剂量的蒺藜TTS-12凝胶对于病灶皮肤出现的红斑、出血、瘙痒有一定程度的缓解作用,能不同程度地杀灭侵袭皮肤的须癣毛癣菌,并呈一定的量效关系,其中高剂量组的治疗效果最佳,与阳性对照组相当,以上研究为蒺藜TTS-12凝胶以后临床应用提供试验依据。
