巧用“试剂—杂质—操作—产品”四线法突破工艺流程题
2019-04-25湖南周学兴
湖南 周学兴 杨 华
1.背景分析
1.1 高考背景分析
高考的功能——立德树人、为国家选拔人才,高考题以真实问题的解决为背景考查所学知识,常以实际生产工艺为背景,以元素化合物基础知识为主线,着眼于学生接受、吸收、整合信息能力的考查。新课改后的高考有很强的时代感和实践性,化工生产技术的“工艺流程题”已成为新亮点和主流题型,突出考查学生对元素化合物知识的运用,以能力与核心素养考查为根本,着眼于学生对化学信息的接受、吸收、整合能力的考查,以化学核心知识、概念为题干,以知识模型建构为落脚点,跳出了让学生陷入题海战的桎梏。
2017年教育部公布的高考考纲发生了很大的变化,对化学而言,删去“化学与技术”模块,选考部分由原来的“三选一”改为“二选一”,工艺流程题在13、15、16、17年高考全国卷Ⅰ中均有考查,近三年高考化学考查工艺流程题的情况,见表1。

表1 近三年高考工艺流程题的考查情况
学生遇到工艺流程题时,畏惧心严重,得分率较低。2017年湖南省学生得分情况抽样表明,27题工艺流程题得分率最低,该题对学生整理、吸收、分析化学信息要求较高,平均得分情况见表2。

表2 2017年全国卷Ⅰ部分非选择题抽样平均得分情况
1.2 学生学情分析
学生应对高考,大多同学把“考点”作为复习依据,用“突破考点”“狂练考点”“强化训练”等为主要手段,进行大量的机械重复劳动,尽管花费了大量学习时间,但收效甚微。具体存在以下困难:①阅读困难,审题过程不能迅速捕捉有用信息。②答题语言不规范。③元素化合物知识不扎实,不能够辨析微观反应。④思考不全面,杂质选择性屏蔽。⑤思维定势,死记硬背,不能灵活运用化学原理分析问题。⑥流程的全面分析与题设解决的辩证与统一,有的时候,工艺流程并不需要各个阶段都详细分析,而应“粗”“细”结合,游刃有余。
笔者阅读了许多关于工艺流程题解题技巧的文章,本文基于模型认知的构建,提出“试剂—杂质—操作—产品”四线法,举例说明该法能帮助高三学生高效理解工艺流程,有效提高学生处理信息、分析问题、解决问题等方面的能力。
2.“四线法”介绍
“四线法”顾名思义,通过分析四条主线,突破工艺流程题的整体把握,四条主线分别为试剂线、杂质线、操作线、产品线。根据工艺流程题的类型不同,四条主线具体呈现的内容不同。
利用“试剂—杂质—操作—产品”四线法解工艺流程题的模型认知,见图1。
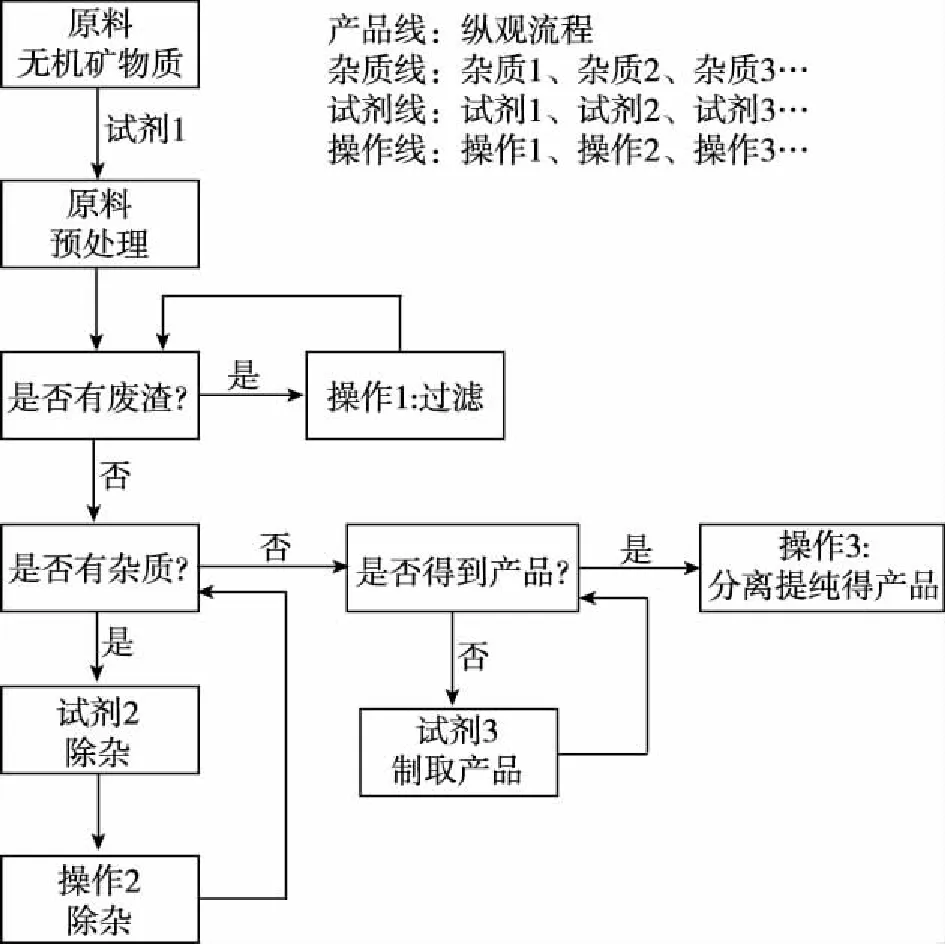
图1 四线法解工艺流程题的模型认知
四线法,符合真实化工流程的目的,更快更好地得到更纯的产品,有利于提升学生宏观辨识与微观探析的素养。
2018年全国卷Ⅰ工艺流程题的四线呈现情况、信息呈现形式,见表3。
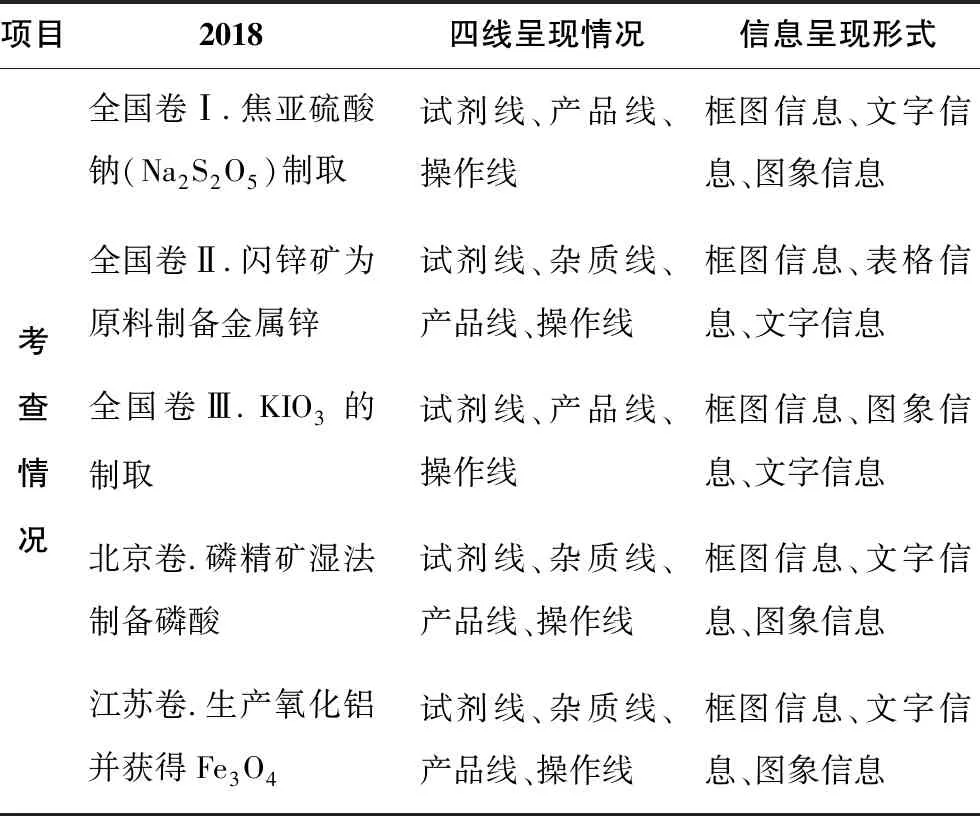
表3 基于四线法的工艺流程题分析
粗看工艺流程框图,迅速把握“四线”,能够整体把控整个化工流程的框架,储备一些常见教材工艺流程,比如高中教材中涉及的化学工业:①候氏制碱法,②氯碱工业,③硅酸盐工业,④工业制硫酸,⑤合成氨工业,⑥工业制硝酸,⑦金属Na、Mg、Al、Fe、Cu等的冶炼,⑧海水中提取物质等。
2.1 试剂线
需要掌握常见试剂的类型、作用和相关反应,也可称为反应线。常见试剂及其作用,见表4。

表4 常见试剂及其作用
2.2 杂质线
对于矿物质而言,测定元素组成后,即可确定杂质,需要积累常见试剂的处理方法、常见杂质及其除杂方式,见表5。

表5 常见杂质及除杂方式
工艺流程分析过程中,需要抓住杂质的去向分析,切勿因为思维的不严谨,导致某杂质还未除去却茫然不知。违背了化工生产的目的。同时杂质的去除离不开试剂线的分析。
2.3 操作线
主要指的是分离提纯操作,每加一次试剂,便需要思考是否需要过滤、蒸发、冷却结晶、蒸馏、萃取等分离提纯操作,见表6。

表6 常见操作及目的
2.4 产品线
试剂线、杂质线、操作线展开是为了获取产品,产品的获取主要通过除去杂质,发生核心反应而获取产品。通过总结近几年全国卷Ⅰ高考化学工艺题产品的获取方式(见表7),不难发现产品的获取具有以下特点:①主要围绕金属元素的相关工艺品进行考查;②工艺产品具有多样性,体现了经济需要实效性;③产品的获取可能在流程的前半部分;更多是后期才得到产品;④产品的获取,需要试剂参与反应转化,可能发生的是氧化还原反应;⑤产品的获取,所涉及的分离提纯操作及方法,离不开产品自身的性质,由于大部分产品是固体,故基本上离不开结晶的相关操作。

表7 工艺产品的获取
3.习题感悟
基于四线法,能够全面了解工艺流程框图的过程,理解如何除杂、试剂如何使用、产品如何获取、如何操作等。
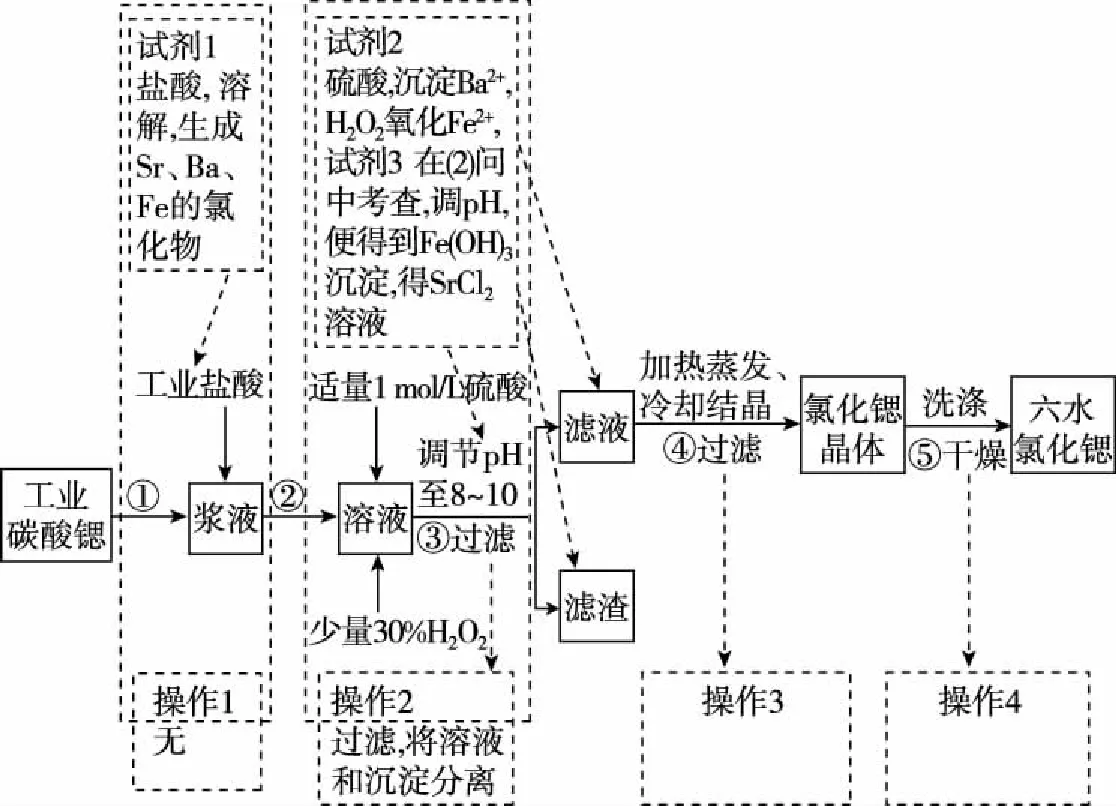
【案例1】锶(Sr)为第五周期ⅡA族元素,高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如图2。

图2
请回答:
(1)写出步骤②在浆液中加入盐酸时发生反应的离子方程式:________________。
(2)步骤③中调节溶液pH至8~10,宜选用的试剂为________。
A.稀硫酸 B.氢氧化锶粉末
C.氢氧化钠 D.氧化锶粉末
所得滤渣的主要成分是________(填化学式)。
(3)步骤⑤中,洗涤氯化锶晶体最好选用________。
A.水 B.稀硫酸
C.氢氧化钠溶液 D.氯化锶饱和溶液
(4)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是________________。
(5)若滤液中Ba2+浓度为1×10-5mol·L-1,依据表8中数据可以推算滤液中Sr2+物质的量浓度为________。

表8
【工艺流程分析】

(2)BD BaSO4和Fe(OH)3
(3)D
(4)温度高于61℃,SrCl2·6H2O失去结晶水
通过试剂线、杂质线、操作线、产品线四线并进的分析方法,有序有效地突破了工艺流程题的难点,解决了学生思考不全面的问题。关注题目的每一条线,但不必将每一条线都推出,问什么推什么,要带着问题去精心研究某一步或某一个物质。
【案例2】(2018·全国卷Ⅰ·27,节选)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:__________________________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺如图3所示:
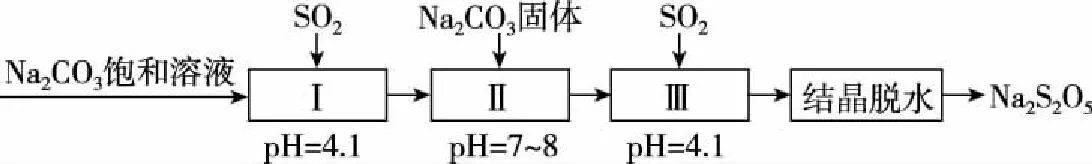
图3
① pH=4.1时,Ⅰ中为________(写化学式)溶液。
② 工艺中加入Na2CO3固体并再次充入SO2的目的是________________。
【工艺流程分析】整合吸收化学信息:工业上通过NaHSO3过饱和溶液结晶脱水制得Na2S2O5。分析流程可知,该题的主线为试剂线、产品线、操作线,并未体现试剂线与杂质线的关系。

直接切中要害,通入SO2即可得到产品,结合已知信息,其目的不言而喻,是为了得到NaHSO3过饱和溶液。

(2)①NaHSO3②得到NaHSO3过饱和溶液
【案例3】某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如图4所示:
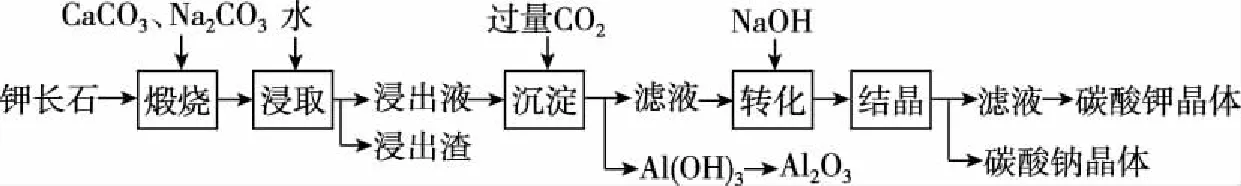
图4
上述工艺中可以循环利用的主要物质是________、________和水。
【工业流程分析】
既消耗又生成的物质,通过试剂线分析可知还有Na2CO3和CO2能够循环利用。
【答案】Na2CO3CO2
【案例4】(2017·全国卷Ⅰ·27,节选)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如图5所示:

图5
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如表9所示:
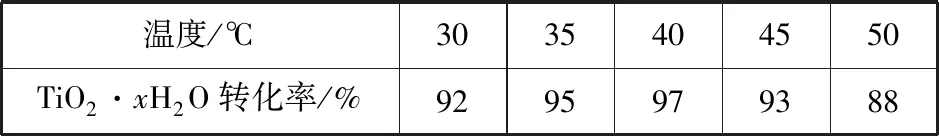
表9
分析40℃时TiO2·xH2O转化率最高的原因:________________________________。
【化工流程分析】
基于中间产物高效获取这一目的,结合产品线及操作线的分析,可知在该流程中温度为何选择40℃,需要从过高过低角度分析原因,低于40℃时,TiO2·xH2O转化率随温度升高而增加,超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降。
【答案】低于40℃,TiO2·xH2O转化率随温度升高而增加,超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降。
4.练后提炼——特殊设问及其解决策略
工艺流程题,往往需要在四线基础上,积累特殊设问的应对策略,这样工艺流程题不再会是高中生的“拦路虎”,近几年高考易错的热点设问如下:
4.1 分析循环利用的物质和可回收的物质
循环利用和回收利用,是工业生产提高经济效益、降低污染、提高物质的利用率等的必要手段。
①理解物质循环利用目的是节能减排,“绿色化学”,降低成本等,提炼出一定不会用于循环的物质:目标产物、杂质,可以用于循环的物质:辅助试剂、母液。
②可回收的物质:副产品(非目标产品)。
应对策略:弄清楚每一步的反应物、产物,对比“投入”“输出”,消耗又生成即为循环利用物质。
4.2 分析调节溶液的pH
①目的:使溶液中的某金属阳离子形成氢氧化物完全沉淀下来而除去。
②需要的物质:含主要阳离子的难溶性氧化物或氢氧化物或碳酸盐,即能与H+反应,使pH增大的物质,如MgO、Mg(OH)2等。
③原理:加入的物质能与溶液中的H+反应,降低了H+浓度,增大pH。
④pH控制的范围:大于除去离子的完全沉淀值,小于主要离子开始沉淀的pH。
4.3 分析洗涤沉淀
实际工业生产过程中,沉淀的洗涤主要围绕洗涤什么杂质、怎么洗(洗涤操作)、用什么洗涤、为什么用这个洗涤剂等问题展开分析,考题亦如此。
(1)沉淀洗涤的目的:除去沉淀表面附着或沉淀中包夹的可溶性离子。
(2)洗涤方法:向漏斗内加蒸馏水至浸没沉淀,待水自然流出后,重复操作2~3次。
(3)沉淀剂是否过量的判断方法答题模板。
①加沉淀剂:静置,向上层清液中继续滴加少量沉淀剂,若无沉淀产生,则证明沉淀剂已过量。
②加入与沉淀剂反应的试剂:静置,取适量上层清液于另一洁净试管中,向其中加入少量与沉淀剂作用产生沉淀的试剂,若产生沉淀,证明沉淀剂已过量。注意:若需称量沉淀的质量而进行有关定量计算时则只能选用方法(1)。
(4)判断沉淀是否洗净的操作答题模板(一般考查氯离子和硫酸根离子等沉淀型的离子检验)取最后一次洗涤液,滴加……(试剂),若没有……现象,证明沉淀已洗净。
4.4 分析控制温度
温度的控制,实际生产过程中主要基于反应速率、物质的溶解度(溶解度曲线)、物质的热分解与挥发(物质的性质分析)、弱离子的水解(平衡)、能源的利用(耗能)、副反应的发生、催化剂的活性、生产安全性等方面的思考。一般需要考虑温度过高、过低会有怎样的效果。具体如下:
(1)加热:加快反应速率或溶解速率
促进平衡向吸热方向移动;除杂,除去热稳定性差的杂质,如NaHCO3、Ca(HCO3)2、KMnO4、I2、NH4Cl等物质。使沸点相对较低的原料气化。
(2)降温:防止某物质在高温时溶解(或分解)
使化学平衡向着题目要求的方向移动(放热方向),使某个沸点较高的产物液化,使其与其他物质分离,降低晶体的溶解度,减少损失,尤其是减压蒸发、减压烘干,通过降低温度需求,防止目标物质的分解。
(3)控温:(用水浴或油浴控温)
防止某种物质温度过高时分解或挥发,为了使某物质达到沸点挥发出来,使催化剂的活性达到最好,防止副反应的发生,降温或减压可以减少能源成本,降低对设备的要求,达到绿色化学的要求。
4.5 分析化工流程的评价
实际工业生产过程中,评价化工流程,需要考虑速率、产率、产品纯度、成本、污染、循环利用等方面,其中污染主要指的是:废渣、废液(酸、碱、重金属盐)、废气(Cl2、Br2、硫和氮的氧化物等)。
教学中注重化工流程的评价,引导学生关注社会生产、社会环境等问题,激发学生探究潜质。
5.总结
利用“试剂—杂质—操作—产品”四线法可以快速地理解工艺流程题的流程模型,通过常见问题认知模型的构建,能够真正了解工艺流程的框架,掌握“四线”及常见设问的解决方式,高三学子便可不用对工艺流程题“望而生畏”。
但在教学过程中不能只强调解题,通过解题引导学生体会真实工艺的复杂性、综合性,比如杂质的去除可以选择方案Ⅰ也可以选择方案Ⅱ,需要综合考虑整个流程最终确定最佳方案,同时应该注重真实工业工艺的介绍,创设条件让学生走进生产一线,切实体会“纸上得来终觉浅”,提供有利条件,创设实验条件,抛出问题,让学生通过“四线法”自主设计如何综合利用矿物质或废渣的实验方案,并实施实验。最终让学生明白高考化学所考查的是一道工艺的简化模式,还需要有化工专业知识、实践经验、经济效益等方面的分析,才能够真正批量生产。通过利用四线法帮助学生从具体知识的掌握到实际问题的解决,最终到知识素养化的转变。通过“四线法”分析工艺流程题教学,让学生顺利地迈出认识化学工艺的第一步,并不断引导学生关注日常的生产实际问题,创设真实情境,提高学生分析、解决问题的能力。
