吗啡联合右美托咪定静脉自控镇痛用于难治性癌痛的临床研究
2019-04-23陈浩飞朱红梅程祝强
陈浩飞 田 蜜 朱红梅 程祝强 金 毅△
(1南京医科大学金陵临床医学院麻醉科,南京211166;2东部战区总医院麻醉科,南京210002)
疼痛是癌症病人最常见和难以忍受的症状之一,晚期癌症病人的疼痛发生率可达60%~80%[1]。癌症疼痛能够引起病人焦虑抑郁、乏力、失眠以及食欲减退等症状,严重地影响癌症病人的生活质量。吗啡作为WHO三阶梯镇痛药物在治疗中重度癌性疼痛方面发挥重要的作用[2],晚期难治性癌痛病人常需要口服大剂量吗啡来镇痛,这会导致病人产生过度镇静、恶心呕吐、便秘、免疫抑制等一系列的不良反应[3]。因此在癌痛控制的同时降低阿片药物用量,减少不良反应,提高病人的生活质量和舒适度,是目前癌痛治疗中急需解决的重要难题。
右美托咪啶(dexmedetomidine,Dex)是一种特异性和高效性的α2肾上腺素受体激动剂,可抑制神经元放电,从而产生镇静、镇痛和抑制交感神经活动的效应,副作用比较轻。动物实验研究发现右美托咪定可以增强吗啡的镇痛作用[4],显著减轻大鼠骨癌痛[5]。临床研究表明,右美托咪定经病人自控镇痛(patient-controlled analgesia,PCA)能够显著降低围术期和ICU病人阿片类药物的用量和副作用[6,7]。刘红军等研究发现鞘内注射右美托咪定能够显著降低难治性癌痛病人吗啡用量和副作用[8]。但右美托咪啶PCA应用于癌痛病人的治疗相关的研究还非常少,仅有零星的病例文献报道,临床使用经验较少[9,10],并且对于右美托咪定长时间应用来降低癌痛病人疼痛的研究,还未有报道;因此本研究采用右美托咪定联合吗啡静脉病人自控镇痛(patient-controlled intravenous analgesia,PCIA)用于治疗晚期难治性癌痛病人,从而探讨右美托咪定联合吗啡静脉自控镇痛在晚期难治性癌痛病人中的安全性和有效性。
方 法
1 一般资料
选择2016年1月至2018年9月东部战区总医院疼痛科收治的难治性癌痛病人,根据相应的入选标准和排除标准共筛选符合标准的病人119例,其中男性77例,女42例。年龄28~94岁,平均年龄为(62.55±11.88)岁;其中肺癌41例,消化道肿瘤32例,胰腺癌19例,妇科肿瘤7例,其他20例。本研究所有病人均签署PCA知情同意书,经东部战区总医院(原南京军区南京总医院伦理委员会)批准。
纳入标准:① 经过病理学诊断为晚期恶性肿瘤病人,预计生存期3个月以下;② 经三阶梯药物镇痛治疗疼痛控制不佳或副反应不能耐受或口服给药困难者,疼痛数字分级法(numeric rating scale,NRS)评分≥4分和(或)爆发痛次数≥3次/天;③ 同意使用电子镇痛泵持续给药,病人及其家属经过宣教能够充分理解PCA泵的优点和风险,能够按需自行操作PCA泵。
排除标准:① 阿片类药物过敏史的病人;②认知功能障碍,不能自控镇痛或配合进行疼痛评估;③ 有精神疾病或药物滥用者;④ 重度心肺功能障碍、肝肾功能衰竭、肠梗阻和预计生存期小于1个月的癌痛病人;⑤ 有医疗纠纷的病人。
119例病人按照随机数字表法分为对照组(Control group,CON,59例)和右美托咪定组(Dexmedetomidine,Dex,简称右美组,60例),对照组采用电子镇痛泵静脉注射吗啡;右美组采用电子镇痛泵静脉注射吗啡和右美托咪定;两组病人性别、年龄、体重、原发疾病、PCIA前24 h等效吗啡总量和疼痛程度比较,差异无统计学意义(见表1)。
2.设备与药品
PCA电子泵(江苏人先医疗科技有限公司);一次性储药盒(江苏人先医疗科技有限公司,规格:250 ml);盐酸吗啡注射液(东北制药集团沈阳第一制药有限公司,规格:1 ml:10 mg);右美托咪定(江苏恒瑞医药股份有限公司,规格0.2 mg/2 ml)。
3.方法
(1)药物的转换及PCA药盒配制:将病人PCIA前24 h使用的阿片类药物换算为等效口服吗啡剂量,然后按3:1的转换系数换算成24 h静脉吗啡剂量(M0)。然后根据入组前病人的NRS评分,估算病人每日需要增加的静脉吗啡剂量(M1= a %×M0),增量原则:轻度疼痛(3<NRS<5):a为25~50,中度疼痛(5≤NRS<7):a为50~75,重度疼痛(NRS≥7):a为75~100,均取范围最小值。
对照组:灌注入5 d预估量的吗啡注射剂[5×(M0+M1)],用生理盐水稀释至240 ml。
右美托咪定组:灌注5 d预估量的吗啡注射剂[5×(M0+M1)]+右美托咪定720 μg (3 μg/ml),用生理盐水稀释至240 ml。
(2)疼痛控制方法及剂量调整:利用电子自控镇痛泵对病人进行静脉电子自控镇痛,采取“背景输注+病人自控”模式输注吗啡。首次设置电子镇痛泵的参数,采用1/2的预估剂量(24 ml)持续给药作为背景剂量,PCA量采用2倍的背景剂量,具体设置如下:背景量(持续量):240 ml÷5÷24×1/2 = 1 ml/h;PCA量(单次增加量/Bolus量):1 ml×2 = 2 ml/次;锁定时间15 min。镇痛泵安装结束后将其交给病人并要求其随身携带,并教会病人及其家属如何正确使用,并叮嘱病人一旦察觉异常应于第一时间向医护人员反映。开始实施静脉自控镇痛后停用其他阿片类镇痛药,并在第1个24 h应密切监测病人的生命体征,尤其应注意病人有无呼吸抑制和意识的改变。
病人自觉疼痛加重时,通过自控按钮注射解救爆发痛剂量的吗啡。每8 h采用NRS 法评估止痛疗效,每日平均NRS作为统计学数据。每24 h根据止痛疗效和PCA次数决定是否调整背景剂量。若前24 h病人使用自控按钮的次数N > 3次,则调整电子镇痛泵的背景量(持续量):PCA量×(N-3)+前24 h吗啡总量/ 24 h;若静脉自控镇痛72 h后病人自觉自控镇痛泵止痛无效或72 h内要求撤换自控镇痛泵时可撤换自控镇痛泵。若病人出现肿瘤进展或肝肾功能损伤等意外,采取出组处理。
4.疗效评定标准和观察指标
(1)有效止疼标准:使用NRS检测病人的疼痛程度,参考NCCN成人癌痛指南,将有效止痛标准定义为:①病人自觉疼痛缓解且NRS评分≤3;②NRS评分4~6,但病人自觉疼痛能够忍受,需解救的爆发痛发生次数≤3次[11]。

表1 两组病人的一般情况Table 1 General condition of two groups of patients
(2)统计PCIA前、PCIA后1 d、2 d、10 d、20 d和30 d时病人NRS评分和有效止疼的病人数量。
(3)统计PCIA前、PCIA后1 d、2 d、10 d、20 d和30 d时吗啡及右美托咪定的每日用量。
(4)生活质量调查:采用肿瘤病人生活质量评分表[12]评估两组病人于PCIA前、PCIA治疗后2 d、10 d、20 d和30 d的生活质量。该评分表包括食欲、睡眠、精神状态、疲乏状态和日常生活5个方面,采用1~5分制,1分为最差,5分为最好,见表2。
(5)满意度调查:满意度采用0~10数字评分法:0为极度不满意,10为非常满意。
(6)不良反应发生率:记录治疗过程中恶心呕吐、便秘、皮肤瘙痒、头晕、排尿困难、呼吸抑制、幻觉等不良反应发生情况。
5.统计与分析
将所有数据输入Excel文件,并对各个时间段未出组的病人的数据进行初步整理,然后利用SPSS 17.0软件进行数据统计处理,以平均数±标准差(±SD) 表示;组间计量资料以t检验分析,计数资料采用卡方检验,组内重复测量的数据采用重复测量的卡方检验;P<0.05为差异有统计学意义。
结 果
1.病人治疗前后镇痛效果
119例病人中,有86例病人在自控镇痛1 d内达到镇痛目的,其中对照组有40例;右美组有46例。103例在进行自控镇痛2 d达到理想镇痛效果,镇痛有效率为86.55%,其中对照组有51例,右美组有52例;自控镇痛治疗1月后,4例病人因为病情进展死亡而出组(对照组2例,右美组2例),4例病人因出现肝肾功能的损伤而出组(对照组2例,右美组2例),5例病人因治疗效果不佳或采用其他治疗方式出组(对照组2例,右美组3例)。经卡方检验可得,在各个时间段,两组病人镇痛的有效率之间没有显著性差异(见表3)。
分析两组病人的NRS评分,组间比较经t检验分析发现:两组病人的NRS评分在各个时间段均无显著性差异;组内不同时间段NRS的比较经过重复测量数据的方差分析可得:两组病人在自控镇痛治疗1 d、2 d、10 d、20 d和30 d的NRS评分均显著低于PCIA治疗前(P<0.01),而在10 d内两组病人的NRS评分逐渐降低,而在20 d和30 d的NRS评分升高,且差异显著(P<0.05,见表4)。

表2 肿瘤病人生活质量评分表Table 2 Quality of life score of cancer patients

表3 两组病人镇痛有效人数Table 3 Numbers of patients with effective analgesics in two groups
2.病人每日等效注射吗啡和右美托咪定剂量
组内比较:随着治疗时间的延长,两组病人每日注射的吗啡剂量逐渐增加;且与自控镇痛前相比,两组病人PCIA治疗后使用吗啡剂量均显著增高(P<0.01);PCIA后30 d时,两组病人注射的吗啡剂量均显著高于其他的时间点的吗啡注射剂量。
组间比较:在PCIA后的各个时间点,右美组病人的每日注射的吗啡剂量均显著的低于对照组(P<0.01)。
随着自控镇痛时间的延长,右美组病人每日注射的右美托咪定的量逐渐增加,且与自控镇痛1 d相比,在自控镇痛10 d后的各个时间点的右美托咪定的注射剂量显著的升高(P<0.01),而其他各个点间均不具有统计学差异(见图1)。
3.两组病人的生活质量得分及满意度得分
组间相比,在各个时间段,两组病人的生活质量得分和满意度得分之间比较均无显著性差异。组内比较,与PCIA前相比,在PCIA后2 d、10 d、20 d和30 d的生活质量得分和满意度得分均显著升高(P<0.01,见表5)。
4.两组病人用药后不良反应情况
两组病人在PCIA治疗前不良反应为便秘和恶心呕吐,其中对照组中便秘有16例(27%),恶心呕吐8例(14%),右美组中有15例(25%),恶心呕吐7例(12%),两组之间的便秘和恶心呕吐副作用发生率之间没有显著性差异,在治疗前未见嗜睡、排尿困难和瘙痒等不良反应。

图1 两组病人每日静脉注射吗啡剂量(mg/d)和右美托咪定剂量(μg/d)AP<0.01,与本组PCIA用药前相比;BP<0.01,与本组PCIA用药1 d相比;CP<0.01,与本组PCIA用药2 d相比;DP<0.01,dP<0.05,与本组PCIA用药10 d相比;EP<0.01,eP<0.05,与本组PCIA用药20 d相比;*P<0.01,两组之间相比Fig.1 Daily intravenous injection of morphine (mg/d) and dexmedetomidine (μg/d) in the patients of two groups AP<0.01,compared with group pre-PCIA; BP<0.01,compared with PCIA 1 d; CP<0.01,compared with PCIA 2 d; DP<0.01,dP<0.05,compared with PCIA 10 d; EP<0.01,eP<0.05,compared with PCIA 20 d;*P<0.01,compared between the two groups.
组内比较,随着治疗时间的延长,两组病人便秘和恶心呕吐的人数逐渐增加,并且在自控镇痛2 d时出现嗜睡的副作用,而且随着治疗时间的延长,两组病人嗜睡的例数逐渐增多。
组间比较发现,在自控镇痛20 d和30 d,右美组便秘和恶心呕吐的发生率显著的低于对照组(P<0.05),在自控镇痛30 d,右美组病人嗜睡的发生率也显著低于对照组(P<0.05,见表6)。
表4 两组病人NRS评分 (±SD)Table 4 NRS scores of patients in two groups (±SD)

表4 两组病人NRS评分 (±SD)Table 4 NRS scores of patients in two groups (±SD)
aP<0.01,与本组PCIA前相比;bP<0.05,与本组PCIA用药1d相比;cP<0.05,与本组PCIA用药2 d相比;dP<0.05,与本组PCIA用药10 d相比aP<0.01,compared with the pre-PCIA group; bP<0.05,compared with this group of PCIA 1 d; cP<0.05,compared with this group of PCIA 2 d;dP<0.05,compared with this group of PCIA 10 d.
治疗时间Time (d)人数(对照组/右美组)Numbers (CON /Dex)NRS评分NRS scorestP对照组CON group右美组Dex group Pre-PCIA59/606.33±1.576.51±0.85-0.170.86 1 59/602.93±1.36a2.75±1.06a0.810.42 2 59/601.93±0.97ab1.88±0.74ab0.320.75 1057/571.83±1.82ab1.62±1.33ab-0.640.53 2055/542.88±0.92acd2.67±0.93acd1.190.24 3053/532.43±0.82a2.57±0.93ad-0.820.41
讨 论
目前,疼痛是肿瘤病人最为常见和难以控制的症状之一,疼痛会导致癌症病人产生焦虑、抑郁、乏力、失眠以及食欲减退等症状,显著影响病人的日常活动、自理能力、社会交往和整体生活质量。解除疼痛,提高病人有限时间的生活质量已成为首要解决的问题[11]。
在癌痛病人当中,大部分癌痛病人经过WHO三阶梯镇痛指南治疗后癌痛可得到控制,但仍有10%~15%癌痛病人(特别是一部分癌症晚期病人)经过规范化药物治疗1~2周后,病人疼痛缓解仍不满意和(或)不良反应可耐受,发展为难治性癌痛病人[13];为提高难治性癌痛病人的止痛效果,改变用药途径是常用的阿片转换方式之一[14],特别是针对那些口服困难的晚期癌痛病人,将等效转换的吗啡注射液经静脉自控镇痛(PCIA)的方法持续给药可以避免因为复杂的药物组合和频繁的用药等原因导致的病人用药意愿和依从性下降,止痛疗效也可因此得到改善[15];本研究对病人进行静脉自控镇痛,采取“背景输注+病人自控”模式输注吗啡;所有的病人注射的吗啡剂量均根据病人PCIA前24 h等效口服吗啡剂量,此种方法一方面符合癌痛规范化用药的方法[16],另一个方面可以提高病人的止痛疗效[17];背景输注的方式可以保证病人疼痛的减缓而不会引起吗啡的用量过大,而产生比较严重的副作用;而针对某些病人背景输注剂量的不足,病人可以通过自控的模式增加吗啡的用量,从而达到良好的阵痛效果;该种方法在滴定阶段(开始~72 h)安全性高,又利用了PCA快速给药的优势,可以在不增加不良反应的前提下最大限度的满足病人药物需求,该种方法在我院已经使用多年,且取得了良好的临床效果。但是长期应用PCIA对阿片耐受病人进行疼痛控制,相关经验较少。同时,长期大剂量阿片类药物应用,尽管使病人的疼痛得到控制,但其带来的严重不良反应,如嗜睡、幻觉、恶心呕吐以及便秘等症状,让病人承受更大的痛苦[18]。本研究中病人24 h使用等效的口服吗啡剂量最小剂量为177 mg,均属于阿片耐受病人[19],且随着药物剂量的增加出现了恶心呕吐、便秘等不良反应。因此,在达到良好镇痛的同时,降低阿片药物的应用剂量,减少其不良反应,使癌痛病人生活质量得到进一步提高,是晚期难治性癌痛急需解决的问题。
表5 两组病人生活质量和满意度评分 (±SD)Table 5 Quality of life and satisfaction scores of patients in two groups (±SD)

表5 两组病人生活质量和满意度评分 (±SD)Table 5 Quality of life and satisfaction scores of patients in two groups (±SD)
*P<0.01,与本组PCIA用药前相比;*P<0.01,compared whth Pre-PCIA group.
右美组Dex Pre-PCIA59/60 9.84±1.4510.12±1.531.84±0.431.76±0.52 2 59/6016.41±2.12*16.36±2.52*6.03±1.26*6.22±1.64*1057/5718.52±3.53*19.32±5.32*7.51±1.48*7.13±2.54*2055/5417.43±4.45*18.11±3.53*7.54±1.68*7.52±1.83*3053/5317.04±3.38*17.93±4.75*7.06±2.42*7.37±1.56*治疗时间(天)Time (d)人数(对照组/右美组)Numbers (CON /Dex)满意度评分Satisfaction score对照组CON生活质量评分Score of quality of life右美组Dex对照组CON
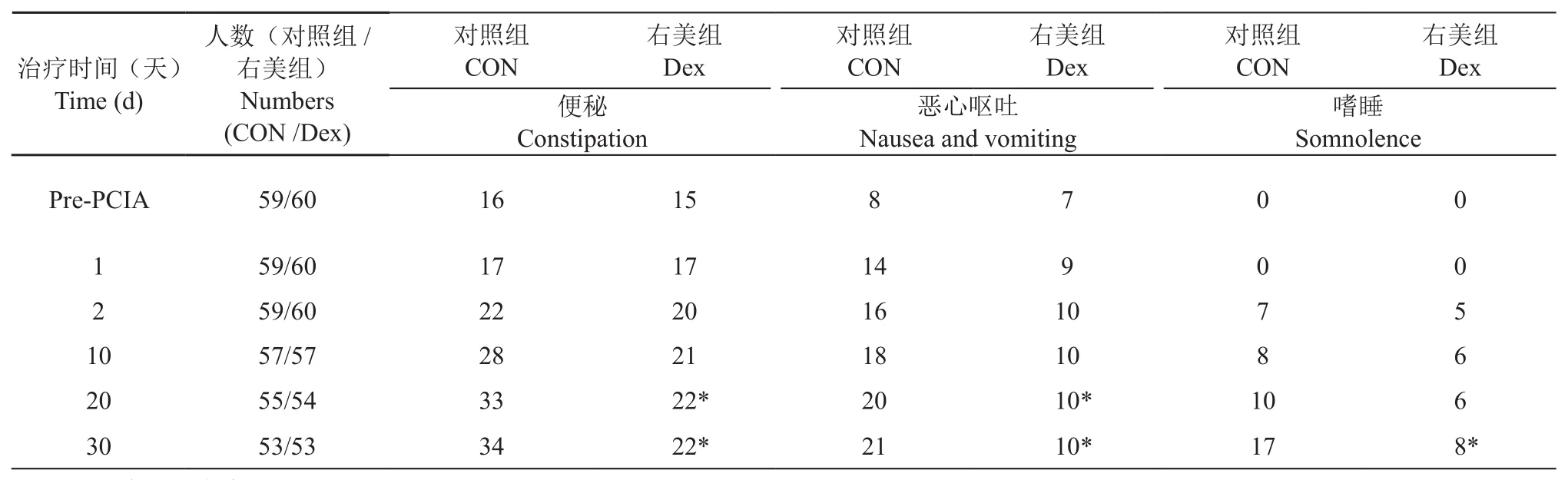
表6 两组病人不良反应人数(n)Table 6 Number of patients with adverse reactions in two groups (n)
右美托咪定可通过激动交感神经末梢和脊髓的α2受体而发挥辅助镇痛作用,其与吗啡的作用位点及机制不同,联合应用时可产生协同镇痛、镇静效应,改善睡眠和疼痛的恶性循环。文献报道,右美托咪定联合吗啡静脉输注,可增强吗啡的镇痛作用,减少吗啡用量及副反应,延长镇痛时间[20,21]。但是关于右美托咪定自控镇痛应用于癌痛病人,相关报道不多,且多为个案报道[9,10]。本研究采用PCIA给药治疗晚期难治性癌痛病人,结果表明:无论是单纯吗啡还是右美托咪定复合吗啡采用PCIA给药,48 h总体镇痛有效率达到86.55%(见表3),并且PCIA能够显著降低病人的NRS评分(见表4),改善病人的生活质量(见表5)和提高病人的满意度(见表5),两组病人在相同的PCIA时间,其有效镇痛率(见表3)、NRS评分(见表4),生活质量评分(见表5)和病人满意度(见表5)方面没有显著性差异,而病人在自控镇痛后的各个时间点右美组病人所使用的每日吗啡剂量显著的低于对照组(见图1)。这表明右美托咪定复合吗啡可以达到与单纯使用吗啡相同的镇痛效果,并且可以显著降低吗啡的使用剂量。这与既往研究结果相一致[9,20]。
本研究从方便病人、切合临床的角度,右美托咪定与吗啡注射使用了同一个自控镇痛泵混合注射,所以随着吗啡注射剂量的增多,右美托咪定的注射量也逐渐的升高,右美托咪定剂量的不恒定对于本研究来说是一个不确定的因素,但是在PCIA治疗后第2 d、10 d、20 d和30 d右美的使用剂量没有显著性变化,这相当于在治疗的第2 d、3 d、10 d、20 d和30 d,右美托咪定的量是相对恒定的;同时本研究中整个过程中右美托咪定的平均用量为0.11~0.15 μg/(kg·h),这远低于围术期镇痛或ICU镇痛的剂量0.2~0.6 μg/ (kg·h)[20,21],这也表明小剂量的右美托咪定能够增强吗啡的镇痛作用,减少吗啡的用量。
难治性癌痛病人使用大剂量阿片类药物镇痛治疗可带来诸如便秘、恶心呕吐、幻觉、肌阵挛和免疫抑制等不良反应[22]。本研究中两组病人入组前均出现了便秘、恶心呕吐的不良反应;在进行自控镇痛后,随着治疗时间的延长;两组病人便秘和恶心呕吐的人数逐渐增加,并且在自控镇痛2 d时出现嗜睡的副作用,并且随着治疗时间的延长,两组病人嗜睡的例数逐渐增多,而右美组便秘、恶心呕吐和嗜睡的发生率显著的低于对照组,这可能与右美托咪定降低吗啡的用量有关。
总之,右美托咪定联合吗啡静脉自控镇痛可有效、安全、稳定地控制癌痛,且可以减少吗啡的应用剂量,降低不良反应的发生,显著提高了病人的生存质量,适合晚期难治性癌痛病人的治疗,值得临床推广应用。
