重审道尔顿原子论的建立:1803还是1805?
2019-04-22徐雅纯佟艺辰
徐雅纯 佟艺辰
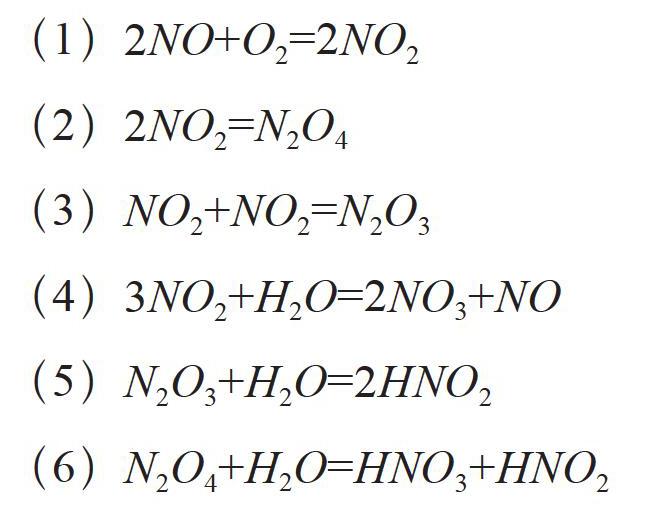
摘 要 化学史家们往往将1803年9月的第一份相对原子质量表看作道尔顿原子论形成的时间点,但是道尔顿本人在1810年的讲座中则称原子论诞生于1805年。这一分歧源于道尔顿与化学史家们对其原子论工作的不同理解。道尔顿认定原子论的证明需从物理角度出发,故自称1805年完成证明。然而纵观原子论发展的历史,道尔顿无法从物理角度证明原子论,其工作实则达成了化学上的证明。因此,1803年9月实为其原子论真正形成的时间点。
关键词 道尔顿 贝托莱-普鲁斯特之争 定比定律 化学原子论 物理原子论
中图分类号 N09: O64
文献标识码 A
道尔顿(John Dalton,1766—1844)研究中一个广受关注的问题就是其原子论思想是如何建立的[1—7]。因為道尔顿的第一份相对原子质量表出现在1803年9月6日的笔记中([4],p.26),所以主流观点认为道尔顿的原子论在此时间点前后诞生①。然而在1810年,道尔顿曾在皇家科学院(Royal Institution)进行一系列正式讲座。在自述其思想发展时,他将原子论诞生的时间节点放在了1805年([4],p.16)。为何道尔顿违反常理地推迟了他原子论的建立时间?对于这一现象,不同的化学史家给出了不同的解释。罗斯科(H. Roscoe)与哈登(A. Harden)二人认为,道尔顿在演讲中所提到的1805年,实则指1803年([4],p.25)。纳什(L. Nash)认为,在1803年9月—1804年8月之间,道尔顿因未认识到化学原子论的潜在价值而暂时放下原子论的工作;1804年8—9月之间重新燃起对原子论的兴趣,并在1805年重新开始相关工作[1]。萨克雷(A. Thackray)同样认为道尔顿曾在1803—1804年间暂时放下原子论的工作。此外,他认为18世纪流行的亲和力化学对原子的拒斥,进一步加剧了道尔顿对第一份相对原子质量表的忽视[2—3]。然而,道尔顿于1805年发表的论文“论水和其他液体对气体的吸收”(On the Absorption of Gases by Water and Other Liquids)的末尾,附有一份“气体物质和其他物质终极微粒的相对质量表”,并且宣称“就我所知,这一对物质终极微粒的相对质量的研究是全新的”([8],pp. 286—287)。该论文宣读于1803年10月,意味着在1803—1805年间道尔顿定然注意到了这项工作的成功之处。同时,道尔顿将“原子”仍旧称作“终极微粒”(ultimate particles),表明道尔顿在1805年前仍未完全确认其原子论,因此放弃了带有本体论意味的“原子”概念,而采用了相对保守的“终极微粒”概念。就以上所提及的文献中所含有的时间点之间的冲突,迫使罗克(A. Rocke)采取了折中的路线。他采纳了兰瑟姆(Joseph Ransome)的说法,认为道尔顿很早就开始思考原子论,因此在每次重新回忆过去的时候难免有所错误[5]。
本文重审道尔顿的原子论的建立,认为这一问题并非源于无意,实则体现出道尔顿对原子论的理解。道尔顿的反常行为表明其所设想的原子是一种本体论上的存在,必须在给以原子以物理性质上的描述后方能证明这一理论。因此,当道尔顿在1805年确定了原子的所有物理性质时,他才认定自己正式建立了原子论。在理解道尔顿主观意愿的同时,化学史家仍需要从原子论发展的进程去理解道尔顿的工作。道尔顿仅仅从化学上证明原子的存在,因此1803年9月6日才是其原子论诞生的真正节点。
一 大气研究:道尔顿从物理学研究转向化学研究的背景
1803年前,道尔顿的研究兴趣主要在气象学、热学、气体化学(pneumatic chemistry)①等方面。从出版的论文及著作来看,道尔顿早年较为关注物质的物理性质,对化学反应关注较少①。道尔顿因气象学走入大气相关研究。
18世纪末,有关大气的研究焦点集中在测定大气中氮气与氧气各自含量与确定大气中不同气体间的关系。对于后者,当时存在两种观点:一是混合大气说,认为二者混合在一起,相互之间并未发生化学反应;二是化合大气说,认为二者之间发生了化学反应,以亲和力相联结。
化合大气说正是化学亲和力理论下的产物。早在1793年,道尔顿就明确反对大气中的气体以化学亲和力相联结[9]。1800年,当时最为重要的化学家之一贝托莱(C. L. Berthollet,1748—1822)撰文为化合大气说做出了修正,称氮气与氧气间以弱亲和力相联结,以解释化合大气说中存在的问题——二者间若有亲和力为何不产生新化合物[10]?
对于贝托莱的修正,道尔顿认为,既未生成新物质,就不应以亲和力进行解释,故应认为大气以混合形式存在([11],p. 538)。但混合大气说无法解释大气同质现象,即大气中的氮气、氧气、水蒸气等气体不单独分层。为了解释这一现象,道尔顿扩展了牛顿《原理》卷二命题23的解释范围。牛顿认为弹性流体是由物质性的极小微粒或者原子组成,它们之间的离心力大小与间距成反比[12]。道尔顿于1801年提出道尔顿分压定律——如果两种气体混合在一起,相互之间不存在斥力;每种气体粒子有着各自的压强与重量,二者互不影响([11],p.536)。分压定律解决大气同质现象的思路,是大气内同种气体粒子相互排斥,不同气体粒子互不影响,因此所有气体能在整个大气层中扩散而不分层。
与大气相关的研究推动道尔顿开始关注化学领域。18世纪中后期亲和力化学一直占据着主导地位。到了18世纪末至19世纪初,亲和力化学处于理论的重大发展时期。化学仪器的升级与化学家们认识的深入,使得定量分析物质组成成为可能。就物质组成问题,亲和力理论发展出现两个分支。一派是持有传统亲和力观点的普鲁斯特(J. L. Proust,1754—1826)。在1799年有关氧化铜的一篇论文中,普鲁斯特提出亲和力是化学结合的原因,不同物质间的亲和力为恒定的,因此所形成的化合物由确定比例组成,也即今日所知的定比定律[13]。贝托莱则持有相反观点。1799年在随拿破仑出征埃及的旅途中,为了解释观察到的化学反应的逆反应,贝托莱提出亲和力、聚合力(Cohesion)与卡路里力三者共同作用于化学反应,达成化学平衡后化合物形成。反应条件的不同导致反应物内三种力不同,由此导致化合物内的物质组成比例有所变动[14]。1801年,贝托莱发表“论亲和力定律”(Recherches sur les lois de laffinité)①正式回应普鲁斯特。贝托莱-普鲁斯特之争由此开始。
二 化学原子论的建立:定比定律与相对原子质量表
自1803年始,道尔顿开始增加气体化学反应的实验。在众多实验中,最为重要的,也是最受研究者争议的实验是一氧化氮的氧化实验。在这一实验中,道尔顿于水面上设置了狭管与宽瓶两种不同的反应条件,得出:反应掉100体积大气(即21体积左右的氧气),两种反应条件下所消耗的一氧化氮比例正好为1:2。该实验结果有力地支持了定比定律。道尔顿在发表这一实验结果时公开支持定比定律,表示“氧元素可能以特定的比例与氮气结合,或者是以这一比例的两倍来结合,但是不可能以某种中间比例来结合”([15],p. 250)。实验所涉及的反应方程式如下:
(1) 2NO+O2=2NO2
(2) 2NO2=N2O4
(3) NO2+NO2=N2O3
(4) 3NO2+H2O=2NO3+NO
(5) N2O3+H2O=2HNO2
(6) N2O4+H2O=HNO3+HNO2
六种化学反应中,反应(2)(3)均可在常温下发生逆反应。在道尔顿所设置的两种反应条件下,六种反应均可同时发生。在狭管条件(3/10英尺宽,5英尺长)下,道尔顿直接将100体积的大气②通入36体积的一氧化氮。在宽瓶条件(未给出具体尺寸)下,道尔顿缓慢将100体积大气通入72体积的一氧化氮,使之成为一个薄空气层,之后迅速搅动。两个实验均剩余79或80的气体,道尔顿表示前者未显示出氧气或一氧化氮的特征,后者为纯氮气。道尔顿进一步说明,若在宽瓶条件下,使用少于72体积的一氧化氮,则会残余氧气;若使用多于72体积的一氧化氮,则会有部分一氧化氮未反应。最终,检查实验中气体与水的产物,前者均为硝酸,后者均为亚硝酸[15]。
对于实验结果,道尔顿认为在狭管条件下一份氧气与一份一氧化氮结合,宽瓶条件下则与两份一氧化氮结合。同时,道尔顿也观察到气体反应在狭管中的速度比在宽瓶中要慢得多。道尔顿对此的解释是反应容器宽度及搅动的影响([15],p. 250)。这一现象实则与所涉及的化学反应的速率有关。反应(1)速度较慢,反应(2)(3)(5)(6)则速度很快。狭管中的氮元素与氧元素间的反应以反应(1)为主,宽瓶中则更多地涉及反应(2)(3)。
该实验所涉及的反应极为复杂,会产生NO、N2、N2O3、N2O4、亚硝酸、硝酸等多种物质,难以控制。另一方面,实验结果易受各种条件影响,例如水中溶解的氧气、大气中的N2等,极有可能导致数据偏差。而道尔顿的实验结果过于工整,招致化学家史们的怀疑。此外,道尔顿的实验笔记上,这一实验结果第一次出现在1803年10月10日—11月13日的笔记中([4],p. 35),而第一份相对原子质量表出现在1803年9月。两者时间极为接近。因此有研究者认为这一实验正是道尔顿在化学原子论下推导出的 [16]。
尤瑟尔曼(M. Usselman)等人运用重复实验的方法,并通过程序拟合反应中产物的形成,重新考察了道尔顿的这一实验,认为“一氧化氮/氧气实验是真实记录并正确报告的”,但是,“如果他(即道尔顿)的脑海中没有一个预期的结果,也不能发现第一个整数结合比例的例子” [17]。
尤瑟尔曼等人的实验结果较为可信,但并未给出道尔顿脑海中有所预期的原因。考察道尔顿自身科学背景与进行该实验时的化学史背景,道尔顿应当知晓贝托莱与普鲁斯特的争论,并受到普鲁斯特定比结论的影响①。在定比定律的设想与实验的双重作用下,道尔顿最终认定一氧化氮消耗氧气比例必然呈1:2。因此在1803年10月10日—11月13日的笔记中留下记录。而早在第一份相对原子质量表出现的1803年9月,道尔顿就已接纳普鲁斯特定比定律的思路。第一份相对原子质量表就是定比思路的简单发展。
道尔顿的原子表现为独立的单个粒子,一对一结合形成物质,原子的外部由热质所包裹。若将氢原子的质量设置为1,因定比定律,其余原子的相对原子质量就可以从化合物的元素比例中求得。道尔顿此前主要研究气体,因此他的第一份相对原子质量表仅包括氧、氮、碳、硫四种非金属元素的相对原子质量,加上氢共计五种元素。第一份相对原子质量表正是在原子论和定比定律的思路下做出的成果。这一思路又反过来推动他在10—11月间坚定了定比定律的结论,得出一氧化氮的氧化实验的实验结果必然为1:2。定比定律与一氧化氮的氧化实验相辅相成,推动道尔顿继续推进这一研究思路。在1805年发表的论文中,道尔顿刊登一份包含氢、氮、氧、水、硫酸、酒精等21种物质的相对原子质量表[8]。
定比定律针对所有化合物的组成,仅有单一实验结果并不足以支撑这一结论。于是1804年中,道尔顿不仅继续一氧化氮的氧化实验,也将实验对象扩展到各类含碳的气体氧化物,包括礦坑气(成分主要是甲烷)与乙烯等。从原子论思想出发,已得定比定律,倍比定律昭然若揭。道尔顿的好友汤姆森(Thomas Thomson,1773—1852)表示,道尔顿于1804年确定,如果将矿坑气与乙烯中含碳量设为相同,前者的氢含量是后者的两倍([7],页327)。这意味着道尔顿于1804年接受了倍比定律。
三 物理原子论的建立:溶解度实验与原子的物理性质
因相对原子质量表与定比定律及其背后的原子假设紧密相关,故此前的化学史家们将1803年9月看作道尔顿原子论思想诞生的时间点,而将他此前的研究描述为导向原子论思想的一系列前提工作。普遍的研究思路将道尔顿思考原子论的开端定位到某类实验或研究;在这类实验或研究的推动下,道尔顿开始以原子论视角省视问题,并不断完善其思想,最终在1803年9月写下相对原子质量表,形成原子论①。这一思路背后暗含着,道尔顿的原子论存在一个开端——在该时间点上,道尔顿“转向”了原子论。因道尔顿与他的朋友各自提供的一手文献相互矛盾,所以研究者们对“何时转向”给出的结论大相径庭,无法判决②。罗克(Alan J. Rocke)认为道尔顿很早就开始思考原子论的思路。这虽绕开了这一问题,却并未道出道尔顿为何早就持有原子论思想。这需要回到18世纪英国的科学背景中去。
从18世纪的整体科学背景来看,道尔顿的原子论思想并非原创。在17世纪末18世纪初,原子论观点并不是一个全新的观点。相反,“继波义耳的工作之后,物质的本质是微粒(particulate)在17世纪晚期开始成为被广为接受的化学思想基础……原子论思想在18世纪化学家中颇为常见”([2],p. 36)。英国更是一向有着原子论思想的传统。研究者们勾勒了从17世纪早期到19世纪的原子论发展史[20—22],其中的一系列人物既包括著名的波义耳(Robert Boyle,1627—1691)、牛顿、道尔顿等,也涉及不为人所熟知的托马斯·哈利奥特(Thomas Harriort,1560—1621)、沃尔特·沃纳(Walter Warner,1563—1643)、沃尔特·查尔顿(Walter Charleton,1619—1807)等等。在道尔顿同时代存在一批被称作“伦敦原子论者”的学者,包括希金斯叔侄(Bryan & William Higgins)、威廉·奥斯汀(William Austin)等。希金斯叔侄曾在1814—1819年就原子论思想的优先性与道尔顿发生争论。格罗斯曼(M. I. Grossman)论证,这一批伦敦原子论者,尤其是布莱恩·希金斯,对道尔顿的原子论思想形成产生了重要的影响[23—24]。
笔者认同罗克的思路,认为道尔顿早在青年时代就已经熟知原子论思想,并不存在“转向”。但不同于罗克的是,笔者认为,作为本体论的原子论思想与道尔顿本人具体的原子论理论之间存在着差异。受到当时科学氛围的影响,道尔顿本人很早就用原子来思考物质组成。但是,原子论要想成为一个真正的理论,必须与实验数据相结合。在这一意义上,道尔顿的原子论思路不存在一个起源的时间节点,但存在原子论作为一种科学理论形成的时间节点①,且正与道尔顿对原子论的设想相关。
因为道尔顿早年信奉牛顿,牛顿的粒子论必然对他有所启迪。牛顿粒子论中的“粒子”为物理上的存在。受其影响,道尔顿所设想的原子也同样在物理层面上存在,即他的原子不仅仅是一个理论假设,更是一个物理实在。在1803年写下相对原子质量表后,道尔顿仅能在化学计算上说明原子存在,并无法从物理实体角度证明原子存在。道尔顿计算相对原子质量的本意是希望建立原子重量与溶解度的关系——较轻的原子更简单,也更易溶解;较重的原子更复杂,不易溶解([8],p. 286)——从而将原子的物理性质与经验联系起来。然而通过进一步的实验与计算,道尔顿发现二者间并无特殊的数学关系。这说明原子可能具有不同的尺寸,为道尔顿的原子研究打开了一条新的思路,即用溶解度的数据计算相对原子直径,为原子在物理层面的存在提供证据。因此,在1803年9月6日写下第一份相对原子质量表后,道尔顿借助溶解度研究的相关实验结果,以水原子的直径作为1,于同年9月19日写下了第二份包含“相对原子直径”的原子表([4],p. 41),计算方式为:因原子外包裹着厚厚的热质,化合物的原子半径并非是单一原子直径的简单相加。
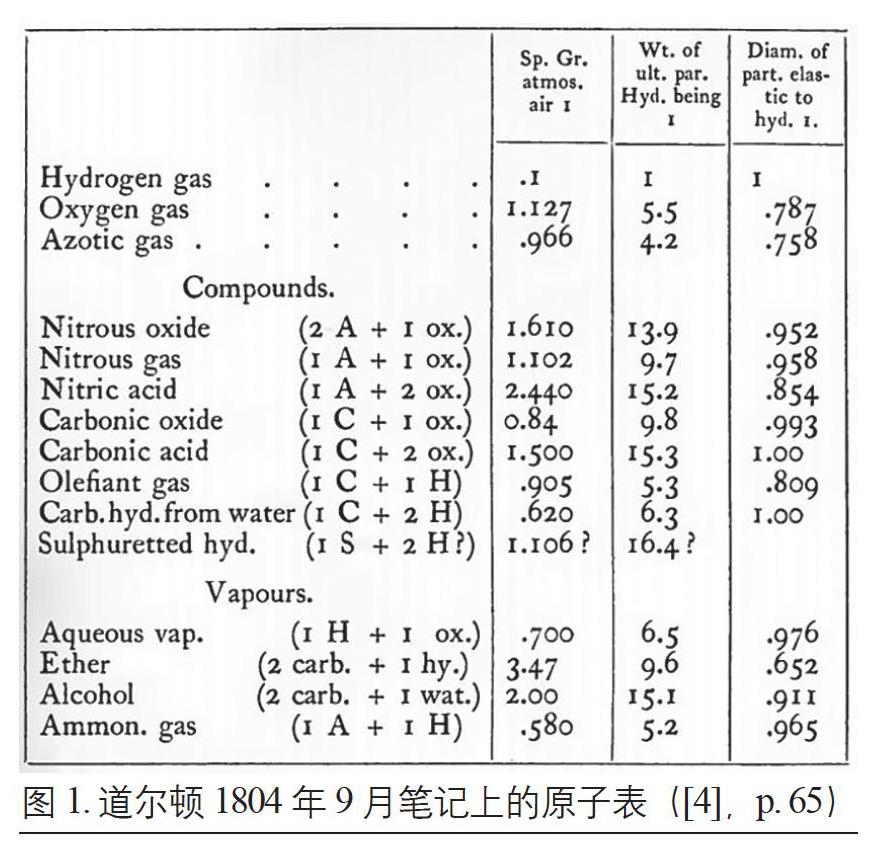
1803年9月的原子表是原子论的初步尝试。1803年底—1804年,道尔顿一方面继续各类化学实验,确定各类物质的原子组成,并将原子表中的元素扩展到金属,计算出更多相对原子重量([4],p. 83)。另一方面,他测定了各类气体溶于水的溶解度及进行有关热的实验,包括水受热膨胀、测定水密度最大时的温度等。道尔顿以热质来解释溶解、液体膨胀等物理现象及分压定律中同种粒子相互排斥的假设,并尝试用相关的实验数据去计算原子直径,以发展其原子论。1804年9月,道尔顿将氢原子的原子直径设为1,写下了一份较为完整的原子表,包含了“比重”(Sp. Gr.)、“相对重量”和“相对原子直径”等参数(图1)。
原子表中的原子直径数据大多较为接近1,在考虑误差的前提下,道尔顿无法确定所有原子的原子直径是否一致。直到1805年,道尔顿在考虑化学结合的发生问题时,认定原子尺寸必须不一致——原子尺寸小则易发生化学反应,尺寸大则不易发生化学反应([4],p. 13)。此时,道尔顿尝试确定了原子的所有物理特征:原子不可破坏;不同种类的原子拥有不同的形状、大小、重量;原子外包裹一层热质,热质密度与距离成反比([25],页52,71)。因此,他开始着手写作《化学哲学新体系》一书[26],笔记中记载的实验数量也因此减少([4],p. 69)。经过两年多的工作,道尔顿终于在1808年发表了《化学哲学新体系》第一卷的第一部分,正式提出了原子论思想。
四 结语
道尔顿的原子论横跨物理与化学两个学科。考察其原子论工作时,必须考虑化学原子论与物理原子论两个部分①。道尔顿设想的路线是物理原子论,通过测量不同物质的溶解度作出了第一份相对原子直径表,希望对原子大小给出定量数据。然而这一研究路线在19世纪初的科学条件下是无法实现的,且物质的溶解度与原子大小并无真正关系。故道尔顿的原子论中的相对原子直径实为一组错误的概念,难以用来解释硬度、密度、挥发性等物理性质。因此广为物理学家所诟病。相对原子质量则更易为人所接受,由此导致了原子论在物理中的接受比在化学中晚了50年[27]。
就原子论思想的形成问题,道尔顿与化学史家们认知上的这一差异,背后所体现的是历史当事人与历史研究者之间因科学知识背景不同,对同一历史事件产生不同的理解。对于道尔顿而言,原子论是一个古已有之、从未被证明的思想传统,其真实性有待研究。要想证明原子的存在,必然要从物理学入手,描绘其物理性质,方能证明本体论意义上的原子论。因此,他更为看重1805年的工作——此年确定了原子的各类物理性质。而当化学史家们去回顾这段历史时,已然带有现代原子论发展的科学背景。此时原子论已成为科学大廈的基础理论。在回顾道尔顿原子论的工作之时,化学史家们不必再去考虑原子论的真假问题,仅需考虑其工作在原子论发展史上真正有价值的部分。道尔顿原子论仅仅做到了化学上的证明。因此,化学史家们自然看重1803年9月的相对原子质量表,将之作为道尔顿原子论诞生的时间点。
回顾历史,需沉浸在历史语境之中,理解历史当事人所持有的观点与概念,方能理解其所作所为和对当时科学发展的贡献。而当史家对历史进行价值判断时,又需站在自身所处时代来评判过去。就道尔顿原子论的诞生问题,化学史家们需要理解道尔顿在1810年所言背后的原因——道尔顿的物理原子论路线。而在评判其原子论的诞生时,则需按今天的标准,回到1803年第一份相对原子质量表。
致谢 感谢袁江洋教授对本文的指导。
参考文献
[1] Nash, L.. The Origin of Dalton's Chemical Atomic Theory[J]. Isis, 1956, 47(2): 101—116.
[2] Thackray, A.. The Origin of Dalton's Chemical Atomic Theory: Daltonian Doubts Resolved[J]. Isis, 1966, 57(1): 35—55.
[3] Thackray, A.. The Emergence of Daltons Chemical Atomic Theory: 1801—1808[J]. The British Journal for the History of Science, 1966, 3(9): 1—23.
[4] Roscoe, H., Harden, A.. A New View of the Origin of Daltons Atomic Theory[M]. London: Johnson Reprint Corp., 1970.
[5] Rocke, A.. In Search of El Dorado: John Dalton and the Origins of the Atomic Theory[J]. Social Research, 2005, 72(1): 125—158.
[6]盛根玉. 科学原子论的创立者——道尔顿[J]. 化学教学, 2010, (10): 53—57.
[7] 托马斯·汤姆森. 化学史[M]. 刘辉, 池亚芳, 陈琳译. 北京: 中国大地出版社, 2016.
[8] Dalton, J.. On the Absorption of Gases by Water and other Liquids[J]. Memoirs of the Literary and Philosophical Society of Manchester, 1805, 2(1): 271—287.
[9] Dalton J.. Meteorological Observations and Essays[M]. London: Harrison & Crosfield, 1834. 134—135.
[10] Berthollet, C.. Observations Eudiométriques[J]. Annales de chimie, 1800, 37: 73—85.
[11] Dalton, J.. Experimental Essays: on the Constitution of mixed Gases; on the Force of Steam or Vapour from Water and other Liquids in different temperatures, both in a Torricellian Vacuum and in Air; on Evaporation; and on the Expansion of Gases by Heat[J]. Memoirs of the Literary and Philosophical Society of Manchester, 1798—1802, 1(5): 535—602.
[12] 伊薩克·牛顿.自然哲学之数学原理[M]. 王克迪译. 陕西: 陕西人民出版社, 2001. 334—335.
[13] Proust, J.. Recherches sur le Cuivre[J]. Annales de Chimie, 1799, 32: 26—54.
[14]Berthollet, C., Lagrange, B. (extracted). Recherches sur les lois de LAffinité[J]. Annales de Chimie, 1801, 36: 302—317.
[15] Dalton, J.. Experimental Enquiry into the Proportion of the Several Gases or Elastic Fluids, Constituting the Atmosphere[J]. Memoirs of the Literary and Philosophical Society of Manchester, 1805, 2(1): 244—258.
[16] Partington, J.. The Origins of the Atomic Theory[J]. Annals of Science, 1939, (4): 279.
[17] Usselman, M., Leaist, D., Watson, K.. Daltons Disputed Nitric Oxide Experiments and the Origins of his Atomic Theory[J]. Chem. Phys. Chem., 2008, 9(1): 109.
[18] Fujii, K.. The Berthollet-Proust Controversy and Dalton's Chemical Atomic Theory 1800-1820[J]. The British Journal for the History of Science, 1986, 19(2): 177—200.
[19] Kapoor, S.. Berthollet, Proust, and Proportions[J]. Chymia, 1965, 10: 53—110.
[20] Henry J.. Thomas Harriot and Atomism A Reappraisal[J]. History of Science, 1982, 20(4): 267—296.
[21] Kargon R.. Thomas Hariot, the Northumberland Circle and Early Atomism in England[J]. Journal of the History of Ideas, 1966, 27(1): 128—136.
[22] Kargon R.. Walter Charleton, Robert Boyle, and the Acceptance of Epicurean Atomism in England[J]. Isis, 1964, 55(2): 184—192.
[23] Grossman M.. John Dalton and the London Atomists: William and Bryan Higgins, William Austin, and New Daltonian Doubts about the Origin of the Atomic Theory[J]. Notes and Records: the Royal Society Journal of the History of Science, 2014, 68(4): 339—356.
[24] Grossman M.. John Dalton and the Origin of the Atomic Theory: Reassessing the Influence of Bryan Higgins[J]. The British Journal for the History of Science, 2017, 50(4): 657—676.
[25]道爾顿.化学哲学新体系[M]. 李家玉, 盛根玉译. 北京: 北京大学出版社, 2006.
[26] Henry, W.. Memoirs of the Life and Scientific Researches of John Dalton[M]. Printed for the Cavendish Society, 1854. 64.
[27] Rocke, A.. Atoms and Equivalents: The Early Development of the Chemical Atomic Theory[J]. Historical Studies in the Physical Sciences, 1978, 9: 225—263.
Abstract: The historians of chemistry used to value the first table of relative atomic mass, which appeared in September 1803, as the establishment of Dalton s atomism, but Dalton himself, in one of his lectures in 1810, claimed that atomism had been born in 1805. In this paper, it is believed that the different understandings of Dalton s atomic theory result in the division between Dalton and historians. Dalton believed that the physical proof is the key to support his atomism, so he claimed that it had been certified in 1805. However, throughout the long history of atomism, Dalton could not prove atomism from a physical point of view. Therefore, September 1803 is actually the time point for the establishment of Dalton s atomism.
Keywords: Dalton, the Berthollet-Proust Controversy, law of definite proportions, chemical atomic theory, physical atomic theory
