神经母细胞瘤中Hsp27的表达及其与化疗药物关系的研究*
2019-04-18
热休克蛋白(heat shock protein,HSPs)[1]根据分子量分为不同家族,在蛋白质折叠、细胞信号传导和细胞凋亡过程中起到分子伴侣的作用。热休克蛋白27(heat shock protein 27,Hsp27)[2-3]是其中一员,参与细胞增殖、分化、凋亡、神经系统发育等生理过程;受到高温、缺氧、药物等刺激时,表达诱导型Hsp27,通过调节细胞死亡的信号通路发挥细胞保护作用。有报道Hsp27参与肿瘤发生、转移、耐药等过程[2],其高表达与胸腺上皮肿瘤[4]、星形胶质瘤[5]、食管腺癌[6]、肝癌[7]、涎腺腺样囊性癌[8]、喉鳞状细胞癌[9]、膀胱癌[10]及多发性骨髓瘤[11]预后不良相关,但与食管癌[12]、子宫内膜癌[13]和肺癌[14]的良好预后相关。
神经母细胞瘤(neuroblastoma,NB)是起源于胚胎性交感神经系统神经嵴的交感神经胚胎性肿瘤,是儿童最常见的颅外实体肿瘤[15]。NB极易发生转移、复发及耐药,占儿童癌症死亡率的15%[16]。根据国际神经母细胞瘤病理学分类(INPC)[17-18],分为NB、节细胞神经母细胞瘤(ganglioneuroblastoma,GNB)和节细胞神经瘤(ganglioneuroma,GN),其中GN为良性肿瘤,NB/GNB为恶性肿瘤。尽管使用手术、化疗、放疗、自体骨髓移植、生物制剂等多模式治疗方案使NB患儿治疗效果有所改善,但高危患儿的长期生存率仍较低。化疗药物耐药是高危患儿治疗失败的关键原因之一,并且患者可能出现显著的早期或晚期毒性,进一步限制了常规化疗剂量增强。近年研究表明,个体遗传基因表达的差异及基因多态性是造成药物反应个体差异的主要原因[19],通过检测药物相关性分子靶标,能够预测肿瘤化疗药物敏感性及毒副反应。
因此,本研究首先检测Hsp27在NB中的表达,分析其与临床病理参数的关系;构建耐药细胞株,检测Hsp27 表达差异;检测常规化疗药物相关性分子靶标,以预测化疗药物的敏感性及毒副反应;进一步分析Hsp27 的表达与药物敏感性的关系,为评估NB/GNB的预后提供新指标,同时为NB/GNB寻找新的潜在的治疗靶点。
1 材料与方法
1.1 材料
1.1.1 病例资料 收集2012年4月至2019年5月在重庆医科大学附属儿童医院确诊神经母细胞瘤新鲜切除的手术或手术活检标本。其中男性79 例,女性55 例,中位年龄3 岁(16 天至11 岁)。NB 分期、危险度分组等参照2015 版《儿童神经母细胞瘤诊疗专家共识》[20]。本研究通过重庆医科大学伦理委员会审查[(2017)年伦审(研)第(40)号],已获得被研究对象或其家属知情同意。
1.1.2 主要试剂及仪器 DMEM/F12培养基(购自美国Gibco公司)、胎牛血清(购自美国Gibco公司)、顺铂(购自大连美仑生物公司MB1055)、胰蛋白酶(购自美国Gibco公司)、CCK-8(购自日本同仁公司)、RNA提取试剂盒(购自中国Bio Teke 公司)、逆转录试剂盒(购自日本TaKaRa公司)、TB Green Ⅱ荧光染料(购自日本TaKaRa公司)、Hsp27引物(购自上海生工生物公司)、β-acting引物(购自上海生工生物公司)、兔Hsp27单克隆抗体(购自美国Abcam公司,ab2154)、免疫组织化学超敏二步法试剂盒(购自北京中杉金桥公司)、DAB显色试剂盒(购自北京中杉金桥公司)、CFX96 Cycler荧光定量PCR仪(购自美国BIO-RAD公司)、显微镜(Nikon E800,分析软件NIS-ELEMENtS br.3.0)。
1.2 方法
1.2.1 细胞培养 人NB 细胞系SH-SY5Y 培养于含10%胎牛血清、1%双抗的DEME 培养基中,培养箱条件为37℃、5%CO2。采用低浓度长时间诱导法干预SH-SY5Y:用完全培养基根据化疗药物的峰值血浆浓度(peak plasma concentration,PPC)(顺铂CDDP:3 µg/mL[21])配制培养基;从初始浓度0.1×PPC 开始,以1.25~1.5 倍的梯度逐步提高化疗药物浓度,直至1×PPC浓度;每个浓度孵育24 h后,弃培养液,换用不含化疗药物的完全培养基,待其恢复生长后,重复1次;反复换液、传代,最终将细胞维持培养于含1×PPC浓度化疗药物的培养基中,常规冻存。
1.2.2 CCK-8法检测耐药性 取对数生长期的细胞消化后用完全培养基重悬为4×104/mL的细胞悬液,接种于96孔板,100µL/孔,培养24 h后,配制含CDDP的完全培养基,按照药物的PPC稀释成不同浓度梯度(0.01、0.10、1.00、10.00、100.00 PPC),用含药培养液置换孔中的培养液,设空白组、对照组,每个浓度重复3孔,培养48 h,弃孔中培养液,加入含10%CCK-8溶液的培养液100µL,37℃孵育1~2 h,酶标仪检测波长450 nm处的OD值。细胞抑制率(%)=(OD空白孔-OD待测孔)/(OD空白孔-OD调零孔)×100%,计算半数抑制浓度(median inhibition concentration,IC50),耐药指数(resistance index,RI)=IC50(耐药细胞)/IC50(亲本细胞)。
1.2.3 RT-qPCR法检测Hsp27基因mRNA的表达 采用离心柱法提取NB组织、亲代及耐药细胞总RNA,紫外分光光度计检测RNA浓度和纯度,参照TaKaRa逆转录试剂盒说明书将RNA逆转为cDNA,逆转录体系为20 µL,采用TB GreenⅡ荧光染料qPCR 法分别扩增Hsp27cDNA(Forward 5'-CAAGGATGGCGTGGTGGAG ATC-3',Reverse5'-CTCGTTGGACTGCGTGGCTAG-3'),以人β-actin为内参基因(Forward 5'-CCTGGCACCCAG CACAAT-3',Reverse 5'-GGGCCGGACTCGTCATAC-3'),在CFX96 Cycler荧光定量PCR仪上运行。每份标本设定3个复孔,实验重复3次;采用2-ΔΔCt法计算Hsp27基因表达水平。
1.2.4 免疫组织化学法检测NB组织中Hsp27蛋白的表达 石蜡包埋,连续组织切片,厚度为4.5µm,60℃烘烤后进行免疫组织化学实验。经脱蜡、柠檬酸钠抗原修复,3%H2O2室温孵育阻酶,0.5%BSA 封闭,滴加兔Hsp27 抗体4℃过夜,经免疫组织化学试剂盒反应增强液和二抗依次作用后,DBA 显色,苏木素复染,中性树胶封片后在光学显微镜下读片。
结果判断:Hsp27 免疫组织化学染色结果以胞核、胞质棕黄色颗粒沉着为阳性表达。染色范围:整张切片内阳性细胞占所有细胞比例,阳性细胞<25%为0分,25%~50%为1分,51%~75%为2分,>75%为3 分。染色强度:不显色0 分,淡黄色1 分,棕黄色2分,棕褐色3分。染色范围结合染色强度(染色范围×染色强度=免疫组织化学结果)来判断Hsp27 表达程度:0分(-),1、2分(+),3、4分(++),9、6分(+++)。
1.2.5 肿瘤标本化疗药物相关性分子靶标检测 18例NB/GNB 的石蜡包埋组织标本送至上海复旦临床病理诊断中心,分别采用IHC、PCR 扩增测序法检测常规药物相关性分子靶标的表达或突变。
1.3 统计学分析
采用SPSS 23.0对实验所得数据进行统计学分析。计量资料结果用表示,组间比较采用独立样本t检验;计数资料组间比较采用χ2检验或Fisher精确检验;Kaplan-Meier生存曲线分析生存及预后资料。以P<0.05为差异具有统计学意义。
2 结果
2.1 耐药株构建情况
通过低浓度长时间诱导法,历时5个月成功构建耐顺铂细胞,命名SH-SY5Y/CDDP,耐药指数>10倍(表1)。

表1 细胞对化疗药物敏感性比较
2.2 免疫组织化学法检测NB组织中Hsp27蛋白表达
Hsp27在NB组织中阳性率为72.22%(65/90),在GNB组织中阳性率为37.5%(9/24),在GN组织中阳性率为0(0/20),差异具有统计学意义(χ2=45.442,P<0.001,表2,图1)。
在NB/GNB 组织中Hsp27 蛋白阳性表达与肿瘤分期、危险度、转移呈正相关(P<0.05),与患儿的年龄、性别、Shimada 组织学分型、N-myc 有无扩增差异无统计学意义(P>0.05,表2)。化疗后的肿瘤组织Hsp27表达较化疗前增高6例,降低5例,无明显统计学差异(P>0.05,表3)。
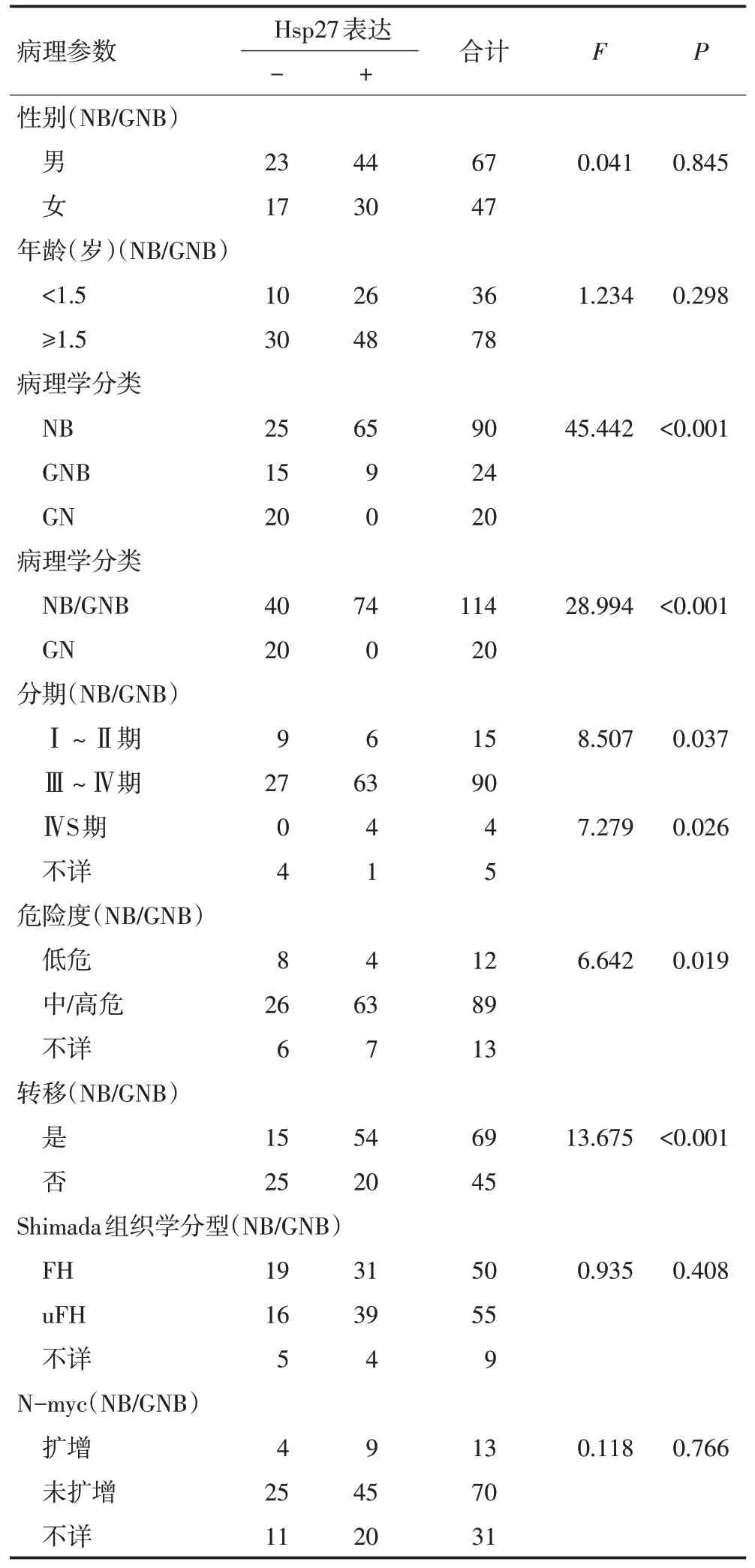
表2 Hsp27蛋白与患者临床病理参数的关系 例
2.3 NB组织和细胞中Hsp27 mRNA的表达
RT-qPCR 检测结果显示,Hsp27 mRNA 在59 例NB/GNB 中表达量为3.763±1.854,在5 例GN 中表达量为2.476±0.698(P>0.05,图2)。
Hsp27 mRNA 表达量在SH-SY5Y/CDDP 中 较SH-SY5Y 显著增高(3.902±0.331vs.1.015±0.061,F=16.246,P<0.01,图3)。
2.4 Hsp27 蛋白在NB 组织中的表达水平与患者预后的关系
将NB组织中的Hsp27蛋白表达水平作为因变量绘制Kaplan-Meier 生存曲线(图4),结果显示Hsp27阴性表达患者的生存率(84.4±10.4)%明显高于阳性表达患者(70.0±7.9)%,χ2=4.22,P<0.05。
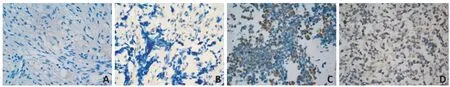
图1 Hsp27在各组织中的表达(DBA染色×400)

表3 20例化疗前后NB/GNB组织中Hsp27蛋白表达情况
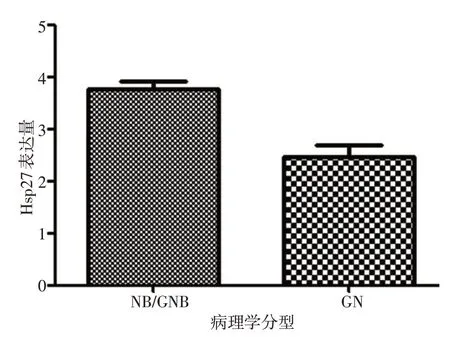
图2 Hsp27 mRNA在NB组织中的表达

图3 Hsp27 mRNA在NB细胞中的表达
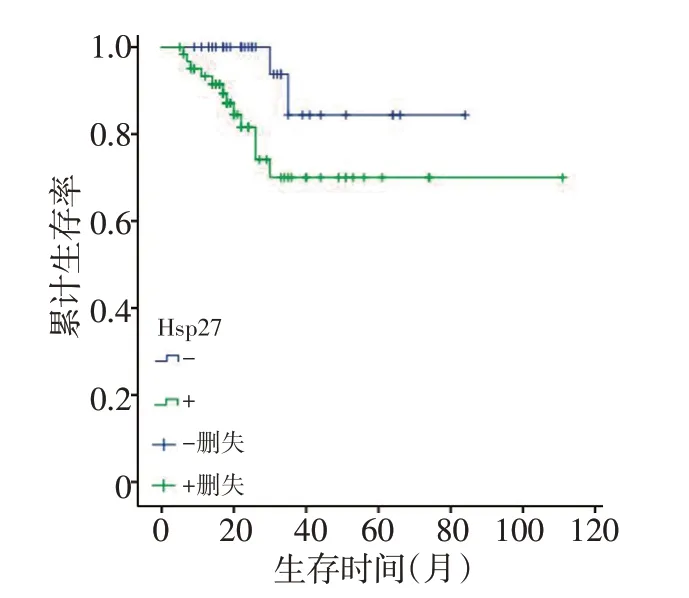
图4 NB/GNB总体生存曲线
2.5 标本化疗药物相关性分子靶标检测结果
本研究共检测18例NB/GNB肿瘤标本的常规7个化疗药物敏感性分子靶标:ERCC1、TOPOⅠ、TOPOⅡA、MGMT、CYP2C19*2、CYP2B6*6、UGT1A1*28(表4)。分析Hsp27蛋白表达与化疗药物敏感性及毒性关系发现(表5),Hsp27蛋白在铂类化疗药物敏感性较低组的阳性表达率61.5%(8/13)明显高于敏感性较高组0(0/5),差异有统计学意义(F=5.538,P<0.05),而Hsp27在环磷酰胺、伊立替康/拓扑替康、蒽环类/依托泊苷、替莫唑胺/卡莫司汀/司莫司汀敏感性较高组与较低组及环磷酰胺、伊立替康/拓扑替康毒副反应较强组与较弱组的表达差异均无统计学意义(P>0.05)。

表4 化疗药物相关性分子靶标检测结果
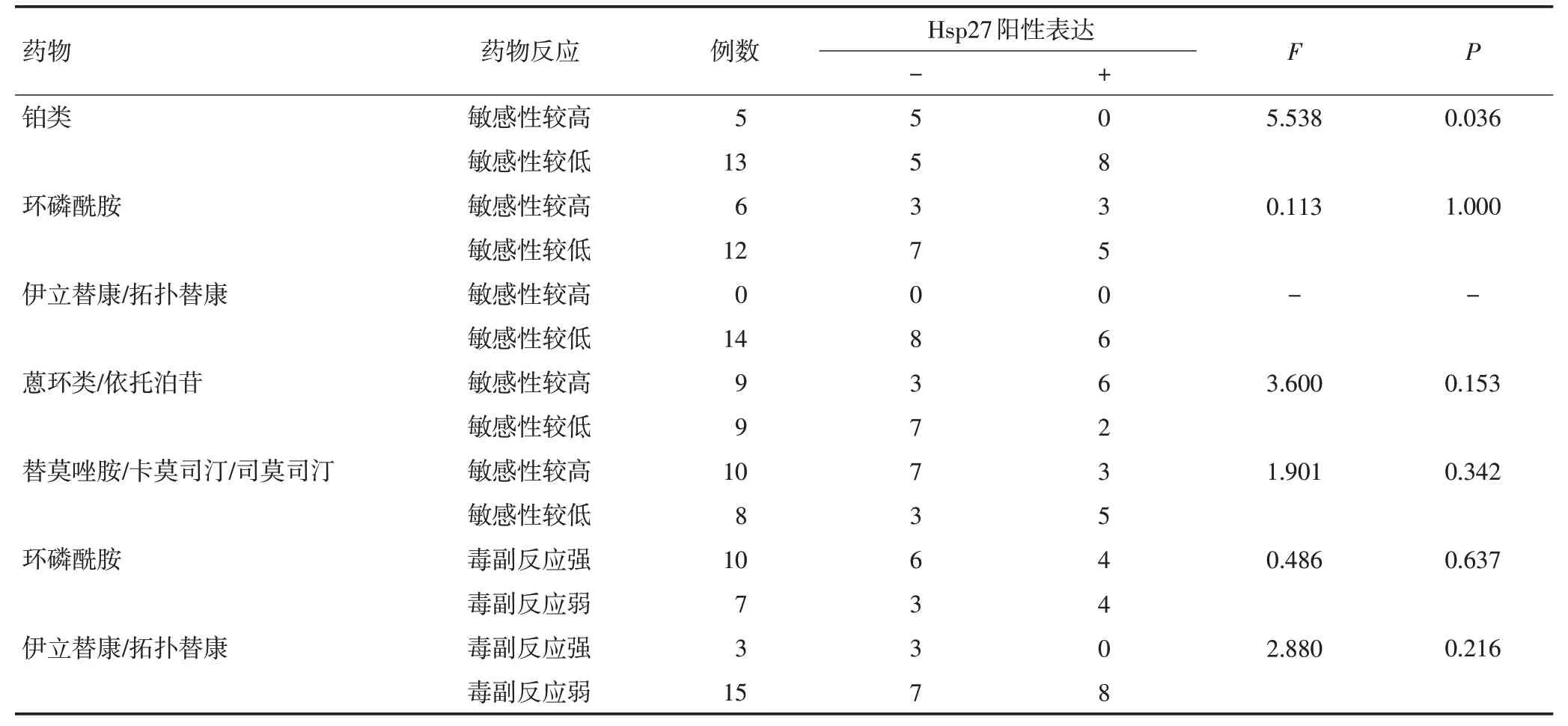
表5 Hsp27表达与化疗药物敏感性的关系
3 讨论
本研究主要通过探讨NB中Hsp27蛋白及基因水平的表达差异,分析找到NB 新的预后/诊断标志物。结果显示,Hsp27在NB/GNB肿瘤组织中高表达,并与肿瘤分期、危险度、转移、预后相关,可能参与NB/GNB 的发生发展转移,为国内首次报道Hsp27 与NB的关系。
Hsp27与肿瘤关系密切,诸多文献已证明其与肿瘤细胞的侵袭和转移有关,可以促进肿瘤发生发展、参与治疗耐受性及抑制细胞凋亡。但是这一结论在相同或不同肿瘤组织中报道不同。Nakajima 等[22]通过对62例食管鳞状细胞癌样本研究发现,Hsp27高表达与肿瘤的浸润深度和病理分期呈负相关,与淋巴结浸润呈正相关。但Kawanishi 等[23]研究认为Hsp27的表达与食管鳞状细胞癌浸润深度和分期无关,与淋巴结转移呈负相关。Zhang等[24]发现Hsp27在食管鳞状细胞癌中高表达。Eto等[25]通过194例肝细胞癌样本发现HSP27表达与临床病理特征及预后无相关性,但对142例丙型肝炎病毒(hepatitis C virus,HCV)阳性组的分析发现,磷酸化HSP27 阳性的肿瘤直径较大,门静脉侵犯率较高。Liang等[7]研究发现Hsp27高表达与肝细胞癌的发病率、甲胎蛋白水平、病理分级呈正相关,与预后呈负相关。
国际上目前有两项研究检测了少量病例中NB的Hsp27 表达,但国内鲜见相关报道。Ungar 等[26]通过对53例NB标本研究发现Hsp27表达与临床分期、N-myc 扩增呈负相关。Zanini 等[27]通过对26 例NB/GNB标本研究发现Hsp27表达与预后良好呈正相关,与侵袭性呈负相关。与本研究关于该蛋白质与NB的关系结论不一致,本研究认为造成这种差异的原因主要为:1)用于评估Hsp27 的方法有关,评估伴侣蛋白表达在肿瘤相关疾病预后作用的一个重要问题是肿瘤细胞中磷酸化伴侣蛋白的细胞内定位信息欠明确;2)NB具有显著异质性及组织学多样性,在同一NB 样本中,通常包含不同程度成熟的区域,癌症的不同区域呈非均匀蛋白质表达;3)另外两项研究[26-27]均未探索Hsp27 在GN 中的表达情况,且样本量较小,临床病理参数队列信息不完善;4)前两项研究[26-27]患者来源分别为美国及意大利,均为欧美人种,本研究病例标本来自中国,患者均为亚洲人种;5)可能与Hsp27抗体有关,Hsp27活性取决于其寡聚化、磷酸化状态。具体差异原因仍需进一步基础实验证明。
有研究[2]报道受化疗药物刺激,Hsp27 表达应激后增加。本研究比较了20 例化疗前后NB/GNB 组织中Hsp27 的表达情况,随着化疗进程,Hsp27 表达增高6 例(6/20),降低5 例(5/20),差异无统计学意义,可能与检测样本量较小相关,后期将扩大样本量,验证该观点。
有研究[28-29]表明Hsp27 参与肿瘤对化疗的耐受性,如Hsp27 在耐5-氟尿嘧啶(5-fluorouracil,5-FU)的结肠癌细胞[30]、耐长春新碱的胃癌[31]、耐吉西他滨的胰腺癌中高表达[32];抑制Hsp27可逆转非小细胞肺癌对化疗药物的耐药性[33],降低肺腺癌对吉西他滨敏感性[34],因此用适当的抑制剂靶向Hsp27可能是理想的肿瘤治疗靶点[35]。
本课题组前期研究[36-37]发现,通过检测药物相关性分子靶标,可以预测肿瘤的化疗药物敏感性及毒副反应,根据检测结果实施个体化化疗方案能够有效缩减瘤体,减少术前化疗疗程,减轻化疗毒副反应。本研究通过RT-qPCR 检测发现Hsp27 mRNA表达在耐顺铂的细胞中比亲代细胞高,说明NB获得性耐药与Hsp27 有关。为进一步在体内验证Hsp27 表达与耐药的关系,本研究初步检测18 例NB/GNB 常用化疗药物相关性分子靶标,预测其对药物的敏感性及毒副反应,发现此18 例NB/GNB 对铂类、伊立替康/拓扑替康、蒽环类/依托泊苷、环磷酰胺、替莫唑胺/卡莫司汀/司莫司汀的敏感性不高。进一步发现Hsp27表达增高与铂类药物耐药相关,与细胞实验一致,这为研究化疗药物耐药靶点提供了新的思路,但仍需在动物实验中进一步验证。
综上所述,本研究通过初步探讨神经母细胞瘤组织及细胞中Hsp27 的表达,发现Hsp27 在NB/GNB高表达,并与肿瘤分期、危险度、转移、预后、铂类药物耐药相关,可能参与了NB/GNB的发生发展转移耐药。因此,本研究可能为NB的靶向治疗寻求到新的标志物,但仍需扩大样本量及进一步基础研究证明。
