新藤黄酸诱导脑胶质瘤细胞U87自噬的研究
2019-04-16王巧雪李庆林
王巧雪,程 卉,李庆林
(安徽中医药大学科研实验中心 新安医学教育部重点实验室,安徽 合肥 230038)
自噬是一种程序性死亡方式,是进化过程中高度保守和至关重要的自我保护系统[1]。自噬发生过程中,自噬体与溶酶体融合形成自噬溶酶体,代谢降解受损的细胞器,为细胞提供新的营养物质和能量[2-3]。自噬作为抗肿瘤药物治疗的潜在作用靶点近年来已得到确认,在肿瘤不同时期发挥着促生存或促死亡的不同作用。
胶质瘤被认为是人类最常见的恶性原发性脑肿瘤,年发病例数约为10万人,占所有原发性脑肿瘤的54%[4]。在过去的50年里,肿瘤的治疗取得重大进展,但在胶质瘤治疗方面改进甚少。胶质瘤患者的中位生存时间仅有12~14个月,5年生存率低于5%[5]。快速的增殖和无法控制的侵袭一直是清除胶质瘤的障碍,虽然有效治疗方案在被不断探索,但大多数治疗方案的疗效是有限的。因此寻找安全有效的化学治疗药物是目前胶质瘤研究的热点问题之一。
中药藤黄分布于泰国、柬埔寨、印度和中国南部地区,传统用于消肿、化瘀、止血等[6]。新藤黄酸(gambogenic acid,GNA)是从藤黄中提取的主要活性化合物之一,近年来GNA的抗肿瘤作用已被人们认可。研究结果表明GNA具有广谱和显著的抗肿瘤活性,其机制与其促进肿瘤细胞发生不同的细胞死亡方式而抑制肿瘤细胞的增殖有关。因此,本实验在前期研究的基础上进一步探究GNA抑制肿瘤细胞增殖的作用是否与诱导胶质瘤U87细胞自噬有关。
1 材料
1.1 细胞和试药 U87细胞:中国科学院上海细胞库;GNA(纯度99.0%,批号 20170503):安徽中医药大学药学院自制;DMEM培养基和胎牛血清、链霉素、青霉素:美国Gibico公司;噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]、单丹磺酰尸胺(monodansylcadaverine,MDC)和吖啶橙(acridine orange,AO):美国Sigma公司;微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)、酵母自噬基因6同系物(Beclin-1)一抗:美国CST公司;辣根酶过氧化物标记的二抗:北京中杉金桥公司。
1.2 主要仪器 MCO175型CO2培养箱:日本SANYO公司;SW-CJ1F型洁净工作台:苏净集团安泰公司;CK2型倒置显微镜、荧光显微镜:日本Olympus公司;SpectraMax M2e型多功能酶标仪:美国MD公司;电泳转印系统、Gel DOC XR凝胶成像分析系统:美国Bio-Rad公司;FC500流式细胞仪:美国Beckman公司。
2 方法
2.1 U87细胞培养 将U87细胞接种于培养瓶中,培养基为DMEM(含10%胎牛血清、100 μg/mL青霉素和链霉素)中,置于37 ℃、5% CO2的细胞培养箱,相对饱和湿度条件下培养,每隔2~3 d传代1次,传代比例为1∶3,取对数生长期细胞进行下述实验。
2.2 MTT法检测细胞活性 取对数生长期的U87细胞,经胰酶消化收集细胞,调整成浓度为4×104/mL的细胞悬液,每孔100 μL,接种于96孔板,每组设6个复孔,并且设空白组和对照组。过夜确定细胞贴壁状态良好后,实验组按梯度加入不同浓度的GNA药液(0、1、2、4、8、16、32 μmol/L),分别孵育24、48 h,每孔加入20 μL MTT(5 g/L),孵育箱避光孵育4 h后,小心吸出上清液,每孔加入150 μL DMSO,避光震荡。用多功能酶标仪检测波长490 nm的每孔光密度(optical density,OD)值。采用公式计算GNA对细胞的抑制率。细胞活力=(A样品-A空白)/(A对照-A空白)×100%,A样品为实验组OD值;A空白为空白组OD值;A对照为对照组OD值。
2.3 细胞形态观察 经胰酶消化后,U87细胞以4×104/mL的密度接种于培养瓶中,每瓶4 mL,待贴壁生长至80%~90%的密度,对照组换成完全培养基,实验组换用含有4 μmol/L GNA的培养基,在37 ℃、5% CO2培养箱中培养24 h,于倒置显微镜下观察细胞形态。
2.4 MDC荧光染色检测细胞自噬泡的形成 取对数生长期的U87细胞消化,细胞以每孔2×105接种到6孔板中,吸弃各孔旧培养基,按照实验分组,正常组加入完全培养基,实验组加入不同GNA(1、2、4 μmol/L)处理,培养24 h,弃去旧培养基,用PBS清洗3遍,每孔加入50 μmol/L的MDC染料500 μL,37 ℃培养箱中避光孵育30 min,PBS清洗3次,4%多聚甲醛固定,再用PBS清净,倒置荧光显微镜下观察细胞内MDC标记的绿色荧光聚集点的强度。
2.5 AO染色流式细胞术观察酸性囊泡细胞器(acidic vesicle organelles,AVO)的数量变化 取对数生长期的细胞接种于6孔板中,每孔约5×106个细胞,分别加入不同浓度的GNA(1、2、4 μmol/L)处理24 h,胰酶消化,离心,收集细胞。用PBS清洗3遍,用1 μg/mL的AO染料,避光染色30 min,PBS清净后重悬,置于流式细胞仪检测AVO数量。
2.6 Western blot法检测U87细胞中自噬相关蛋白LC3和Beclin-1的表达 将U87细胞以每孔5×106个细胞接种于6 cm培养皿中,待密度长到70%~80%,不同浓度GNA(1、2、4 μmol/L)处理24 h,收集在RIPA裂解缓冲液,提取总蛋白,BCA测定法定量每种样品的浓度。通过SDS-PAGE凝胶分离总蛋白质,湿转到硝酸纤维素膜上,室温下牛奶封闭3 h,振荡器上一抗4 ℃震荡过夜,用TBST洗涤后,加入HRP标记的二抗,孵育2 h,置于Protein Simple Alpha凝胶成像系统记录图片并分析蛋白表达变化。
3 结果
3.1 GNA对胶质瘤U87细胞增殖的抑制作用 不同浓度GNA处理细胞24、48 h后,U87细胞的存活率随剂量和时间呈现依赖性下降。GNA作用胶质瘤U87细胞24 h的IC50为2.63 μmol/L,GNA作用胶质瘤U87细胞48 h的IC50为1.62 μmol/L。见图1。

图1 GNA对胶质瘤U87细胞活力的影响
3.2 不同浓度GNA处理胶质瘤U87细胞24 h后的细胞形态 对照组细胞贴壁牢固,细胞呈现长梭形或不规则形,触角明显,胞体透明,折光性好。GNA组细胞间隙增宽,无特定形态,细胞触角收缩,皱缩变圆,贴壁不牢,胞内颗粒增多,折光度下降。见图2。

注:A. 0 μmol/L GNA组;B. 2.0 μmol/L GNA组
图2倒置显微镜下观察GNA对胶质瘤U87细胞形态的影响(10×10倍)
3.3 不同浓度GNA对胶质瘤U87细胞自噬泡形成的影响 实验组U87细胞质出现大量MDC标记的荧光颗粒聚集,且荧光强度呈剂量依赖方式增加;而对照组处理中只观察到少量自噬囊泡,表明GNA增加自噬过程中自噬泡的积累。见图3。
3.4 GNA对胶质瘤U87细胞AVO数量的影响 通过用流式细胞仪分析,在GNA处理的胶质瘤U87细胞中检测到大量的AVO,并以剂量依赖性方式增加红染AVO的比例,这表明GNA可能诱导细胞发生自噬。见图4。
3.5 不同浓度GNA对胶质瘤U87细胞内自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ和Becline-1表达的影响 GNA(1、2、4 μmol/L)作用胶质瘤U87细胞24 h后,LC3-Ⅱ/LC3-Ⅰ比值呈剂量依赖性升高,细胞内Beclin-1蛋白表达量呈剂量依赖性增加。结果提示GNA对胶质瘤U87细胞的增殖抑制作用可能与细胞自噬途径相关。见图5。

注:A. 0 μmol/L GNA组;B.1.0 μmol/L GNA组;C. 2.0 μmol/L GNA组;D. 4.0 μmol/L GNA组
图3不同浓度GNA对U87细胞自噬泡形成的影响(MDC荧光染色,10×20倍)

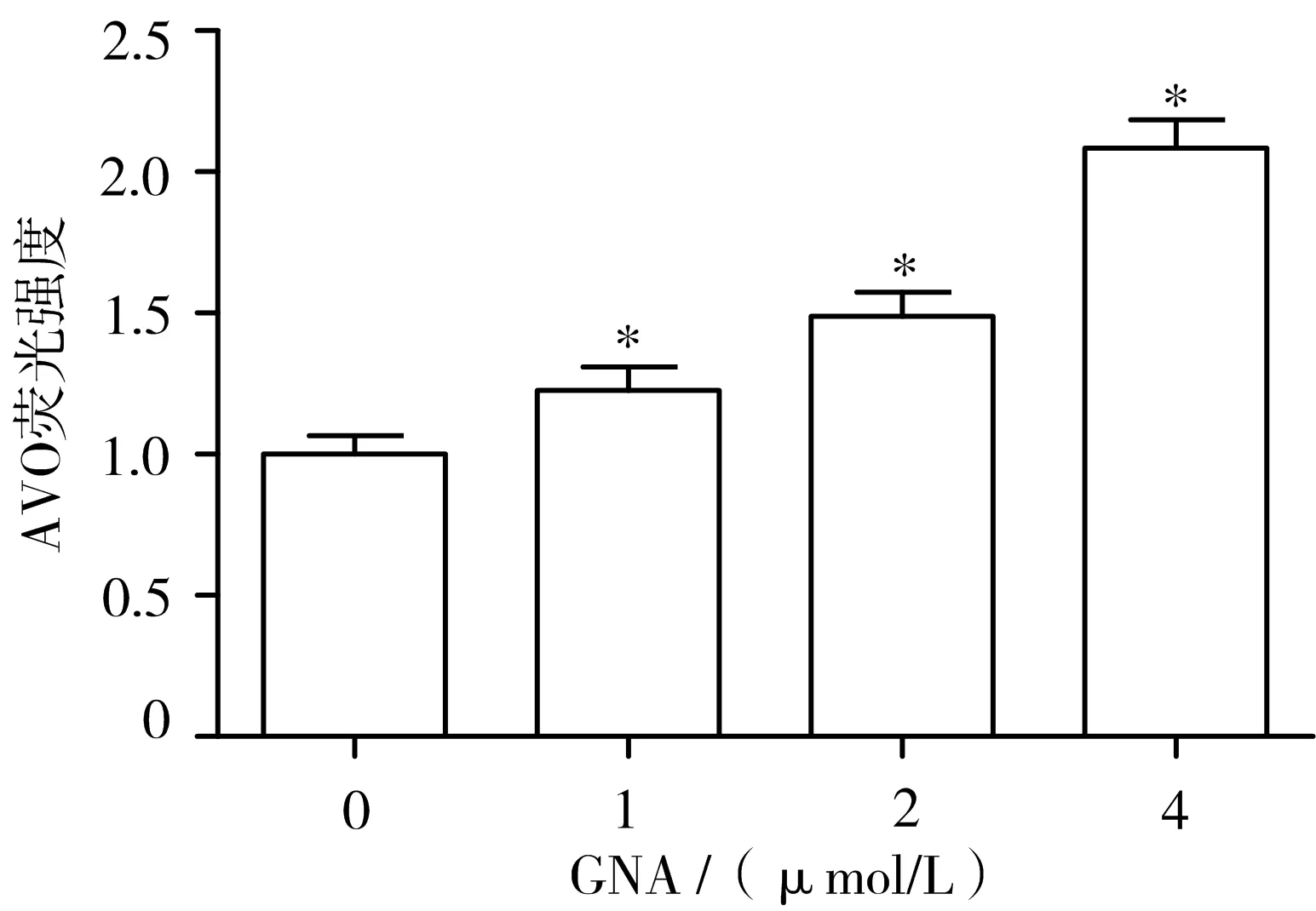
注:与GNA 0 μmol/L组比较,*P<0.05
4 讨论
中药藤黄的抗肿瘤成分主要是藤黄酸和GNA,与藤黄酸相比,GNA具有抗癌谱广、作用强、毒性低、稳定性好等特点,有望成为新结构类型的抗肿瘤药物[7]。近年来本课题组着力于GNA抗肿瘤作用的研究,现有研究结果表明GNA能够抑制多种肿瘤细胞的增殖,如肝癌细胞、黑色素瘤B16细胞、非小细胞肺癌A549细胞、胶质母细胞瘤细胞、宫颈癌U251细胞等,体内外的实验结果均表明GNA有显著的抗肿瘤活性,其抗肿瘤作用可能与肿瘤细胞凋亡、自噬有关[8-11]。



注:A. 0 μmol/L GNA组;B.1.0 μmol/L GNA组;C. 2.0 μmol/L GNA组;D. 4.0 μmol/L GNA组;与0 μmol/L GNA组比较,*P<0.05

自噬是细胞通过典型双层膜结构包裹细胞器、难降解物质和部分胞浆,形成自噬体,再运送至溶酶体与之融合,代谢降解受损的细胞器,为细胞提供新营养物质和能量的过程,是一种普遍存在于真核细胞中的现象[12]。MDC是一种趋向溶酶体的嗜酸性活细胞染料,可以特异性地标记成熟的自噬泡[13]。形成AVO是自噬的特征之一,AVO可以在细胞自噬过程中与AO结合,可以将细胞核和细胞质染色成明亮的绿色,使AVO呈鲜红色[14]。酸性小泡的形成和促进自噬小体的运输过程中,LC3蛋白的参与起重要作用[15]。在自噬发生时,LC蛋白由LC3-Ⅰ形式转化为LC3-Ⅱ形式,LC3-Ⅱ在组装溶酶体、自噬体及最后诱导激活自噬中起重要作用,因此在自噬分子水平的研究中,LC蛋白的转化具有重要意义[16]。Beclin-1被明确是调控自噬的正因子,细胞发生恶性转化大多存在Beclin-1杂合性缺失,在自噬过程中,Beclin-1不仅有利于吞噬泡的形成从而促进自噬体的形成,另外还有助于自噬体的成熟[17]。
本研究从细胞自噬的角度研究GNA对类胶质瘤细胞胶质瘤U87细胞增殖的抑制作用,结果提示在一定的范围内GNA对胶质瘤U87细胞呈现剂量与时间依赖性。经MDC荧光染色和AO染色的流式细胞术发现,GNA处理24 h后的细胞内,自噬泡和酸性囊泡细胞器增加;经Western-blot检测,GNA处理的胶质瘤U87细胞内自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ比值呈剂量依赖性升高,Beclin-1蛋白表达量均呈剂量依赖性增加,提示胶质瘤U87细胞的增殖抑制可能与细胞自噬途径相关。
本研究表明,GNA引起胶质瘤U87细胞自噬过程的发生,而诱导细胞自噬也正是GNA发挥肿瘤抑制作用的机制之一,有关GNA诱导自噬的相关途径尚待进一步研究。
