清脑益元汤调控HIF-1α、VEGF和PDGF表达在大鼠脑缺血损伤中的保护机制研究
2019-04-15韩艳茹贾奎赵福成
韩艳茹,贾奎,赵福成
(新乡医学院第一附属医院,中西医结合科,河南 新乡 453003)
缺血性卒中是因多种病因造成脑动脉闭塞导致脑组织缺血缺氧,进而导致脑组织出现兴奋性毒性、线粒体功能失调、氧化应激、炎症、离子失衡及酸中毒,最终导致脑组织不可逆性损伤,神经细胞坏死,出现神经功能及认知功能缺失[1,2]。缺血所引起的脑组织损伤是致死性疾病的主要原因,是全世界第三大致死疾病之一,具有高发病率,高致残率,高死亡率及高复发率的特点[3,4]。其中,缺血再灌注损伤发生在急性脑梗死恢复血液供应后,重新获得血液供应的脑组织内的神经细胞死亡增多,脑组织损伤加重。近些年来,许多中药被发现在缺血再灌注早期可缓解脑组织损伤情况,并可减少海马细胞的死亡[5,6]。因此,本研究旨在探究清脑益元汤大鼠脑梗死缺血再灌注中的主要作用机制,及对脑内HIF-1α、VEGF、PDGF调节情况。
1 材料与方法
1.1 大鼠MACO模型制备[7]45只成年雄性Wistar大鼠SPF级 (购买于北京维通利华实验动物技术有限公司)。相对湿度40%~70%,昼夜12h循环光照,温度适宜。将SD大鼠按设计方案分成组,每组3组,每组15只;随机分为对照组、模型组、清脑益元汤组。采用灌胃方法在造模后分别灌注14d等剂量的生理盐水或清脑益元汤。采用10%水合氯醛行大鼠腹腔注射麻醉(35mg/kg),仰卧位固定大鼠,切开皮肤病分离左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),在CCA远心端近心端及ECA处挂线备用。用动脉夹暂时夹闭ICA,然后近心端结扎 CCA、ECA。然后在距 CCA分叉部4mm处剪一小口,将拴线插入到ICA,这时用绕在CCA远心端的细线轻轻系牢拴线。用眼科镊轻推拴线,从血管分叉处开始算距离,当插入深度在18mm时,紧紧系牢CCA远心端的细线。栓塞1h后,打开栓塞制作再灌注模型。做完模型后,终止麻醉,将所有大鼠归放笼里。
清脑益元汤:水牛角30g、水蛭 8g、赤芍 15g、参三七 10g、川牛膝 15g、紫河车 15g、红景天 20g、干地黄10g、制首乌10g、肉苁蓉10g。煎药直至其变为膏状,药物浓度含生药2g/ml。大鼠按照3ml/100g清脑益元汤灌胃14d,对照组和模型组给予等剂量生理盐水灌胃。
1.2 大鼠Longa评分[8]动物苏醒后,参照Longa等评分标准进行神经功能缺陷评分。0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失。1~3分为模型成功,0分和4分予以剔除,并在后续实验中补足每组动物数。
1.3 采样与指标检测 大鼠用10%水合氯醛腹腔注射麻醉,留取大脑海马组织,中性福尔马林(10%)固定,常规组织脱水和浸蜡包埋,石蜡5μm/张切片连续6张,切片用于HE染色和TTC检测观察脑组织形态变化和颜色变化,计算梗死面积。
1.4 Western Blot检测蛋白表达水平 离心大鼠脑组织提取海马区蛋白,调整每一组的蛋白浓度总量为30ug/uL。各组蛋白样品在10%SDS聚丙烯酰胺凝胶中进行凝胶电泳和转膜,加入大鼠多克隆抗体 HIF-1α、VEGF、PDGF和二抗。显色使用 ECL显色剂,成像使用Bio-Pro凝胶成像分析仪,各泳道条带进行灰度扫描得出相应蛋白表达量用Quantity-one软件进行分析。
1.5 Real-Time PCR 法检测基因表达 Trizol法提取大鼠脑组织内总RNA。按照试剂盒说明书逆转录合成cDNA并进行实时荧光定量Real-time PCR分析。每个实验HIF-1α、VEGF、PDGF至少重复3次。 分析:通过计算 HIF-1α、VEGF、PDGF 得到循环阈值CT值来确定基因的表达量。
1.6 统计学处理 本实验各组数据结果采用SPSS 22.0软件处理,对数据行正态性和方差齐性检验,符合正态分布的计量资料,计量资料结果用均数±标准差表示,采用单因素方差分析和Bonferroni "s Multiple Comparison Test进行组间差异比较,P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠神经组织学评分结果 对照组大鼠脑组织呈均匀红色,未见苍白缺血区;模型组损伤脑组织可见苍白梗死灶,且缺血灶范围随再灌注时间的延长而扩大;清脑益元汤组大鼠脑组织缺血面积明显减少。与对照组相比,模型组和清脑益元汤组大鼠Longa评分明显增高,梗死面积(%)明显增加,差异具有统计学意义(P<0.05)。 与模型组相比,清脑益元汤组大鼠Longa评分明显降低,梗死面积(%)明显减少,差异具有统计学意义(P<0.05),见表 1。

表1 大鼠神经组织学评分结果
2.2 HE染色结果 对照组大鼠脑海马回神经细胞胞膜、核膜清晰,核仁明显细胞形态无异常。模型组大鼠神经细胞,多无完整的细胞结构,呈不同程度的缺血性坏死,细胞核固缩,染色质浓缩集聚,甚至形成核碎片,星形胶质细胞呈簇样增生。清脑益元汤组缺血区神经细胞肿胀程度、间隙及细胞核改变均较轻,脑缺血区仅有轻、中度缺血性改变,缺血区脑梗死现象明显减轻。见图1。
2.3 Western blot法检测蛋白表达结果 与对照组相比,模型组和清脑益元汤组大鼠脑组织中HIF-1、VEGF、PDGF的蛋白含量明显升高,差异具有统计学意义(P<0.05);与模型组相比,清脑益元汤组HIF-1蛋白含量明显降低,VEGF、PDGF蛋白含量明显升高,差异具有统计学意义(P<0.05),见图 2。

图1 HE染色结果(400×)
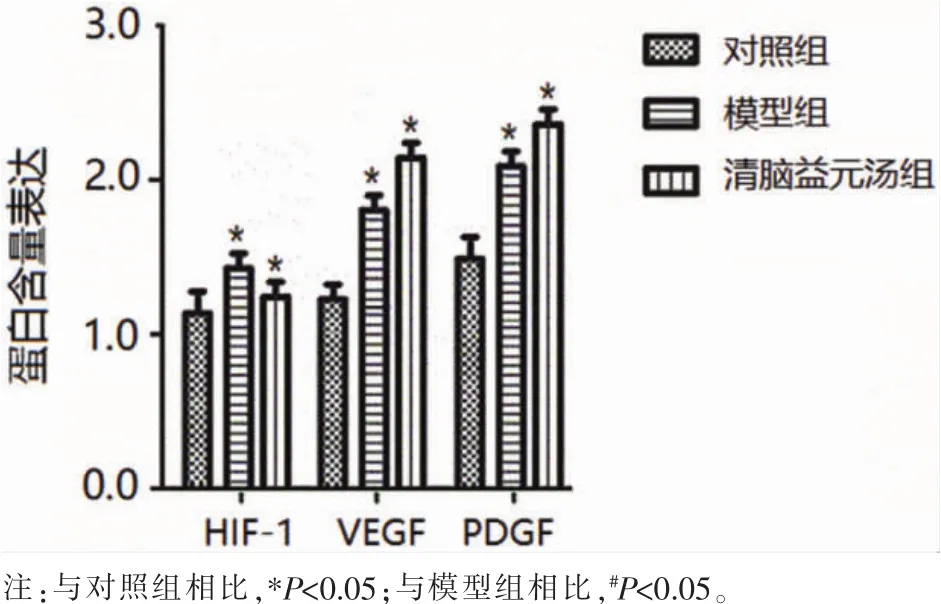
图2 大鼠脑组织中HIF-1、VEGF、PDGF的蛋白表达含量
2.4 Real-Time PCR法检测蛋白表达结果 与对照组相比,模型组和清脑益元汤组大鼠脑组织中HIF-1、VEGF、PDGF mRNA 含量明显升高,差异具有统计学意义(P<0.05);与模型组相比,清脑益元汤组 HIF-1 mRNA含量明显降低,VEGF、PDGF mRNA含量明显升高,差异具有统计学意义 (P<0.05)。 见图 3。
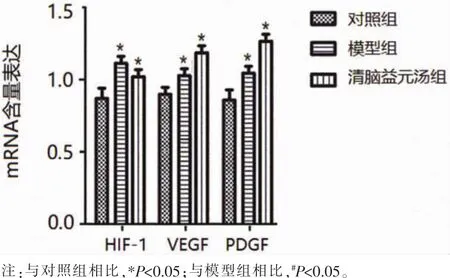
图3 大鼠脑组织中HIF-1、VEGF、PDGF mRNA表达水平
3 讨论
中医药现如今在干预和治疗脑组织疾病中具有显著疗效,不仅可以活血化瘀、解毒清脑,帮助机体恢复脑内血流量,改善脑缺血损伤的局部微环境,改善脑缺血损伤程度;还可以益肾填精、补肾生髓,用于修复和改善缺血坏死的脑神经元,降低神经功能缺损。清脑益元汤由水牛角、水蛭、赤芍、参三七、川牛膝、紫河车、红景天、干地黄、制首乌、肉苁蓉10味中药组成,水牛角清热凉血解毒;水蛭破血逐瘀、活血通络;赤芍清热凉血;参三七活血化瘀;川牛膝活血通经络;红景天活血化瘀、健脾益气;紫河车补肾益精、补气益血;地黄、制首乌及肉苁蓉填精益髓益肾固元,功效为清脑祛瘀、益肾生髓,使脑络通畅,局部血液供应改善,梗死体积缩小,神经功能缺损加速修复,拟用于脑缺血损伤大鼠急性期和恢复早期阶段的防治[9-11]。
HIF-1α是机体在低氧状态下做出适应性反应的细胞内氧稳态调节性因子。缺氧时HIF-1α在细胞核内与HIF-1β聚合成HIF-1,HIF-1与血管内皮因子结合介导VEGF的转录激活,激活相关的缺血缺氧转导通路,促进受损脑组织中新生血管生成[12,13]。 同时,HIF-1α可参与介导颅脑损伤中的神经元凋亡作用。HIF-1α是一种用于检测低氧环境的细胞转录因子,在颅脑损伤所致的缺血缺氧脑损伤发生、发展过程中HIF-1α发挥着十分重要的作用。在发生了脑缺血损伤后,相比于损伤发生之前,大脑内VEGF的表达显著的提高[14]。VEGF作为目前最强的血管通透因子,通过促进血管内皮细胞增殖、增加血管的通透性,能够被激活或者直接促进血管的生成,研究表明VEGF能够提高机体脑组织内神经干细胞的存活和促进细胞增殖[15,16]。血小板衍生因子(PDGF)在结缔组织细胞参与伤口愈合时表达明显升高,PDGF通过增强机体内炎性细胞和成纤维细胞的合成和分泌,进而促进细胞外基质蛋白和胶原蛋白的形成,可以大大降低伤口愈合的时间。国内外研究表明,PDGF及其受体能够促进毛细血管壁的形成和稳定,促进血管生成和血管重建,并可通过促进少突胶质细胞的增殖,能对细胞起保护作用,缓解脑部损伤[17,18]。
本研究结果表明,清脑益元汤可以有效缓解Longa评分,并可以有效改善大鼠的行为学变化,减轻大鼠脑组织脑缺血损伤情况,改善损伤海马区不同程度的缺血性坏死和神经元损伤。清脑益元汤能够显著降低大鼠海马区神经元内HIF-1α含量表达,并促进VEGF、PDGF mRNA和蛋白含量表达以改善大鼠脑缺血再灌注损伤,促进脑内新生血管生成,保护脑内神经元。综上所述,清脑益元汤对脑损伤大鼠的治疗作用可为脑梗死的临床治疗提供新的理论依据、可能思路和靶向药物。
