矮牵牛花药培养技术及影响因素的研究
2019-04-15张馨默刘丽萍
张馨默,刘丽萍*
(1.黑龙江大学农业微生物技术教育部工程研究中心;2.黑龙江大学生命科学学院黑龙江省普通高校分子生物学重点实验室,黑龙江 哈尔滨 150000)
花药培养是利用植物组织培养技术,将花药进行无菌操作接种到人工培养基上,通过改变小孢子的发育途径,使其诱导分化,进行连续的有丝分裂,形成细胞团,继而形成愈伤组织后胚状体,最终分化成完整的植株。印度Guha等最早针对毛曼陀罗的离体花药,诱导出单倍体植株,而后花药培养法被运用到烟草上,并受到世界的广泛关注。此后,人们陆续开展了对观赏性植物的花药培养研究。
花药培养在育种中的应用价值:一是可缩短育种年限,加速育种进程。通过对获得的单倍体植株进行染色体加倍,从而获得纯合的二倍体植株;二是对育种研究提供原材料。通过鉴定和选择满意的基因组合,对遗传变异方面的研究提供了科学的理论依据;三是提供了外源基因的转化受体,从而利于外源基因的整合与表达。
矮牵牛(Petunia hybrid Vilm),又名碧科茄、灵芝牡丹、撞羽牵牛等,为茄科矮牵牛属一年生或多年生的半蔓性草本花卉。其品种丰富、系列繁多,包括阿根廷系列、云系列、梦幻系列、魅力系列、地毯系列、梅林系列等。因其具有鲜艳丰富的色彩、较长的花期和适应能力、较好的耐热性及观赏性,被广泛地用于城市绿化和室内盆栽等。在种子的获取方面所面临的问题有:播种繁殖,采种困难;进口杂交种,价格昂贵;扦插繁殖,成活率低等。
因此,针对矮牵牛的需求量的增加以及需求品种的多样化,通过花药培养可快速获得纯合二倍体以及隐形突变体,并能缩短育种周期、提高选择效率。而目前在矮牵牛花药培养的技术研究方面还远不如禾本科植物成熟,例如,水稻、小麦等。通过本试验研究,旨在明确矮牵牛花药培养技术的最佳培养条件、总结有关花药培养中的影响因素和培养过程中应注意到的问题。
1 材料与方法
1.1 试验材料选择
以矮牵牛“梅林系列”红色品种为试验材料。于晴天上午10时从健壮无病毒的植株中采集花蕾,首先对小孢子发育时期进行观察,通过醋酸洋红染色,再进行压片镜检,确定小孢子的发育时期与花蕾直径的相关性。选取小孢子发育时期处于单核靠边期的花蕾做试验,花蕾直径在1.5~2.0mm。
1.2 培养基与培养条件
MS、B5、N6 基本培养基与 2,4-D 、6-BA、NAA、IBA、IAA等生长调节剂按照不同比例混合,部分培养基中需加入琼脂和麦芽糖,培养基pH值为5.8。培养室温度为25±2℃,愈伤组织的诱导需要暗培养,愈伤组织分化的光照周期为14h/d,光照强度为3000lx。
1.3 预处理与接种
首先剥去花萼,用1 mol/L的HCL处理60s后用流水清洗数遍,再用70%乙醇浸泡2 min,流水冲洗干净。用无菌蒸馏水冲洗3次,大约15 min。将处理后的花蕾剪下,放在4℃的恒温冰箱中冷藏,冷藏时间设置4组对照,即12h、24h、48h、72h。之后在干净无菌的实验台上,使用70%的酒精处理花蕾1 min,无菌水冲洗3次(约15 min)。最后用0.1%的HgCl2消毒,消毒时间设置 4组对照,即 6min、8min、10min、12 min,无菌水冲洗 5次(约30 min),后用吸水纸吸干花蕾表面的水分。接种前使用灭菌后的解剖刀或镊子小心地剥去花瓣,取出花药,去除花丝。将花药散落接种到诱导培养基上,诱导培养基设置3种,即MS、B5、N6且与不同浓度的生长调节剂、琼脂和麦芽糖混合配制,每个平皿中接种10个花药,每个处理接种5瓶,用parafilm封口膜封好平皿,进行暗培养。每7d观察一次愈伤组织的诱导情况,30d后统计最佳诱导培养基的诱导率。
1.4 愈伤组织的分化
愈伤组织诱导完成后,需在新配置的培养基(即3种基本培养基与生长调节剂混合配置)中进行光培养,每个瓶皿中接种5块愈伤组织,每处理接种10瓶。每10d观察一次愈伤组织的分化情况,30d后统计最佳分化培养基的分化率。
2 结果与分析
2.1 花蕾直径与小孢子发育阶段的关系
通过压片镜检可观察出:当花蕾直径≤1.5mm时,小孢子处于四分体时期,此时的花药呈绿色扁平状;花蕾直径在1.5~2.0mm时,小孢子处于单核靠边时期,此时的花药呈绿色略饱满状,适合做培养材料;当花蕾直径≥2.0mm时,小孢子处于双核时期,此时的花药逐渐变成黄色呈饱满状。
2.2 冷藏时间对愈伤组织诱导率的影响
接种前,对花药进行低温预处理,有利于提高愈伤组织的诱导率。试验表明,随着冷藏时间的增加,诱导率呈先升高后降低的趋势。在4组对照组中,冷藏48h后的诱导率最高,达27.54%。48h后诱导率降低的原因可能是花药失水受损而导致营养物供不应求。
2.3 0.1%HgCl2的消毒时间对花蕾污染的影响
对花蕾进行HgCl2灭菌消毒,可减少污染、预防花药受损。试验结果显示消毒时间与花蕾的污染率呈反比,最终可达到零污染的效果。但是HgCl2存在毒性,对花蕾作用时间过长会毒害细胞。消毒10 min为最佳灭菌时间,此时的污染率基本降低到10%左右,污染率较低且对细胞基本无损伤,也可保护花药免受污染。
2.4 不同碳源对愈伤组织诱导及分化的影响
不同种类的培养基中分别添加蔗糖、麦芽糖、白砂糖作为碳源,对比愈伤组织诱导及分化效果好的碳源种类与浓度。试验得出麦芽糖对提高愈伤组织的诱导率最明显,当麦芽糖的浓度为20g/L时的诱导率为29.02%,其次是蔗糖,而白砂糖的效果不佳。
2.5 不同基本培养基对愈伤组织诱导及分化的影响
培养基的种类对花药愈伤组织的诱导、分化起着重要的作用。本试验通过对N6、B5、MS三种基本培养基的比较研究,筛选确定出最适合诱导出愈伤组织的培养基N6,其诱导率最高,而B5培养基的诱导率则不是很明显,MS培养基的诱导率比较适中。对于最适分化培养基的选择,试验表明MS基本培养基比N6基本培养基的分化率高,愈伤组织的分化效果明显。
2.6 参与配制的生长调节剂的种类与浓度对诱导率及分化率的影响
生长调节剂是通过很低的浓度来促进或抑制植物生命活动中的某些过程,所以往往起到量小作用大的效果,本试验中所用到的生长调节剂包括:生长素2,4-D、IBA、IAA,细胞分裂素6-BA、NAA。在比较不同浓度的生长调节剂组成中,发现对于愈伤组织诱导培养基的最佳组合为N6+1.5mg/L 6-BA+1.0mg/L IBA其诱导率可达36.82%,此时其基部可产生大量的愈伤组织;而对于分化培养基的最佳组合为MS+0.5mg/L 6-BA+0.2mg/L IBA其分化率可达43.75%,此时愈伤组织分化出芽量较高并且可保持褐化量较少。诱导培养基与分化培养基的配制方法,见表1及表2。
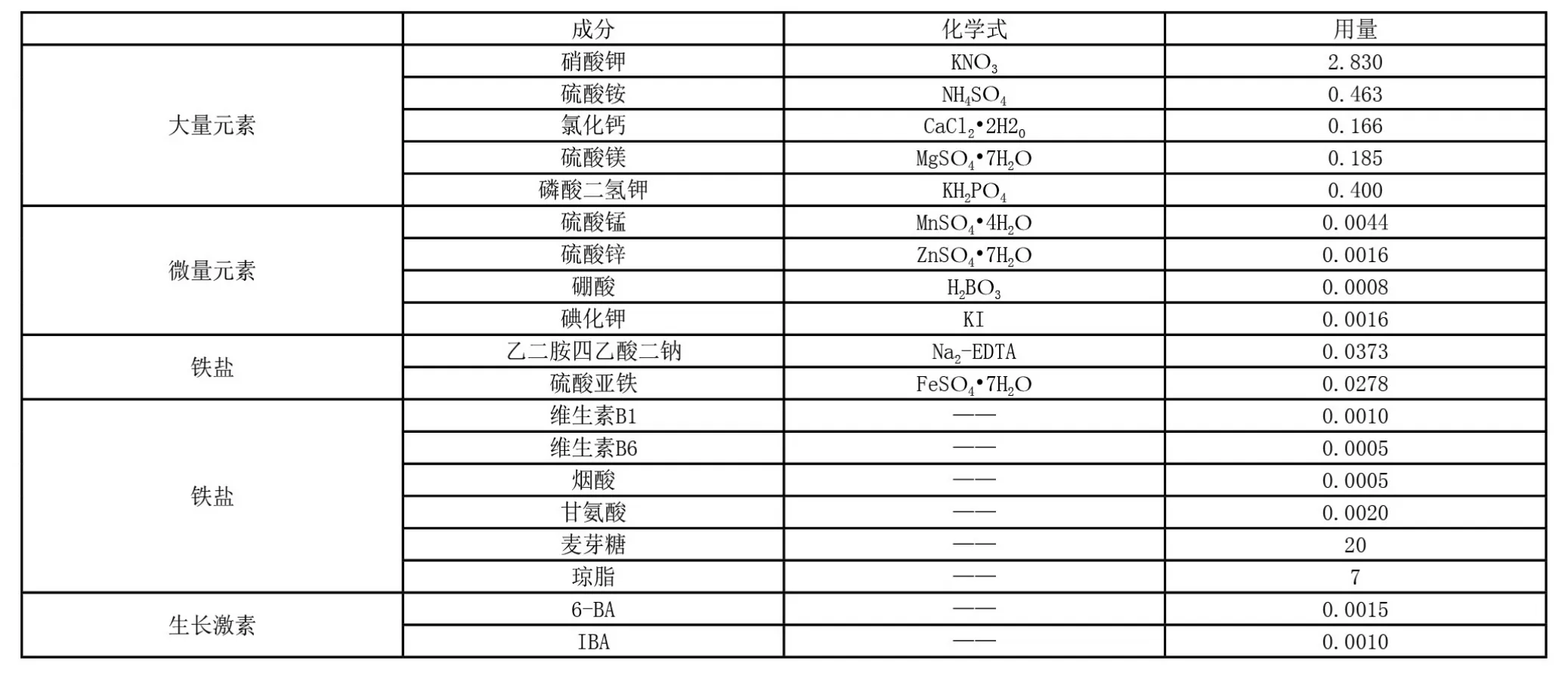
表1 N6诱导培养基配方(单位:g/L)
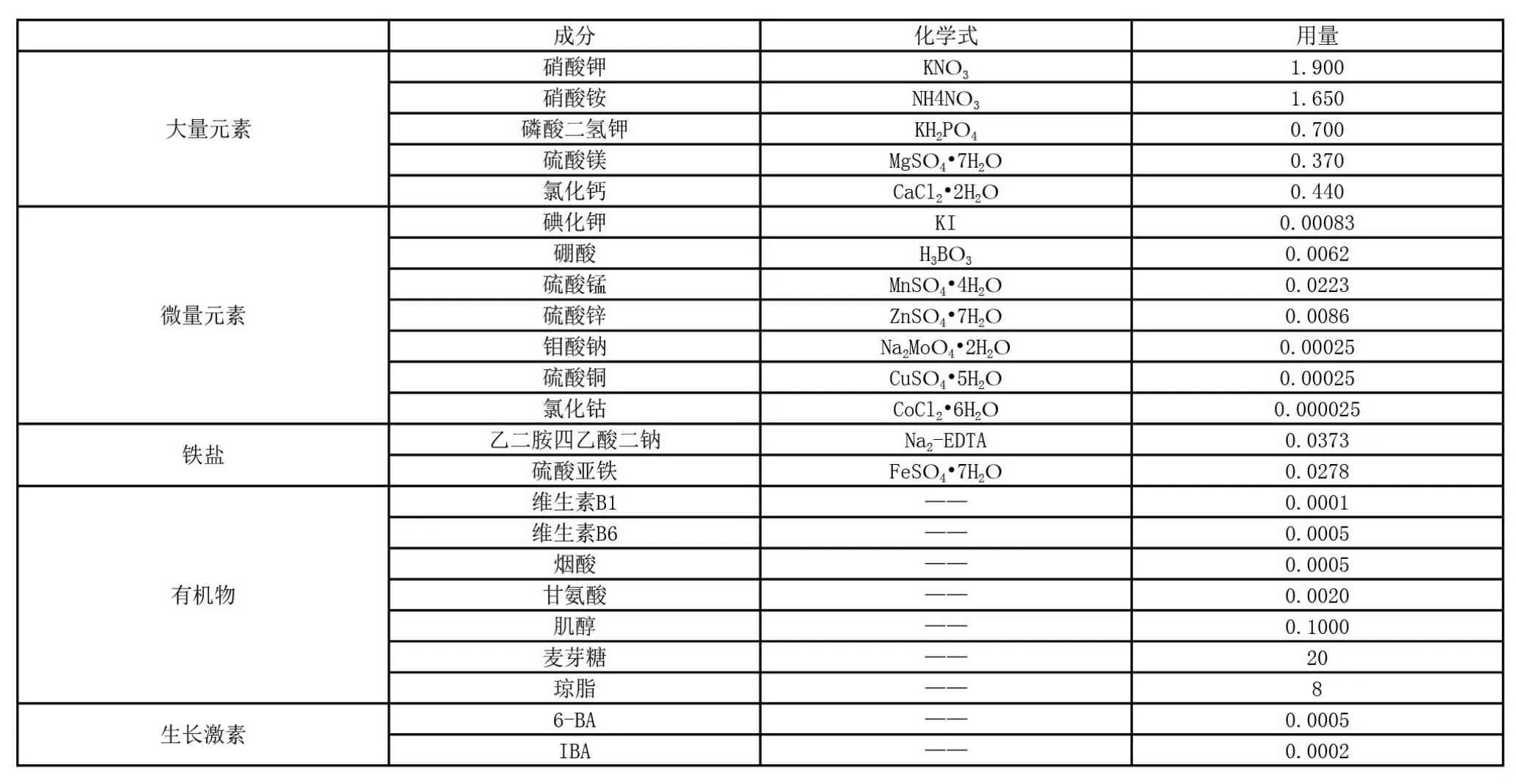
表2 MS分化培养基配方(单位:g/L)
试验表明,生长调节剂的浓度不能过高,当其超出一定值时就会抑制愈伤组织的诱导效果或分化效果。如细胞分裂素6-BA对提高愈伤组织的诱导率有显著的效果,但是当其浓度高于1.5mg/L时又会抑制愈伤组织的形成。
3 结论
本试验通过一系列的对照研究,确定出矮牵牛花药培养的诱导培养基与分化培养基的培养配方。其中,在培养过程中起重要作用的有对花药的选择方面、对花药接种前的处理方面,以及对培养基配制中各成分与浓度剂量的确定方面。研究得出:花蕾直径在1.5~2.0mm的花药处于单核靠边期的较好;预处理中,冷藏温度在4℃、时间在48h,灭菌时间在10min为宜;培养基中的碳源选择麦芽糖对提高愈伤组织的诱导率效果比蔗糖和白砂糖明显;生长调节剂针对不同作用的培养基的选择和浓度确定是不同的,诱导培养基中需1.5mg/L 6-BA、1.0mg/L IBA,分化培养基中则需0.5mg/L 6-BA、0.2mg/L IBA。
矮牵牛花药培养成功的关键在于培养过程中的无菌操作。一是保证花药的无菌获取,即在对花蕾进行预处理消毒灭菌时,应保持实验台的超净无菌。而且牵牛花的花蕾表面包被短绒毛,易受污染,所以应保证对花蕾或花药进行转移时周围环境的洁净无菌、无污染;二是保证对诱导后的愈伤组织进行分化培养基转移时的无菌操作。
不同梯度的对比试验组是研究有关影响因素的重要方法,其中涉及控制唯一变量的原则,以及试验现象的定期观察、试验结果的判断与数据计算。本试验中涉及到数据计算包括:诱导率=成功诱导的愈伤组织数量/接种花药的数量;分化率=成功分化的愈伤组织数量/接种愈伤组织的数量。
一是花药培养可实现矮牵牛花的快速培育、缩短其繁殖周期,但仍存在繁殖率低的问题。主要原因在于部分花胚的发生率较低,从而降低了其应用价值,所以有待于针对其基因方面进行深入研究;二是在小孢子的发育调控机理方面的研究还不够成熟,若能明确此方面的机理,将有助于进行对目的性状的筛选,可增加定向突变;三是花药培养过程难免会受矮牵牛植物本身的体细胞影响,可通过适当的改变生长调节剂的种类和碳源的浓度来减缓其影响,但对于解决问题的关键仍需进一步的深入研究。
