笃斯越桔花色苷提取工艺的研究
2019-04-14勾智丽
勾智丽
(扎兰屯职业学院林业工程系,内蒙古 呼伦贝尔 162650)
笃斯越桔花色苷的提取方法主要包括溶剂提取法、微波辅助提取法、超声波辅助提取法等。溶剂提取法是应用最广泛的方法,在破坏植物细胞壁和细胞膜的同时使花色苷溶出。微波和超声波辅助提取法都是在溶剂提取法的基础上辅以微波和超声波的作用来提高提取效率[1]。这3种方法,所用的提取溶剂组成和配比种类很多,但是这些溶剂体系对越桔果实花色苷的提取效率未曾进行过系统的分析比较。为了更客观地评价越桔果实中花色苷的含量和抗氧化活性,研究将致力于分析比较花色苷提取中的几个关键点:破碎方式、溶剂体系和提取方式的选择,然后对笃斯越桔花色苷的提取工艺进行优化。
1 试验材料与方法
1.1 试验材料
1.1.1 花色苷提取工艺原料 选用水湿地土型生境类型采摘的野生笃斯越桔果实作为原料,采集地点位于大兴安岭北部林区,地理坐标为124°25′ E,51°43′ N,海拔为512 m。在相同的立地条件下随机抽取30株植株,每株采集3个结果穗,将采集的果实混合。
1.1.2 标样 二甲花翠素-3-O-葡萄糖苷,试剂:甲醇、乙醇、盐酸、乙酸均为分析纯试剂。
1.1.3 使用仪器 SHA-CA型水浴振荡器、JJ-2型组织捣碎机、UV-2800A型紫外分光光度计、DT5-2B型离心机、SL-N系列电子天平、QL-90型漩涡混合器、RE-52型旋转蒸发仪、SHB-Ⅲ型循环水式多用真空泵、LGJ-19S型冷冻干燥机、JY99-IIDN型超声波仪。
1.2 试验方法
1.2.1 花色苷含量的测定方法 采用示差法[2],并略加改进。花色苷提取液分别与0.025 mol·L-1的NaCl缓冲液(pH=1)和0.4 mol·L-1的CH3COONa缓冲液(pH=4.5)以1/8(V/V)的比例混合,与NaCl缓冲液混合的样品利用分光光度计在400~750 nm的波长范围内扫描,用以确定其最大吸收波长λvis-max,每个花色苷提取样品均在λvis-max和700 nm的波长下读取吸光值。所有样品在配制15 min后测定,并在1 h内完成。将吸光值换算为花色苷含量(TAC),表示为每100 g鲜果中二甲花翠素-3-O-葡萄糖苷(MGE)的含量(mg)。计算公式如下:
TAC=A×MW×DF×V×105/(ε×L×M)
A= (Avis-max-A700)pH1.0-(Avis-max-A700)pH4.5
式中:A—吸光值;MW—二甲花翠素-3-O-葡萄糖苷的摩尔质量493 mol·g-1;ε—二甲花翠素-3-O-葡萄糖苷的摩尔吸光系数21200;L—液层厚度1 cm;M—原料鲜果质量g。
1.2.2 果实破碎方式的确定 分别利用匀浆法和液氮研磨法对越桔果实进行破碎,比较分析两种方法处理后果实花色苷提取效率。
匀浆法:将一定量的越桔果实放入组织捣碎机中,以物料没过搅拌旋叶为准,匀浆10 min,取出匀浆的原料并混合均匀,从中称取1 g放入50 mL三角瓶中,再加入10 mL不同的溶剂体系,放在水浴振荡器内以250 rpm室温下避光提取1 h,离心取上清液,测定花色苷含量。每次实验均采用3个平行样品。
液氮研磨法:液氮磨制样品是分子生物学实验中常用的方法,如果将其应用于活性成分的提取,不但可以消除高温和氧气的不利影响,还可以保证良好的均细度[3]。将一定量的越桔果实放入研钵,并在液氮中研磨,称取1 g放入50 mL三角瓶中,再加入10 mL不同的溶剂体系,放入水浴振荡器内以250 rpm室温下避光提取1 h,离心取上清液,测定花色苷含量。每次实验均采用三个平行样品。
1.2.3 溶剂体系的确定 针对甲醇和乙醇系列溶剂提取花色苷的效率进行比较分析,包括甲醇(M)系列:M1-甲醇/水(65∶35,V/V)、M2-甲醇/水(80∶20,V/V)、M3-甲醇/水/乙酸(80∶19∶1,V/V)、M4-甲醇/水/盐酸(80∶19∶1,V/V);乙醇(E)系列:E1-乙醇/水(65∶35,V/V)、E2-乙醇/水(80∶20,V/V)、E3-乙醇/水/乙酸(80∶19∶1,V/V)、E4-乙醇/水/盐酸(80∶19∶1,V/V)。精确称取1 g以不同方式破碎的果实样品,加入含有10 mL溶剂的50 mL三角瓶中,放在水浴振荡器内以250 rpm室温下避光提取1h,离心取上清液,分别测定花色苷含量。每次实验均采用三个平行样品。
1.2.4 提取方式和提取次数的确定 精确称取1 g果实样品(按选定方法破碎),加入10 mL选定的溶剂体系,分别利用溶剂浸提法和超声辅助提取法提取花色苷。溶剂浸提法:放入水浴振荡器(250 rpm)内室温下避光提取1 h;超声辅助提取法:放入超声波仪内避光提取20 min,离心取上清液。残渣按上述方法再提取3次,分别测定花色苷含量。每次实验均采用三个平行样品。
1.2.5 笃斯越桔花色苷提取工艺参数优化 确定最佳的破碎方法、溶剂体系和提取方式后,对料液比、提取时间、功率等进行单因素试验,最后通过正交试验设计确定最佳提取工艺参数。单因素和正交试验中每个试验均重复3次。每次实验均采用三个平行样品。
1.3 统计分析
所得的实验数据均以三个平行样品的平均值±标准偏差来表示,利用Microsoft Excel 2007和SPSS 16.0进行数据统计分析。方差分析利用Student Newman Keuls法,置信区间为95%,图表中表示的不同英文小写字母表示同一项目的数据结果存在显著差异。
2 结果与分析
2.1 破碎方式和溶剂体系对笃斯越桔花色苷提取效率的影响
不同破碎方式和溶剂体系提取所得的花色苷含量如图1所示。无论用哪种溶剂体系进行花色苷的提取,笃斯越桔鲜果经液氮研磨后所得的提取液中花色苷含量明显高于经匀浆破碎的样品。与传统的匀浆破碎方法相比,液氮研磨破碎平均可从鲜果中多提取花色苷36.59 mg·(100 g)-1,即增加了10%的提取率。主要原因一是液氮磨样能保证良好的粒度均一性,且颗粒较细,二是花色苷对温度敏感,机械破碎会产生的热能使样品温度升高,导致花色苷部分降解,液氮研磨保证了样品在低温环境下破碎,可有效防止花色苷降解,并能保持其生物活性。Xu等指出液氮破碎处理可显著提高葡萄果实中酚类物质的提取率[4],对于蓝莓鲜果,本研究也得到了相同的结果,由此说明在实验室条件下液氮研磨预处理可显著提高原料中生物活性物质的提取效率。
提取花色苷的溶剂经常为酸化甲醇或乙醇的水溶液。根据相似相溶原理,甲醇或乙醇与水混合的溶剂系统大于纯的有机溶剂,当溶剂的极性增大到与花色苷极性相近时,可以溶解出更多的花色苷。而花色苷在酸性环境中更稳定,所以一般在溶剂体系中加入弱酸或强酸来降低pH值。在本试验中,甲醇溶剂系统和乙醇溶剂系统对于花色苷的提取率并无显著差异,M4-甲醇/水/盐酸(80∶19∶1,V/V)和E4-乙醇/水/盐酸(80∶19∶1,V/V)的提取率最高,液氮研磨后样品提取液中花色苷含量分别为478.75和480.42 mg·(100 g)-1,而M1-M3和E1-E3溶剂系列的花色苷提取率不存在统计学上的显著差异。这说明乙酸在提高花色苷提取效率上作用不明显,而盐酸却起着重要作用,主要原因为等浓度盐酸使溶剂体系的pH值变得更低,有效地保护了花色苷免受氧化和降解,从而提高了提取效率。由于提取得到的花色苷一般作为保健食品等的添加成分,考虑到安全性问题,我们在以下实验中均采用E4乙醇溶剂体系。
2.2 提取方式和提取次数对笃斯越桔花色苷提取效率的影响。
提取方式和提取次数对花色苷提取效率的影响如图2所示,总体来看,连续20 min超声波辅助提取比连续1 h溶剂浸提(加以机械震荡)的花色苷提取效率高,相同体积提取液花色苷的含量平均增加了26.72 mg·(100 g)-1。对于这两种提取方法,第一次提取产量分别占总提取产量的91%和92%,重复提取三次均可达到最高产量,分别为513.54和539.56 mg·(100 g)-1,证明三次连续提取基本可将花色苷全部提取出来。超声波主要利用其强大的空化相应、强烈的震荡、较高的加速度等破坏植物原料的细胞壁,促使细胞中的内容物溶出,提高提取效率。但超声辅助提取特别需要注意的是,长时间超声作用产生的热能可能使水浴温度高于60 ℃,这会造成花色苷化合物的降解[5],为了避免这一现象,在超声波仪内的水槽中加入了一定量的冰块,使水浴温度一直保持在较低水平,来避免花色苷的降解。

图1 不同破碎方式和溶剂体系对笃斯越桔花色苷提取效率的影响

图2 不同提取方式和提取次数对笃斯越桔花色苷提取率的影响
2.3 超声辅助提取笃斯越桔花色苷工艺优化
根据以上实验结果,选择乙醇/水/盐酸(80∶19∶1,V/V)的溶剂体系进行超声辅助提取笃斯越桔果实花色苷的单因素实验和正交实验,每次实验都重复提取3次。
2.3.1 单因素实验

图3 超声辅助提取笃斯越桔花色苷的单因素实验(a.料液比;b.超声功率;c.提取时间)
对于相同的原料质量,溶剂体积越大,花色苷的提取效率越高,主要原因是溶剂体积的增加能提高分子扩散速率并缩短平衡时间。花色苷的提取效率从1∶5料液比的366.97 mg·(100 g)-1升高到1∶30料液比的478.54 mg·(100 g)-1(图a)。但从统计学上看,1∶20的料液比已经使笃斯越桔果实花色苷的提取效率达到了最高,再增加溶剂的体积(1∶25和1∶30)也没有使花色苷的提取效率显著提高。
超声波产生的强烈震动和空化效应能够使植物细胞内的花色苷分子快速溶解于溶剂中,提高提取效率。随着超声功率的升高,花色苷的提取效率也随之升高,从400 W时的382.34 mg·(100 g)-1升高到800 W时的481.56 mg·(100 g)-1,但600 W、700 W和800 W的花色苷提取效率并不存在显著差异(图b)。
提取时间越长,提取越充分,提取时间为25 min时花色苷的提取效率为481.45 mg·(100 g)-1,已达到了最高,再延长提取时间,花色苷的提取效率也没有明显地升高(图c)。张华等指出,花色苷容易发生氧化和降解,提取时间过长杂质会越多[6],所以超声时间不宜过长。
2.3.2 正交实验 根据单因素的实验结果,超声辅助提取笃斯越桔花色苷的三个因素料液比、超声功率和提取时间分别选择1∶20、600 W和25 min为中间水平,为了更准确地优化提取工艺,各因素水平的取值范围也进行了适当的缩小。
微波辅助提取笃斯越桔花色苷的正交实验设计表和结果如表1所示,由极差R可知,3个因素对提取效率影响的主次顺序为料液比>超声功率>提取时间。根据正交试验结果分析得知,最佳提取条件为A3B3C2,即以1∶24的料液比、650 W的超声功率和25 min的提取时间,提取3次,笃斯越桔鲜果的花色苷提取效率最高,为492.72 mg·(100 g)-1。
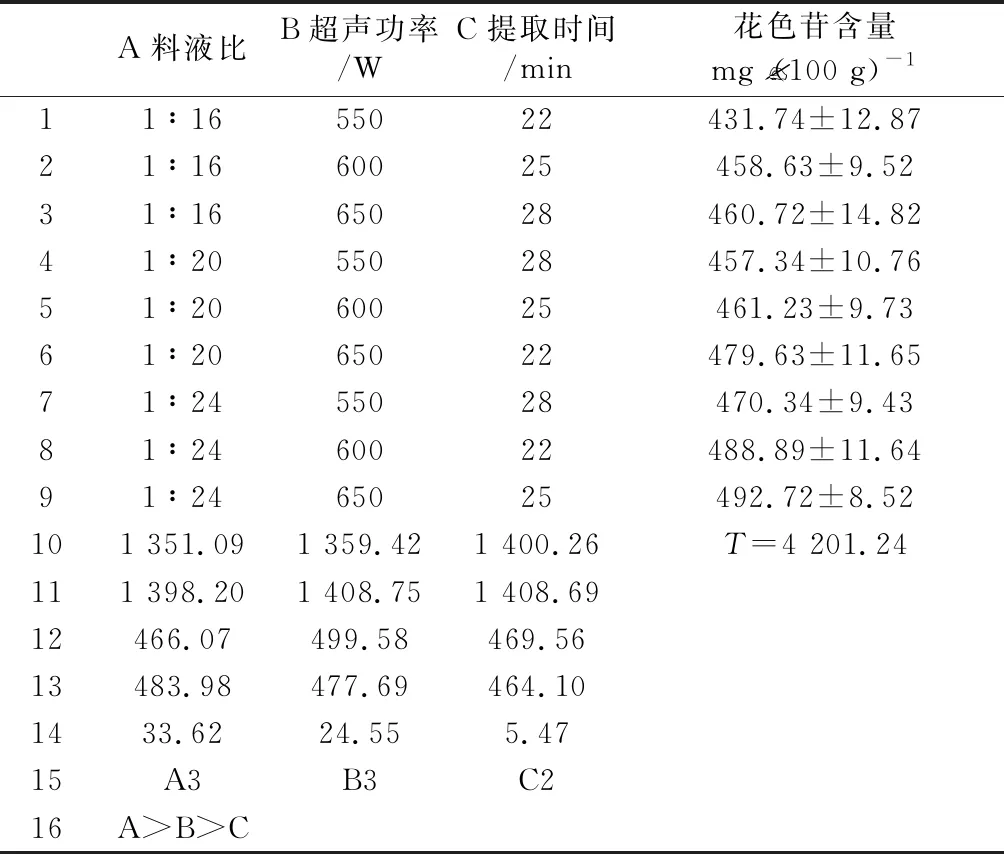
表1 超声波辅助提取笃斯越桔花色苷的因素水平
3 小结
以大兴安岭地区采集的水湿地有土类型的野生笃斯越桔果实为试验材料,对越桔果实花色苷的提取工艺进行研究。对影响越桔花色苷提取效率的几个关键因素,即果实破碎方式、提取溶剂体系、提取方式和提取次数的分析结果表明:
(1)液氮研磨后越桔花色苷的提取效率明显高于传统的匀浆破碎处理;
(2)利用乙醇/水/盐酸(80∶19∶1,V/V)溶剂体系提取花色苷的效率高且不存在安全性问题,连续3次超声辅助提取的效果较好;
(3)对超声辅助提取越桔花色苷工艺的优化结果表明料液比1∶25、超声功率650 W和提取时间25 min时,经3次提取,水湿地有土类型笃斯越桔鲜果的花色苷提取效率最高,为492.72 mg·(100 g)-1。
